扩展功能
文章信息
- 张强, 刘士博, 杨军星, 韩佳岐, 宋立杰, 徐一驰, 王瑶, 赵楚翘, 王博蔚, 刘志辉
- ZHANG Qiang, LIU Shibo, YANG Junxing, HAN Jiaqi, SONG Lijie, XU Yichi, WANG Yao, ZHAO Chuqiao, WANG Bowei, LIU Zhihui
- 载VEGF/VAN多层海藻酸盐-壳聚糖缓释微球的制备
- Preparation of multilayer alginate chitosan microspheres loading VEGF and vancomycin
- 吉林大学学报(医学版), 2017, 43(04): 839-844
- Journal of Jilin University (Medicine Edition), 2017, 43(04): 839-844
- 10.13481/j.1671-587x.20170434
-
文章历史
- 收稿日期: 2016-11-08
2. 民航总医院口腔科, 北京 100123;
3. 吉林大学第二医院妇产科, 吉林 长春 130041
2. Department of Stomatology, Civil Aviation General Hospital, Beijing 100123, China;
3. Department of Obstetrics and Gynecology, Second Hospital, Jilin University, Changchun 130041, China
微球和微囊作为药物缓释载体可根据临床的需要设计成不同的给药形式,具有广阔的应用前景,目前对微球和微囊的研究依然是国内外学者关注的热点[1-2]。随着各种药物体系的开发,人们越来越青睐于使用天然产物[3]。
海藻酸钠是一种从褐藻(如海带、马尾藻)中提取出来的多糖碳水化合物,聚阴离子高分子,侧链结构中含有游离羧基,与钙离子在室温下即可交联,生成具有蛋壳式结构的海藻酸钙微球。海藻酸盐具有良好的生物相容性、生物黏附性和天然无毒、可降解等特性,如今已作为药物载体被广泛研究[4-6]。壳聚糖为聚阳离子高分子,侧链结构中含有游离氨基,海藻酸盐与壳聚糖可通过正负电荷相互吸引发生反应并形成聚电解质复合物。反应形成的微囊可增加其凝胶性能,克服海藻酸盐单独作为释放药物载体时凝胶溶蚀现象严重、药物释放过快及力学性能差的缺点[7-10]。由海藻酸盐和壳聚糖制得的海藻酸盐-壳聚糖复合微球已用于免疫和癌症等研究[11-13]。
组织工程骨由种子细胞、细胞因子和支架材料构成。前期的研究[14]介绍了一种载血管内皮生长因子(vascular endothelial growth factor, VEGF)和万古霉素(vancomycin, VAN)的多层缓释微球制剂及其制备方法,其为负载VEGF和VAN 2种药物的以海藻酸盐和壳聚糖为载体的多层核壳型缓释微球,制备工艺简单,缓释效果良好。但由于其核心球使用滴注交联法制备导致粒径较大,达500μm以上,故在应用上受到组织工程骨支架材料孔隙大小的限制。
本文作者在前期工作的基础上,以氯化钙(CaCl2)作为交联剂,应用乳化交联法制备核心球,制备具有控制释放功能的负载VEGF和VAN的粒径较小[15-16]的海藻酸盐-壳聚糖微球,使其同时具有促进血管再生和抗感染的作用[17],并研究微球的体外释放特性,旨在为骨修复提供一个新思路。
1 材料与方法 1.1 主要试剂和仪器试剂:海藻酸钠(黏度为20mPa·s)和壳聚糖(脱乙酰度80.0%~95.0%,黏度为50~800mPa·s),国药集团化学试剂有限公司;海藻酸钠(黏度为5mPa·s),青岛海之林公司;异辛烷和吐温80,天津市光复精细化工研究所;span80,天津市福晨化学试剂厂;CaCl2、无水乙醇和柠檬酸钠,分析纯,北京化工厂;冰醋酸,分析纯,西陇化工股份有限公司;VAN,效价906.3IU,美国Biosharp公司;VEGF及其酶联免疫吸附ELISA试剂盒,美国PeproTech公司。
仪器:NicoletFT-IR360型傅里叶变换红外光谱仪(美国Thermo公司),SU8020型冷场发射扫描电子显微镜(SEM)(日本HITACH公司);InfiniteM200PRO型多功能酶标仪(瑞士Tecan公司),UV-4802H型紫外分光光度计(美国UNICO公司),Genex系列移液器[BIO-DL(中国)有限公司],ALPHA1-2LD型冷冻干燥机(德国Marin Christ公司),高速离心机(美国BECKMAN仪器公司),85-2型恒温磁力搅拌器(上海志威电器有限公司)。
1.2 微球的制备参照文献[18],利用乳化法制备海藻酸钙核心球:配制一定浓度海藻酸钠(黏度为20mPa·s)溶液(每20mL溶液含0.8μg VEGF)和含一定浓度span80的异辛烷溶液;高速搅拌下,将海藻酸钠溶液缓慢加入异辛烷溶液中,10min后滴加2mL吐温80水溶液,调节亲水疏水平衡(HLB)值,继续乳化5min后,滴加CaCl2水溶液,交联凝胶化形成海藻酸钙微球,搅拌固化10min后,加入10mL无水乙醇分离微球;静置一段时间后离心分离微球,用无水乙醇、蒸馏水依次洗涤。
将50mgVAN溶于30mL浓度为1.5%的壳聚糖溶液(壳聚糖溶于2%醋酸溶液)中, 在搅拌条件下加入海藻酸钙核心球,400r·min-1搅拌10min,5000r·min-1离心并用无水乙醇、蒸馏水依次洗涤制备海藻酸钙-壳聚糖微球。
将0.15g海藻酸钠(黏度为5mPa·s)溶于30mL蒸馏水,将上述海藻酸钙-壳聚糖微球加入海藻酸钠溶液中,400r·min-1搅拌10min,5000r·min-1离心并用无水乙醇、蒸馏水依次洗涤制备海藻酸钙-壳聚糖-海藻酸微球。
将50mgVAN溶于30mL浓度为1.5%的壳聚糖溶液(壳聚糖溶于2%醋酸溶液)中,在搅拌条件下,将海藻酸钙-壳聚糖-海藻酸微球加入,400r·min-1搅拌10min,5000r·min-1离心并用无水乙醇和蒸馏水依次洗涤得海藻酸钙-壳聚糖-海藻酸-壳聚糖微球(双重载药多层包覆微球)。
1.3 正交设计优化配方利用正交实验设计9组优化配方,制备核心球的海藻酸钠溶液浓度(Factor A)、CaCl2溶液浓度(Factor B)、油水比(Factor C)和span80浓度(Factor D)4个因素作为考查对象,采用SPSS13.0统计软件进行正交实验设计并进行极差分析,各因素及水平见表 1。
| Level | Factor | |||
| A [ρB/(g·mL-1)] |
B [ρB/(g·mL-1)] |
C | D (η/%) |
|
| 1 | 1. 0 | 6 | 1:1 | 2 |
| 2 | 1.5 | 7 | 2:1 | 4 |
| 3 | - | 8 | 3:1 | - |
| “-”:No data. | ||||
取适量微球样品,SEM下观察其分布形态,采用ImagePro plus及Origin8.0软件进行粒径分析。
1.5 VEGF和VAN标准曲线的绘制VEGF标准曲线根据ELISA试剂盒说明绘制;VAN标准曲线绘制:称量一定质量VAN配制标准溶液, 其质量浓度梯度为0~1g·L-1, 用紫外分光光度计测定VAN溶液在190~600 nm处的紫外光谱图, 确定最大吸收峰波长为291nm。在此波长下,测定标准溶液的吸光度(A)值, 绘制标准曲线。
1.6 微球包封率(EE)和载药量(DL)的测定称取适量双重载药多层包覆微球,加适量柠檬酸钠溶液,使微球破囊,所有药物充分溶解后,取上清液定容至25mL容量瓶中摇匀,ELISA试剂盒测定VEGF浓度,紫外分光度计法测定VAN的A值,并根据标准曲线计算其浓度,按以下公式计算2种药物的EE和DL:EE=(微球中药物含量/初始投药量)×100%,DL=(微球中药物含量/微球总重量)×100%。
1.7 体外释放实验检测微球的累积释放率称取适量双重载药多层包覆微球浸泡于25mL PBS缓冲液(pH=7.4) 中。分别于0.5、2.5、4.5、6.5、8.5、10.5、12.5和16.5d抽取适量上层清液待测,吸出全部剩余上清液,同时补入25mL新鲜PBS缓冲液。测定VEGF和VAN浓度,计算释放率,并绘制累积释放率-时间曲线。累积释放率(%)=(药物累积释放量/药物含量)×100。
2 结果 2.1 微球的形态和粒径海藻酸钠浓度为1g·mL-1、CaCl2浓度为8 g·mL-1、油水比为1:1和span80质量分数为4%时制备的微球SEM下观察可见:微球分散性和球形度好,较为圆整,表面光滑(图 1)。使用ImagePro plus软件对微球粒径进行分析:微球粒径范围较窄,多为30~80μm,平均值为56μm(图 2)。

|
| 图 1 多个(A)和单个(B)微球SEM图 Figure 1 SEM images of multiple (A) and single (B) microspheres |
|
|
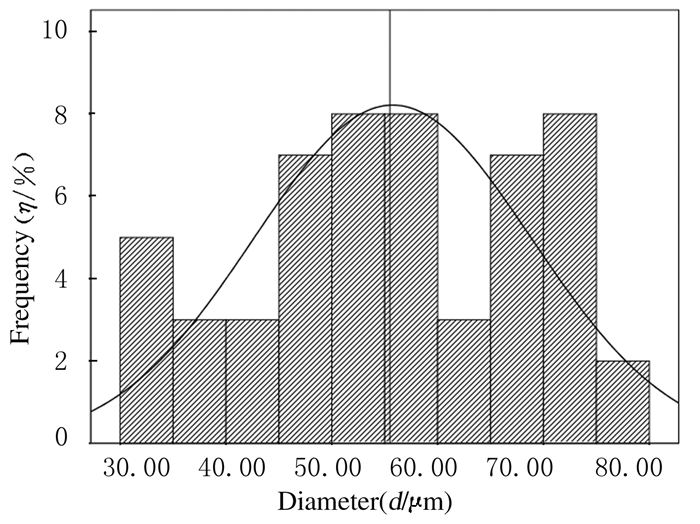
|
| 图 2 微球粒径分布图 Figure 2 Size distribution of microspheres |
|
|
对海藻酸钠(a)、壳聚糖(b)和载药微球(c)进行红外光谱分析。1616.34cm-1是海藻酸钠羰基对称伸缩振动的吸收谱带。在海藻酸盐/壳聚糖复合微载体中,出现了1个1617.71cm-1的红外吸收特征峰,为微球自组装后壳聚糖新形成的-NH3+反对称变形振动吸收峰和海藻酸的羰基吸收峰的重叠峰。其中羰基吸收峰由原来的1616.34cm-1向高波数移动了约2cm-1,表明壳聚糖分子链上的氨基与海藻酸分子链上的羧酸盐官能团存在很强的静电相互作用。3398.74cm-1处是N-H和O-H伸缩振动的吸收谱带,反映了壳聚糖分子中羟基和氨基之间的氢键作用情况,在海藻酸盐/壳聚糖复合微球中,此谱带向高频移动了约10cm-1至3407.73cm-1,说明复合微球中羟基和氨基之间的氢键作用有所减弱,这是由于壳聚糖与海藻酸分子链间存在很强的静电相互作用,从而破坏了壳聚糖的分子内与分子间氢键作用。见图 3。
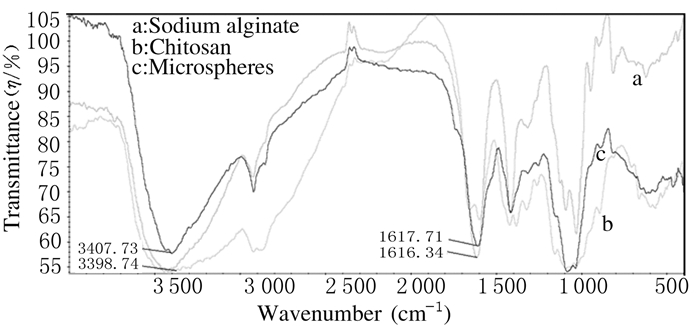
|
| 图 3 海藻酸钠、壳聚糖和微球的红外扫描图 Figure 3 IR spectra of sodium alginate, chitosan and microspheres |
|
|
各组微球EE和DL见表 2。各组微球VEGF的EE均较高,为22.74%~49.63%,VAN的EE相对较低,为10.22%~16.67%。不同因素不同水平正交设计结果的极差分析见表 3。对VEGF的EE影响大小排序为B > C > A > D,对VAN的EE影响大小排序为C > B > D > A,对VEGF的DL影响大小排序为B > C > A > D, 对VAN的DL影响大小排序为B > A > C >D。结合表 2和表 3中的数据综合考虑,海藻酸钠浓度为1.0 g·mL-1、CaCl2浓度为8 g·mL-1、油水比为3:1和span80浓度为2%时为最佳配方,此时VEGF和VAN的EE均较高。
| (η/%) | ||||||||||
| Group | Factor | EE | DL | |||||||
| A | B | C | D | VEGF | VAN | VEGF(×10-4) | VAN | |||
| 1 | 1 | 2 | 3 | 1 | 29.85 | 14.41 | 1.09 | 6.60 | ||
| 2 | 1 | 3 | 1 | 2 | 40.32 | 14.31 | 1.48 | 6.56 | ||
| 3 | 2 | 1 | 3 | 2 | 35.06 | 16.67 | 0.87 | 5.20 | ||
| 4 | 2 | 3 | 2 | 1 | 40.00 | 11.48 | 1.08 | 3.89 | ||
| 5 | 2 | 2 | 1 | 1 | 45.18 | 10.98 | 1.07 | 3.26 | ||
| 6 | 1 | 3 | 3 | 1 | 49.63 | 14.55 | 1.61 | 5.92 | ||
| 7 | 1 | 1 | 1 | 1 | 32.33 | 14.47 | 2.61 | 14.58 | ||
| 8 | 1 | 1 | 2 | 1 | 27.71 | 11.18 | 1.39 | 7.02 | ||
| 9 | 1 | 2 | 2 | 2 | 22.74 | 10.22 | 1.04 | 5.85 | ||
| (η/%) | |||||||||||||||||||
| Factor | EEofVEGF | EE of VAN | DLofVEGF(×10-4) | DL of VAN | |||||||||||||||
| K1 | K2 | K3 | R | K1 | K2 | K3 | R | K1 | K2 | K3 | R | K1 | K2 | K3 | R | ||||
| A | 33. 76 | 40. 08 | - | 6. 32 | 13. 19 | 13. 04 | - | 0. 15 | 1. 54 | 1. 03 | - | 0. 51 | 7. 76 | 4. 36 | - | 3. 40 | |||
| B | 31. 70 | 32. 59 | 43. 32 | 11. 62 | 14. 11 | 11. 87 | 13. 45 | 2. 24 | 1. 62 | 1. 07 | 1. 39 | 0. 56 | 8. 93 | 5. 24 | 5. 46 | 3. 70 | |||
| C | 39. 28 | 30. 15 | 38. 18 | 9. 13 | 13. 25 | 10. 96 | 15. 21 | 4. 25 | 1. 72 | 1. 17 | 1. 19 | 0. 55 | 8. 13 | 5. 59 | 5. 91 | 2. 55 | |||
| D | 37. 45 | 32. 71 | - | 4. 74 | 12. 85 | 13. 73 | - | 0. 89 | 1. 48 | 1. 13 | - | 0. 35 | 6. 88 | 5. 87 | - | 1. 00 | |||
| “-”:No data. | |||||||||||||||||||
双重载药多层微球体外累积缓释情况见图 4。9组微球的药物释放趋势基本相同,VEGF累积释放时间可达16.5 d,VAN累积释放时间可达12.5 d,释放药物的速率保持相对缓慢的过程。VEGF分别在0~2.5 d和6.5~10.5 d阶段有释放高峰,其他时间段释药平稳缓慢,16.5 d时释放接近完全;VAN在0.5 d时有相对明显的突释。9组微球在0.5 d时平均释放量在40%左右,随后的释放保持平稳的过程。
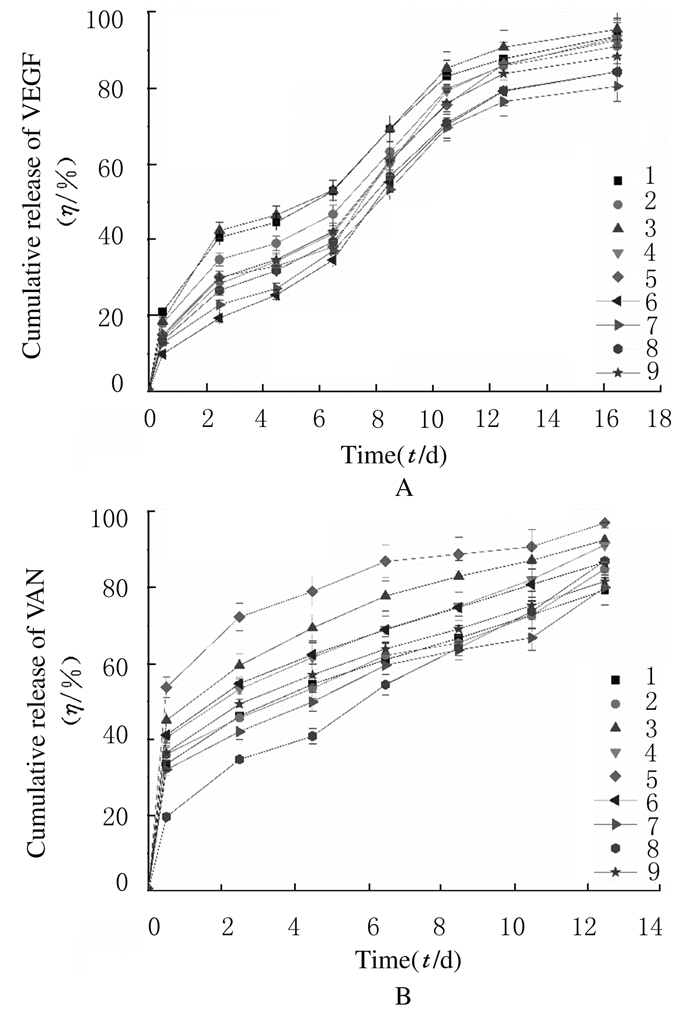
|
| 图 4 VEGF(A)和VAN(B)累积释放曲线 Figure 4 Cumulative release curves of VEGF (A) and VAN (B) |
|
|
利用乳化法制备海藻酸钙核心球,依据海藻酸盐与壳聚糖所带电荷相反的性质,利用交替自组装技术在核心球基础上制备的海藻酸钙-壳聚糖-海藻酸-壳聚糖微球,其制备过程简单,粒径在微米级,球形规整,粒径分布较均匀且不同配方制备的微球之间差异较小[18]。
双重载药多层包覆微球还具有良好的控释VEGF/VAN的作用。药物释放主要包括2个过程:通过微球本身具有的孔结构向外扩散和制备微球材料的降解。VEGF只包覆于多层载药缓释微球的最内层,因为外层不断的溶胀降解,所以VEGF在6.5~10.5 d出现释放高峰,随后的释放过程主要基于核心球的微孔及其溶胀破解;微球外壁是由海藻酸钠与壳聚糖反应得到的具有高强度的网状结构,且各层之间由于正负电荷吸引的作用,具有很大的分子链堆积密度,VEGF向外释放速率较慢,释放时间较长。而VAN投药量较大且位于微球的外部,外层最先溶胀破解,所以其在0.5 d时出现突释,随着微球外层的降解,VAN的释放过程随之结束,释放时间相对较短。
各组双重载药多层包覆微球VEGF的EE相对高于VAN,由于VEGF包覆在微球内部的核心球,VAN包覆在外层的壳聚糖中,制备过程中洗涤次数较多,位于外层的VAN损失量大于VEGF,导致VAN的EE相对较低。
药物释放过程中,VEGF和VAN的浓度维持较稳定,不仅能持久地促进血管再生,还能持续发挥抗菌作用。该释药系统能够一次投药缓慢释放,降低VEGF和VAN本身在高浓度时带来的毒副作用,以期满足临床需要,有望用于临床实践。
| [1] | Andhariya JV, Burgess DJ. Recent advances in testing of microsphere drug delivery systems[J]. Expert Opin Drug Deliv, 2016, 13(4): 593–608. DOI:10.1517/17425247.2016.1134484 |
| [2] | McClements DJ. Designing biopolymer microgels to encapsulate, protect and deliver bioactive components:Physicochemical aspects[J]. Adv Colloid Interface Sci, 2017, 240: 31–59. DOI:10.1016/j.cis.2016.12.005 |
| [3] | Farooq U, Malviya R, Sharma PK. Advancement in microsphere preparation using natural polymers and recent patents[J]. Recent Pat Drug Deliv Formul, 2014, 8(2): 111–125. DOI:10.2174/1872211308666140218110520 |
| [4] | Poojari R, Srivastava R. Composite alginate microspheres as the next-generation egg-box carriers for biomacromolecules delivery[J]. Expert Opin Drug Deliv, 2013, 10(8): 1061–1076. DOI:10.1517/17425247.2013.796361 |
| [5] | George M, Abraham TE. Polyionic hydrocolloids for the intestinal delivery of protein drugs:alginate and chitosan——a review[J]. J Control Release, 2006, 114(1): 1–14. DOI:10.1016/j.jconrel.2006.04.017 |
| [6] | Reis CP, Ribeiro AJ, Reufeld RJ, et al. Alginate microparticles as novel carrier for oral insulin delivery[J]. Biotechnol Bioeng, 2007, 96(5): 977–989. DOI:10.1002/(ISSN)1097-0290 |
| [7] | Zhu AM, Hua C, Liu QL, et al. Controlled release of bebeerine hydrochloride from alginate microspheres embedded within carboxymethyl chitosan hydrogels[J]. J App Polym Sci, 2011, 120(4): 2374–2380. DOI:10.1002/app.33433 |
| [8] | Xiao C, Sun F. Fabrication of distilled water-soluble chitosan/alginate functional multilayer composite microspheres[J]. Carbohydr Polym, 2013, 98(2): 1366–1370. DOI:10.1016/j.carbpol.2013.07.068 |
| [9] | Shi X, Fang Q, Ding M, et al. Microspheres of carboxymethyl chitosan, sodium alginate and collagen for a novel hemostatic in vitro study[J]. J Biomater Appl, 2016, 30(7): 1092–1102. DOI:10.1177/0885328215618354 |
| [10] | 姜恒丽, 崔元璐, 齐学洁, 等. 海藻酸钠-壳聚糖微胶囊载体在组织工程研究中的应用[J]. 中国组织工程研究, 2014, 18(3): 412–419. DOI:10.3969/j.issn.2095-4344.2014.03.014 |
| [11] | Borges O, Silva M, de Sousa A, et al. Alginate coated chitosan nanoparticles are an effective subcutaneous adjuvant for hepatitis B surface antigen[J]. Int Immunopharmacol, 2008, 8(13/14): 1773–1780. |
| [12] | Glavas Dodov M, Calis S, Crcarevska MS, et al. Wheat germ agglutinin-conjugated chitosan-Ca-alginate microparticles for local colon delivery of 5-FU:development and in vitro characterization[J]. Int J Pharm, 2009, 381(2): 166–175. DOI:10.1016/j.ijpharm.2009.06.037 |
| [13] | Nagarwal RC, Kumar R, Pandit JK. Chitosan coated sodium alginate-chitosan nanoparticles loaded with 5-FU for ocular delivery: in vitro characterization and in vivo study in rabbit eye[J]. Eur J Pharm Sci, 2012, 47(4): 678–685. DOI:10.1016/j.ejps.2012.08.008 |
| [14] | 杨军星, 王琦, 王媛媛, 等. 双重载药多层海藻酸盐-壳聚糖缓释微球的制备及体外释放[J]. 高等学校化学学报, 2015, 36(5): 1025–1032. |
| [15] | 刘亚军, 朱以华, 张素秋, 等. 以三聚氰胺甲醛微球为模板的空腔胶囊的制备与应用[J]. 过程工程学报, 2004, 4(6): 513–518. |
| [16] | 赵名艳, 李立华, 周长忍, 等. 载荷壳聚糖微球的海藻酸钠水凝胶的制备[J]. 现代生物医学进展, 2011, 11(11): 2006–2010. |
| [17] | 刘伟, 王莹, 王士斌, 等. 乳化-凝胶化法制备药用载体海藻酸钙微球的研究[J]. 生物医学工程研究, 2007, 26(2): 155–158. |
| [18] | 李琳, 刘宝林, 韩宝三, 等. 海藻酸钠/壳聚糖微载体的制备及生物活性评价[J]. 应用化工, 2013, 42(2): 233–238. |
 2017, Vol. 43
2017, Vol. 43


