扩展功能
文章信息
- 刘丹青, 叶树凤, 童卫芳, 滕博, 王三春, 冯青杰
- LIU Danqing, YE Shufeng, TONG Weifang, TENG Bo, WANG Sanchun, FENG Qingjie
- 肾透明细胞癌鼻腔-鼻窦转移1例报告及文献复习
- Renal clear cell carcinoma transferred to nasal cavity and sinuses:A case reportand literature review
- 吉林大学学报(医学版), 2017, 43(04): 829-831
- Journal of Jilin University (Medicine Edition), 2017, 43(04): 829-831
- 10.13481/j.1671-587x.20170432
-
文章历史
- 收稿日期: 2017-04-10
肾透明细胞癌(renal clear cell carcinoma,RCCC)是来源于肾小管上皮细胞的腺癌,为肾癌最为常见的病理类型,占肾恶性肿瘤的85%~90%,在成人恶性肿瘤中占2%~3%,主要由肾小管上皮细胞发生,具有较强的侵袭性和远处转移能力,预后较差。有25%~30%的肾癌缺乏早期临床表现,在确诊时已出现肺、肝脏、骨、脑和淋巴结等远处转移,而肾透明细胞癌转移至鼻腔及鼻窦者极为罕见[1]。在肾透明细胞癌的转移部位中,以上颌窦最为多见,其次为蝶窦、筛窦和额窦。因肿瘤血管丰富,患者早期症状表现为鼻出血,极易误诊为血管瘤。在治疗上多采用局部切除和放射治疗控制转移灶,国内外相关报道较少。本文作者完成1例鼻内镜下低温等离子左鼻腔筛窦肿物切除术治疗肾透明细胞癌鼻腔-鼻窦转移病例,现结合相关文献报道如下。
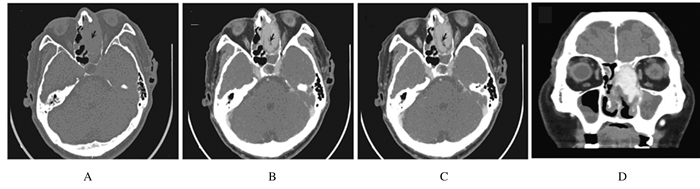
1 临床资料 1.1 一般资料患者,男性,65岁。因左侧鼻腔间断性出血1月余转入本院治疗,急诊以鼻出血伴中度贫血收入院。既往1年前因左肾恶性肿瘤行左肾切除术,术后未行放化疗。鼻窦CT示:左侧筛窦和左侧鼻腔内可见类椭圆形软组织密度影,约30mm×19mm(图 1A);动脉期图像可见明显强化,强化程度与动脉血管相似,左侧筛窦扩大,窦壁骨质变薄,双侧额窦、蝶窦、筛窦及上颌窦密度增高,增强未见确切强化;右侧上颌窦黏膜影增厚,呈轻度强化;延迟期强化区轻度减弱,肿瘤密度略高于软组织密度(图 1B-D)。诊断:左侧筛窦和鼻腔内占位性病变,考虑血管源性病变可能性大。临床诊断为:鼻出血,鼻腔肿物(左侧),失血性贫血(中度)。
|
| 图 1 患者术前鼻窦CT图像 Figure 1 Preoperative CT images of sinuses of patient |
|
|
术前患者给予红细胞悬液5U输注后,血红蛋白升至105 g·L-1,全麻下行鼻内镜下左鼻腔筛窦肿物切除术。术中见左侧鼻腔充满色暗肿物,肿瘤以左侧筛窦为中心,易出血,与周围组织界限尚清,术中快速病理回报为“毛细血管瘤”,因肿瘤出血凶猛,故行控制性降血压,并以凡士林纱条反复压迫止血,以双极电刀及等离子刀沿鼻腔外侧壁分离止血,分次迅速将肿瘤剥离,彻底清除。肿瘤切除后鼻腔再无活动性出血。左鼻腔内以纳吸绵、碘仿及凡士林油纱填塞。术中出血量约为1500 mL,输入红细胞悬液4.5 U。
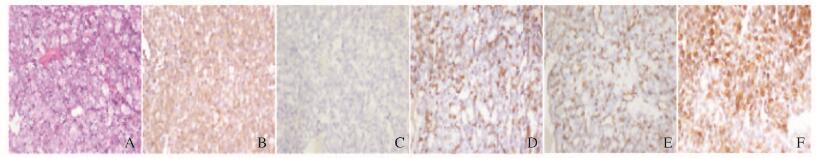
1.3 治疗结果术后病理回报:送检组织内见大量坏死,血管丰富,肿瘤细胞呈巢状或腺泡状分布,巢间有纤细薄壁的纤维血管包绕,细胞膜界限清晰,部分细胞质嗜酸性,核形态及大小较一致。肿瘤细胞呈圆形或多边形,胞浆透明,含大量类脂及糖原,细胞核大小不一,排列多样(图 2A,见封三);免疫组织化学SP法染色结果: CD31(-)、CD34(-)、CK7(-)、CD10(+)、CK8/18(+)、Vimentin(+)、Ki67(阳性率10%)、CK(AE1/AE3)(+)、pax-8(+),支持肾透明细胞癌诊断(图 2B-F,见封三)。患者既往肾癌病史1年,明确临床诊断为“肾癌鼻腔鼻窦转移”。患者术后无发热,无活动性出血,无颅内及眼部等并发症,术后3d取出鼻腔填塞物,患者出院后失访。
|
| A:HE staining;B:CK;C:Ki67;D:CD10;E:Vimentin;F:CD34. 图 2 肾透明细胞癌鼻腔-鼻窦转移患者 术后病理及免疫组织化学染色结果(×200) Figure 2 Postoperativeresults of pathology and immunohistochemical staining of patient with renal clear cell carcinoma transferred to nasal cavity and sinuses(×200) |
|
|
鼻腔-鼻窦恶性肿瘤以原发者多见,而其他部位的恶性肿瘤转移至鼻部较为罕见。肾恶性肿瘤远处转移部位多见于肺和乳腺[2-3],极少发生鼻腔-鼻窦转移。肿瘤转移至鼻腔-鼻窦的具体机制目前尚不明确。研究[4]报道:因为鼻腔血供丰富,无静脉瓣膜的椎静脉丛在每一个节段水平与肋间静脉、奇静脉系统和腔静脉等形成交错的血管网,增加胸腔及腹腔内压力可使癌细胞进入椎静脉丛,通过翼丛、海绵窦及咽丛等扩散至头面部,出现鼻腔-鼻窦区域的逆行播散。鼻腔-鼻窦恶性肿瘤典型影像表现为位于鼻腔及鼻窦的高血供软组织肿块伴明显骨质破坏。本病例的鼻窦CT显示动脉期快速扑入,病灶强化明显,延迟期出现低灌注,并出现弱强化,与文献[5]报道的肾透明细胞癌的CT表现相一致。
对于本病的组织病理学诊断,需要综合患者的临床资料,并最终结合免疫组织化学染色结果进行鉴别。肾透明细胞癌的组织病理学标志包括Vimentin、pax-8和CD10等[6],98%的肾透明细胞转移癌中均有pax-8表达,CD10在正常肾小管上皮细胞刷状缘呈阳性,有助于肾脏透明细胞癌与其他部位透明细胞癌的鉴别。由于CD10表达于多种正常组织,是一种敏感性强且特异性差的标志物,故联合Vimentin和pax-8等抗体,对准确诊断肾透明细胞转移癌具有重要意义[7-8]。CD10(+)和CK7(-)是肾透明细胞癌的典型免疫表型;CD31、CD34是不同亚型肾癌组织的微血管标志,在肾透明细胞癌中多无表达[9]。Ki67是一种与细胞增殖相关的核抗原,其比例代表着肿瘤细胞的增殖活性,随着肿瘤恶性程度增高,Ki67阳性细胞数也相应增加[10]。本病例术后病理HE染色结果:送检组织内见大量胞质丰富、透明度高的细胞呈腺泡状排列,周围见大量坏死组织,血管丰富;免疫组织化学染色结果:CD31(-)、CD34(-)、CK7(-)、CD10(+)、CK8/18(+)、Vimentin(+)、Ki67(阳性率10%)、CK(AE1/AE3)(+)、pax-8(+),结合患者临床资料,支持肾透明细胞转移癌的诊断。
本病例术中误诊为毛细血管瘤,其原因可能为:① 肿瘤组织血管丰富,冰冻切片上见异常增生的毛细血管网,毛细血管扩张,管腔大小不等,腔内充满红细胞,支持毛细血管瘤的诊断;② 鼻腔血管瘤与肾透明细胞癌鼻腔鼻窦转移均表现为鼻腔大量出血史,CT图像均可存在骨质的破坏,增强扫描均出现肿瘤实质的明显强化;③ 身体其他部位的恶性肿瘤转移至鼻腔-鼻窦者临床罕见。对于既往有恶性肿瘤病史的鼻出血患者,均应把转移瘤放到鉴别诊断的首要位置。
肾透明细胞癌鼻腔-鼻窦转移癌对传统放化疗均不敏感,转移灶切除术是其主要治疗手段,术前行肿瘤供血动脉栓塞可有效减少术中出血。此类患者预后极差,中位生存期约为1年,5年生存率约为13%[11]。Lee等[12]报道1例肾透明细胞癌鼻腔转移接受单纯鼻内镜下手术治疗患者,对其随访5个月,患者无复发。Mahajan等[13]报道1例肾透明细胞癌行“左肾切除术”术后2年出现鼻腔上颌窦转移的病例,患者接受外科手术联合放化疗后,对其随访半年,患者无复发。对于恶性肿瘤鼻腔-鼻窦转移癌患者,临床医生应以改善患者的生存质量、延长生命为治疗目的,并根据患者的具体情况选择合适的治疗方案。
| [1] | Remon J, Lianes P, Martínez S. Brain metastases from renal cell carcinoma. Should we change the current standard?[J]. Cancer Trea Rev, 2012, 38(4): 249–257. DOI:10.1016/j.ctrv.2011.06.008 |
| [2] | Ralli M, Altissimi G, Turchetta R, et al. Metastatic renal cell carcinoma presenting as a paranasal sinus mass:The importance of differential diagnosis[J]. Case Rep Otolaryngol, 2017, 2017(4): 1–5. |
| [3] | Evgeniou E, Menon KR, Jones GL, et al. Renal cell carcinoma metastasis to the paranasal sinuses and orbit[J]. BMJ Case Rep, 2012. DOI:10.1136/Bcr.01.2012.5492 |
| [4] | Batson OV. The function of the vertebral veins and their role in the spread of métastases[J]. Ann Surg, 1940, 112(1): 138–149. DOI:10.1097/00000658-194007000-00016 |
| [5] | 杨毅, 周俊林, 郭玲, 等. 肾透明细胞癌的CT表现与Ki67、MVD、P73表达的相关性研究[J]. 中国CT和MRI杂志, 2015, 13(1): 51–54. |
| [6] | Zou H, Pang LJ, Hu WH, et al. Study on clinicopathologic features and immunophenotype of 114 cases of renal cell carcinoma[J]. Zhanghua Bing Li Xue Za Zhi, 2008, 37(11): 726–731. |
| [7] | 张伟, 于文娟, 夏岩, 等. 碳酸酐酶Ⅸ、PAX2和PAX8在肾上皮性肿瘤中的表达及临床病理意义[J]. 中华病理学杂志, 2013, 42(7): 442–445. |
| [8] | Tong GX, Yu WM, Beaubier NT, et al. Expression of PAX8 in normal and neoplastic renal tissues:an immunohistochemical study[J]. Mod Pathol, 2009, 22(9): 1218–1227. DOI:10.1038/modpathol.2009.88 |
| [9] | Baldewijns MM, Thijssen VL, Van den Eynden GG, et al. High-grade clear cell renal cell carcinoma has a higher angiogenic activity than low-grade renal cell carcinoma based on histomorphological quantification and qRT-PCR mRNA expression profile[J]. Br J Cancer, 2007, 96(12): 1888–1895. DOI:10.1038/sj.bjc.6603796 |
| [10] | Pritchyk KM, Schiff BA, Newkirk KA, et al. Metastatic renal cell carcinoma to the head and neck[J]. Laryngoscope, 2002, 112(9): 1598–1602. DOI:10.1097/00005537-200209000-00012 |
| [11] | Garcia JA, Rini BI. Recent progress in the management of advanced renal cell carcinoma[J]. CA Cancer J Clin, 2007, 57(2): 112–125. DOI:10.3322/canjclin.57.2.112 |
| [12] | Lee SM, Kim YM, Kim BM. Epistaxis as the first manifestation of silent renal cell carcinoma:A case report with relevant literature review[J]. Iran J Radiol, 2016, 13(1): e31208–e31210. |
| [13] | Mahajan R, Mayappa N, Prashanth V. Metastatic renal cell carcinoma presenting as nasal mass:vase teport and teview of literature[J]. Indian J Otholaryngol Head Neck Surg, 2016, 68(3): 374–376. DOI:10.1007/s12070-015-0959-8 |
 2017, Vol. 43
2017, Vol. 43


