扩展功能
文章信息
- 刘红梅, 初喆, 田锐, 唐颖
- LIU Hongmei, CHU Zhe, TIAN Rui, TANG Ying
- IL-10和IL-12检测在结核性和恶性胸腔积液鉴别诊断中的应用
- Application of IL-10 and IL-12 detection in differential diagnosis of tuberculous and malignant pleural effusion
- 吉林大学学报(医学版), 2017, 43(04): 782-786
- Journal of Jilin University (Medicine Edition), 2017, 43(04): 782-786
- 10.13481/j.1671-587x.20170423
-
文章历史
- 收稿日期: 2016-08-17
2. 吉林大学第一医院急诊内科, 吉林 长春 130021;
3. 空军航空大学门诊部, 吉林 长春 130022
2. Department of Emergency, First Hospital, Jilin University, Changchun 130021, China;
3. Department of Out-patients, Aviation University of Air Force, Changchun 130022, China
结核和肿瘤是渗出性胸腔积液最常见的病因,巨噬细胞参与了二者的发病过程。目前研究[1-3]显示:经典活化的M1型巨噬细胞参与了结核胸膜炎的早期发病过程,而替代活化的M2型巨噬细胞参与了恶性胸腔积液的发病,M1型巨噬细胞以分泌白细胞介素12(interleukin-12,IL-12) 为主、M2型巨噬细胞以分泌白细胞介素10(interleukin-10,IL-10) 为主。能否通过IL-10和IL-12检测鉴别结核性和恶性胸腔积液目前尚不明确,因此本研究拟通过检测上述2种细胞因子在胸腔积液患者血清和胸腔积液中的水平,探讨二者对于结核性和恶性胸腔积液鉴别的意义,为临床上结核性和恶性胸腔积液的鉴别提供理论依据。
1 资料与方法 1.1 临床资料选取2014年6月—2015年12月于吉林大学第一医院呼吸内科住院的经内科胸腔镜及组织病理学确诊的未经治疗的渗出性胸腔积液患者48例,根据病因分为:结核性胸膜炎患者25例,其中男性13例,女性12例,平均年龄45岁;恶性胸腔积液患者23例(腺癌15例,鳞状细胞癌8例),其中男性12例,女性11例,平均年龄55岁。选取年龄、性别等与患者相匹配的健康对照者20名作为健康对照组,其中男性10名,女性10名,平均年龄48.5岁,均来自健康献血者或吉林大学第一医院员工。本研究经吉林大学第一医院伦理委员会批准,所有参与者均签署知情同意书。
1.2 研究方法采用流式微球阵列法(Cytometric Bead Array,CBA)检测受试者血清和胸腔积液中IL-10和IL-12水平,比较各组受试者血清和胸腔积液IL-10、IL-12水平和IL-12/IL-10比值的差异,对有差异的组别进行受试者工作特征(ROC)曲线的分析,评价相应指标对于鉴别结核性和恶性胸腔积液的临床效益。
1.3 标本采集于清晨采集受试者外周静脉血3mL,利用Eppendorf离心机,2000 r·min-1离心10 min,留取上清冻存;所有胸腔积液的患者行内科胸腔镜的同时获取胸腔积液5 mL后,3500 r·min-1低温离心10 min,留取上清冻存。
1.4 胸腔积液中脱落细胞和腺苷脱氢酶(ADA)水平检测患者胸腔积液脱落细胞的检测需留取300~500mL样本,获得有核细胞后采用苏木精-伊红染色,用显微镜观察细胞形态。脱落细胞检测由受过训练的检验科专科医生完成。采用化学发光免疫测定法检测胸腔积液中ADA水平,由吉林大学第一医院检验科完成。
1.5 IL-10和IL-12水平检测采用CBA法检测血清和胸腔积液中IL-10和IL-12水平,按照说明书中的方法制备IL-10和IL-12的标准曲线。根据样本量计算所需试管数,按照每个试管加入10 μL磁珠悬液的量计算所需的磁珠悬液总量,将抗体包被的磁珠悬液加入一个新的流式管,漩涡振荡混匀,避光孵育。准备与前述所需数量相同的流式管,每管内加入50μL混匀捕获磁珠。加入待测样本50 μL,混匀,室温下避光温育2 h。加入1 mL缓冲液,200g离心5 min。弃上清,加入50 μL PE标记的亲和素,轻轻混匀,室温避光孵育1 h。加入1 mL缓冲液,200g离心5 min。弃上清,加入300 μL缓冲液,混匀。使用FACS Calibur流式细胞仪进行检测,应用CBA软件根据标准曲线计算出各测试管细胞因子水平。CBA法检测IL-10和IL-12水平的极值分别为3.3和1.9 ng·L-1。
1.6 统计学分析采用SPSS16.0统计软件进行统计学分析。各组受试者血清和胸腔积液中IL-10、IL-12水平和IL-12/IL-10比值以M(P25,P75) 表示,多组间比较采用Kruskal-Wallis H检验,两组间比较采用非参数检验的Mann-Whitney U检验。采用ROC曲线法比较不同指标对胸腔积液诊断的特异性和敏感性。以P < 0.05为差异有统计学意义。
2 结果 2.1 2组患者胸腔积液中脱落细胞和ADA水平胸腔积液中脱落细胞和ADA水平是目前比较公认的提示恶性胸腔积液和结核性胸腔积液的指标。本组恶性胸腔积液和结核性胸腔积液患者胸腔积液中脱落细胞和ADA水平见表 1。
| Group | n | Cast-off cells (+/-) | ADA[λB/(U·L-1)] |
| Tuberculous | 25 | 0/25 | 52.6 (3.5, 113.2) |
| Malignant | 23 | 14/9 | 23.2(3.7, 48.7) |
3组受试者血清中IL-12水平比较差异有统计学意义(P= 0.027);结核性胸腔积液组受试者血清中IL-12水平明显高于健康对照组(P= 0.008),而与恶性胸腔积液组比较差异无统计学意义(P > 0.05);3组受试者血清IL-10水平和IL-12/IL-10比值比较差异无统计学意义(P > 0.05)。见表 2。
| [M(P25, P75)] | ||||
| Group | n | IL-10[ρB/(ng·L-1)] | IL-12[ρB/(ng·L-1)] | IL-12/IL-10 |
| Healthy control | 20 | 7.68(7.55, 8.01) | 7.92(7.79, 8.09) | 1.02(0.97, 1.06) |
| Tuberculous | 25 | 7.86(7.61, 8.34) | 8.22(7.95, 8.62)*[HT6] | 1.05(1.00, 1.07) |
| Malignant | 23 | 8.19(7.73, 8.64) | 8.16(7.71, 8.61) | 1.00(0.91, 1.08) |
| F | 5.075 | 7.250 | 2.550 | |
| P | 0.079 | 0.027 | 0.279 | |
| *P < 0.05 vs healthy control group. | ||||
恶性胸腔积液组患者胸腔积液中IL-12水平和IL-12/IL-10比值明显低于结核性胸腔积液组(P < 0.01);结核性胸腔积液组和恶性胸腔积液患者胸腔积液中IL-10水平比较差异无统计学意义(P > 0.05)。见表 3。
| [M(P25, P75)] | |||
| Group | IL-10[ρB/(ng·L-1)] | IL-12[ρB/(ng·L-1)] | IL-12/IL-10 |
| Tuberculous | 13.44(11.84, 19.61) | 9.78(9.14, 11.19) | 0.74(0.50, 0.85) |
| Malignant | 16.35(12.84, 20.00) | 8.11(7.95, 8.33) * | 0.53(0.40, 0.63)* |
| *P < 0.01 vs tuberculous group | |||
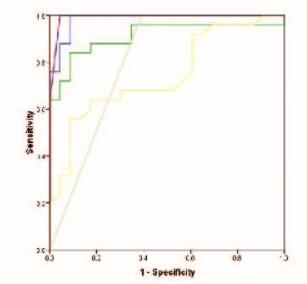
以结核性胸腔积液组为病例组,恶性胸腔积液组为对照组时,胸腔积液中IL-12水平、IL-12/IL-10比值、脱落细胞和ADA水平鉴别结核性和恶性胸腔积液的ROC曲线下面积分别为0.984、0.744、0.804和0.911(图 1,见封三)。IL-12诊断效益优于其他检测,最适的IL-12鉴别临界阈值为8.585 ng·L-1,特异度为91.3%,敏感度为100%。将IL-12、ADA和脱落细胞3项指标联合检测后,诊断效益明显增加,曲线下面积为0.992,诊断效益优于其他任一单一指标。
|
| Purple:ADA+cast-off+IL-12; Blue:IL-12; Green:ADA;Gray:Cast-off. 图 1 不同指标鉴别结核性和恶性胸腔积液的ROC曲线 Figure 1 ROC curves for different indexes in differential diagnosis of tuberculous and malignant pleural effusion |
|
|
胸腔积液是一种比较常见的胸部疾病,临床上以结核性和恶性胸腔积液最为多见[4-5],尽快明确胸腔积液的病因对于评估患者治疗方案、改善患者预后具有非常重要的意义。近年来随着内科胸腔镜技术的发展,其已经为胸腔积液的病因诊断提供了有效的方法,但胸腔镜具有一定的风险性,且许多医院并无相应的技术,限制了该技术的临床应用。目前临床上鉴别结核性和恶性胸腔积液的方法主要依赖于胸腔积液中ADA、癌胚抗原(CEA)和脱落细胞检测结果,然而胸腔积液中肿瘤细胞学阳性率较低,容易漏诊,而部分恶性胸腔积液患者ADA增高、部分非恶性胸腔积液患者CEA也可以增高,以上均增加了结核性和恶性胸腔积液的鉴别难度,因此急需一种能有效辅助诊断胸腔积液病因的标志物。
新近研究[2-3]证实:巨噬细胞在结核性和恶性胸腔积液的发生发展过程中发挥了重要的作用。在不同细胞因子的作用下,巨噬细胞可以激活成为M1型和M2型:M1型巨噬细胞主要分泌活性氧簇(ROS)、一氧化氮(NO)、IL-12、IL-23和肿瘤坏死因子α(TNF-α)等,可以杀灭入侵机体的外来微生物,同时在抗肿瘤免疫反应中发挥重要作用[6-8];M2型巨噬细胞分泌IL-10和转化生长因子β(TGF-β)等[9-13],主要发挥抗炎、修复、刺激新生血管生成以及促进肿瘤组织的生长的作用[14-17]。本课题组研究[1]也证实:在结核性胸腔积液发病的早期,巨噬细胞以IL-12+M1型为主,而在恶性胸腔积液中巨噬细胞以IL-10+M2型为主。通过检测M1型和M2型巨噬细胞分泌的细胞因子可能有助于结核性胸膜炎和恶性胸腔积液的鉴别。因此本研究通过检测结核性和恶性胸腔积液患者胸腔积液中IL-12和IL-10水平进一步验证本课题组的假设。
本研究结果显示:结核性胸腔积液和恶性胸腔积液患者外周血中IL-10和IL-12水平比较差异无统计学意义,而恶性胸腔积液患者胸腔积液中IL-12水平明显低于结核性胸腔积液患者,与陈丽华等[18]的结果一致。然而Chen等[19]研究结果显示:与恶性胸腔积液组比较,结核性胸腔积液患者胸腔积液中IL-12水平有明显升高的趋势,这可能与该研究中结核性胸腔积液病例数过少(仅为5例)有关。鉴于恶性胸腔积液患者胸腔积液中IL-12水平和IL-12/IL-10比值明显低于结核性胸腔积液组,本文作者进一步进行了ROC曲线的分析,与胸腔积液中脱落细胞和ADA水平比较结果显示:胸腔积液中IL-12水平、IL-12/IL-10比值、脱落细胞和ADA水平鉴别结核性和恶性胸腔积液的ROC曲线下面积分别为0.984、0.744、0.804和0.911,其诊断效益为IL-12>ADA>脱落细胞> IL-12/IL-10比值,因此IL-12可以作为鉴别结核性和恶性胸腔积液的标志物,其鉴别的临界阈值为8.585 ng·L-1,特异度为91.3%,敏感度为100%。
结核性和恶性胸腔积液的鉴别一直是困扰临床医生的难题,本研究结果提示:检测胸腔积液中IL-12的水平有助于二者的鉴别,通过联合ADA和脱落细胞检查可以有效提高结核性和恶性胸腔积液的诊断率,并且胸腔积液标本临床上容易获取,值得在临床上广泛推广。
| [1] | Tang Y, Hua SC, Qin GC, et al. Different subsets of macrophages in patients with new onset tuberculous pleural effusions[J]. PLoS One, 2014, 9(2): e88343. DOI:10.1371/journal.pone.0088343 |
| [2] | Wynn TA, Chawla A, Pollard JW. Macrophage biology in development, homeostasis and disease[J]. Nature, 2013, 496(7446): 445–455. DOI:10.1038/nature12034 |
| [3] | 鲁宏伟, 蔡军伟, 刘靖华. 巨噬细胞的极化及其调控的信号分子和转录因子[J]. 细胞与分子免疫学杂志, 2013, 29(7): 777–779, 783. |
| [4] | Nam HS. Malignant pleural effusion:Medical approaches for diagnosis and management[J]. Tuberc Respir Dis(Seoul), 2014, 76(5): 211–217. DOI:10.4046/trd.2014.76.5.211 |
| [5] | Im KS, Choi MK, Jeon YK, et al. Dissecting thoracic aortic aneurysm associated with tuberculous pleural effusion[J]. J Thorac Dis, 2016, 8(7): E520–522. DOI:10.21037/jtd |
| [6] | Veremeyko T, Siddiqui S, Sotnikov I, et al. IL-4/IL-13-dependent and independent expression of miR-124 and its contribution to M2 phenotype of monocytic cells in normal conditions and during allergic inflammation[J]. PLoS One, 2013, 8(12): e81774. DOI:10.1371/journal.pone.0081774 |
| [7] | Jiang ZL, Zhu L. Update on the role of alternatively activated macrophages in asthma[J]. J Asthma Allergy, 2016, 9: 101–107. |
| [8] | Tomioka H, Tatano Y, Maw WW, et al. Characteristics of Suppressor Macrophages Induced by Mycobacterial and Protozoal Infections in relation to Alternatively Activated M2 Macrophages[J]. Clin Dev Immunol, 2012, 2012: 635451. |
| [9] | Chung Y, Hong JY, Lei J, et al. Rhinovirus infection induces interleukin-13 production from CD11b positive, M2-polarized exudative macrophages[J]. Am J Respir Cell Mol Biol, 2015, 52(2): 205–216. DOI:10.1165/rcmb.2014-0068OC |
| [10] | Staples KJ, Hinks TS, Ward JA, et al. Phenotypic characterization of lung macrophages in asthmatic patients:overexpression of CCL17[J]. J Allergy Clin Immunol, 2012, 130: e1407. |
| [11] | Zdrenghea MT, Makrinioti H, Muresan A, et al. The role of macrophage IL-10/innate IFN interplay during virus-induced asthma[J]. Rev Med Virol, 2015, 25(1): 33–49. DOI:10.1002/rmv.1817 |
| [12] | Hume DA. The many alternative faces of macrophage activation[J]. Front Immunol, 2015, 6: 370. |
| [13] | 高延秋, 张华, 刘敏, 等. 重症肺炎患者外周血IL-6和IL-8水平的检测[J]. 郑州大学学报:医学版, 2015, 50(4): 555–558. |
| [14] | Zaynagetdinov R, Sherrill TP, Polosukkhin VV, et al. A critical role for macrophages in promotion of urethane induced lung carcinogenesis[J]. J Immunol, 2011, 187(11): 5703–5711. DOI:10.4049/jimmunol.1100558 |
| [15] | Schmieder A, Michel J, Schonhaar K, et al. Differentiation and gene expression profile of tumor-associated macrophages[J]. Semin Cancer Biol, 2012, 22(4): 289–297. DOI:10.1016/j.semcancer.2012.02.002 |
| [16] | Shirabe K, Mano Y, Muto J, et al. Role of tumor-associated macrophages in the progression of hepatocellular carcinoma[J]. Surg Today, 2012, 42(1): 1–7. DOI:10.1007/s00595-011-0058-8 |
| [17] | Hao NB, Lu MH, Fan YH, et al. Macrophages in tumor microenvironments and the progression of tumors[J]. Clin Devel Immunol, 2012, 2012: 948098. |
| [18] | 陈利华, 蒋捍东, 林存智. γ干扰素、白细胞介素18、白细胞介素12及可溶性白细胞介素2受体在结核性和恶性胸腔积液中表达意义分析[J]. 中华临床医师杂志:电子版, 2011, 5(12): 3602–3604. |
| [19] | Chen KY, Feng PH, Chang CC, et al. Novel biomarker analysis of pleural effusion enhances differentiation of tuberculous from malignant pleural effusion[J]. Int J Gen Med, 2016, 9: 183–189. |
 2017, Vol. 43
2017, Vol. 43


