扩展功能
文章信息
- 张琦, 赵洪岩, 张志民, 张红, 李文月, 超博, 杨瑶瑶
- ZHANG Qi, ZHAO Hongyan, ZHANG Zhimin, ZHANG Hong, LI Wenyue, CHAO Bo, YANG Yaoyao
- 氟环境下变形链球菌耐氟菌株ciaH、eno和pykF基因的差异表达及其意义
- Differential expressions of ciaH, eno and pykF genes of fluoride-resistant Streptococcus mutans cultivated in fluoride environment and its significance
- 吉林大学学报(医学版), 2017, 43(04): 747-751
- Journal of Jilin University (Medicine Edition), 2017, 43(04): 747-751
- 10.13481/j.1671-587x.20170417
-
文章历史
- 收稿日期: 2016-12-27
- 网络出版时间: 2017-07-07 09:12:35
龋病是最常见的口腔细菌感染性疾病之一,其主要致龋菌是变形链球菌(Streptococcus mutans,S.mutans)。氟化物能有效抑制变形链球菌生长,1g·L-1氟化物能完全杀灭变形链球菌。目前,氟化物已经广泛应用于临床,但是长期局部高浓度使用氟化物可能导致变形链球菌耐氟菌株的产生,为防龋领域带来新的挑战。
耐氟菌株具有更强的产酸性、耐酸性及脱矿能力,尤其是在低pH值环境下,耐氟菌株具有更强的致龋性[1]。目前可在体外用直接或间接诱导法获得耐氟菌株,并且其氟抗性均能稳定遗传[2],提示变链菌氟抗性的产生可能并非来源于氟化物的诱变,而是在接触氟化物之前源自基因的随机突变而产生。研究[3]显示:耐氟菌株较亲代菌株存在多种基因型的改变,但尚未找到明确的耐氟基因或决定性的突变位点。
本课题组前期通过对变形链球菌耐氟菌株进行全基因组测序[4],与亲代菌株对比,发现有20个基因和5个基因间隔发生了突变,其中3个基因,ciaH、eno和pykF可能与耐氟菌株氟抗性的产生有关。ciaH基因中1069778位点(该位点指UA159全基因组序列中位点,GenBank ID: NC_004350.2,下同)C→T,编码氨基酸由苏氨酸→异亮氨酸;eno基因中1184373位点C→T,编码氨基酸也由苏氨酸→异亮氨酸;pyfK基因中1131158位点A→G,编码氨基酸由谷氨酸→甘氨酸。这些位点突变均可能造成基因在表达和翻译层面的变化。ciaH、eno和pykF分别编码组氨酸激酶、烯醇酶和丙酮酸激酶,该3种基因所参与的耐酸性、糖酵解和糖转运过程又是氟抑菌作用的主要机制,尤其烯醇酶还是氟作用的主要位点。上述3种基因如果发生变化很可能引起氟抗性的产生。以往曾将变形链球菌亲代菌株及耐氟菌株同时置于低浓度氟环境下来探究二者生理状态上的差异。本研究首次将耐氟菌株置于其诱导时达到的最大氟浓度(1g·L-1)的培养基中,并首次检测高浓度氟对变形链球菌耐氟菌株特定基因表达的影响,探讨ciaH、eno和pykF基因与氟抗性的关系。
1 材料与方法 1.1 菌种、主要试剂和仪器采用本课题组前期冻存的菌种,其中变形链球菌UA159购自上海交通大学口腔医学院,采取逐步诱导法得到其耐氟菌株UA159-FR。BHI培养基和氟化钠(NaF)(青岛海博公司),琼脂(中国生工生物工程公司),细菌RNA提取试剂盒(北京康为世纪公司),逆转录试剂盒和荧光定量PCR试剂盒(日本TaKaRa公司)。Agilent3500荧光定量PCR仪(美国Agilent Technologies公司)。
1.2 变形链球菌亲代菌株及其耐氟菌株的复苏和鉴定将保存于-80℃甘油中的UA159及UA159-FR取出复苏,连续传代后确定为纯培养。分别挑取UA159及UA159-FR典型单菌落接种于含有1g·L-1 NaF的BHI固体培基中,37℃厌氧培养(95%N2、5%CO2)48 h,UA159无菌落生长,UA159-FR可稳定生长,证明后者为耐氟菌株且耐氟性能稳定遗传。对菌株进行生理生化鉴定并送至中国生工生物工程公司进行16SrRNA细菌鉴定,最终确定二者均为变形链球菌。
1.3 实验分组菌株分3组。亲代组(UA组):变形链球菌UA159于不含氟的5mL BHI液体培养基中培养;耐氟组(FR组):变形链球菌耐氟菌株UA159-FR于不含氟的5mL BHI液体培养基中培养;含氟组(FFR组):变形链球菌耐氟菌株UA159-FR于含1g·L-1 NaF的5mL BHI液体培养基中培养。
1.3 变形链球菌及其耐氟菌株生长曲线的测定挑取变形链球菌UA159及其耐氟菌株UA159-FR单菌落,分别接种于5mL BHI液体培养基中,37℃微需氧(95%N2、5%CO2)培养48 h;添加BHI液体培养基将菌悬液配至吸光度(A)(550) 值均达到1.0;以总体积5%的接种量按以上分组方法培养。每组24管,均另设立2管空白对照;每隔2h从每组中各取出2管菌液置于4℃保存,直至24h;各样本混匀后取150 μL菌悬液置于96孔板内,每管取样2次,采用紫外可见分光光度计测定菌液A值。分析数据,结果取平均值,用Origin8绘制细菌生长曲线。
1.4 实时荧光定量PCR(RT-PCR)法检测菌株中ciaH、eno和pykFmRNA表达水平用配置好的A值为1.0的亲代及耐氟菌株菌悬液以总体积5%的接种量按以上分组方法培养,培养11和20 h后按试剂盒说明书提取细菌总RNA后逆转录。以上步骤重复3次。采用RT-PCR法检测ciaH、eno和pykFmRNA表达水平。各基因引物由生工生物公司设计合成,序列见表 1。反应体系为25 μL:SYBR 12.5 μL,上下游引物各0.5 μL,cDNA 2 μL,纯水9.5 μL。测定Ct值,确认反应的扩增曲线正常,熔解曲线均为单一峰。以16S为内参基因,通过2-ΔΔCt法计算目的基因相对于内参基因表达的倍数,作为目的基因mRNA的相对表达水平。将ciaH、eno和pykF基因中亲代组的基因表达均设为1,以表格形式分别列出基因耐氟组和含氟组与亲代组基因表达的倍数差异。
| Gene | Primer sequence | Size (bp) |
| 16S | F:5′-GTATCGTCGCCTTGGTAAGC-3′ | 20 |
| R:5′-CGCGTAGGTAACCTGCCTAT-3′ | 20 | |
| ciaH | F:5′-TTATTAGCAAGCAGGCGAGC-3′ | 20 |
| R:5′-GCGGACAATGGTCAAGGTATT-3′ | 21 | |
| eno | F:5'′-CGATTGGAGCATCTGAGTGA-3′ | 20 |
| R:5′-GTGCTGCTGCTGATTTCCTT-3′ | 20 | |
| pykF | F:5′-CTTTGACACCATCTGCAAACA-3′ | 21 |
| R:5′-TGAGCAAGGTGAACGTATGG-3′ | 20 |
采用SPSS 19.0统计软件进行统计学分析。各组菌株ciaH、eno和pykFmRNA表达水平以x± s表示,组间比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 不同培养条件下的细菌生长曲线以时间(0~24h)为横坐标,A值为纵坐标,绘制出3组细菌的生长曲线,空白对照组生长曲线为一直线,显示无细菌生长。见图 1。
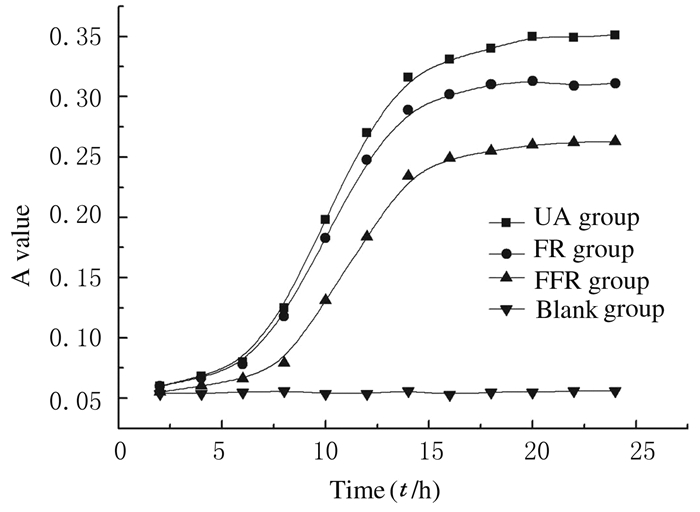
|
| 图 1 3组细菌的生长曲线 Figure 1 Growth curves of bacteria in three groups |
|
|
与亲代组比较,耐氟组细胞生长稍慢,最大菌体量较亲代组略低。含氟组细胞较其他2组生长速度明显减慢,进入指数期用时更久,最大菌体量也明显低于其他2组。由于基因表达具有一定的时间性,同一基因在不同时段表达水平不同,本实验选取典型的对数期(11h)和稳定期(20h)的3组菌株对比目的基因表达水平的差异。
2.2 3组菌株中ciaH、eno和pykFmRNA表达水平与耐氟组比较,含氟组的耐氟菌株ciaH、eno和pykF mRNA表达水平在对数期及稳定期均明显升高(P < 0.05或P < 0.01);与亲代组比较,耐氟组的耐氟菌株eno和pykF mRNA表达水平在对数期及稳定期均明显降低(P < 0.01),ciaH mRNA表达水平在对数期差异无统计学意义(P>0.05),在稳定期明显升高(P < 0.01)。见表 2。
| (n=3, x± s) | |||||||||
| Group | ciaH mRNA | eno mRNA | pykF mRNA | ||||||
| (t/h) | 11 | 20 | 11 | 20 | 11 | 20 | |||
| UA | 1.000±0.071 | 0.014±0.003 | 1.000±0.082 | 0.012±0.002 | 1.000±0.068 | 0.028±0.002 | |||
| FR | 0.942±0.256 | 0.025±0.006* | 0.317±0.142* | 0.003±0.000* | 0.313±0.061* | 0.010±0.001* | |||
| FFR | 2.466±0.381△ | 0.192±0.062△△ | 1.186±0.104△△ | 0.092±0.005△△ | 1.270±0.315△ | 0.176±0.017△△ | |||
| *P<0.01 compared with UA group; △P<0.05,△△P<0.01 compared with FR group. | |||||||||
氟的主要抑菌原理:① 通过抑制某些酶活性,尤其是烯醇酶,来抑制细菌的糖酵解[5]。② 抑制细菌糖转运。磷酸转移酶系统(PTS)承担了细菌绝大部分糖转运任务,该系统必须依赖磷酸烯醇式丙酮酸(PEP),而PEP主要由烯醇酶催化生成。目前研究[5]认为:氟通过抑制烯醇酶活性,减少PEP的生成从而间接抑制PTS系统的糖转运。③ 抑制细菌产酸性和耐酸性。氟以氢氟酸(HF)的形式渗透入胞内,释放H+降低胞内pH值。同时抑制细菌外排H+,胞浆酸化干扰细胞生命活动[6]。
目前对于细菌氟抗性产生机制的研究较少[7],主要有氟化物响应的核糖体开关[8]和氟离子逆向运输蛋白EriCF[9]等。研究[10]显示:与变形链球菌亲代菌株比较,耐氟菌株的某些氟抗性相关酶活性发生变化,比如ATP酶活性升高。但这些发现都无法阐明耐氟菌株氟抗性产生的原因。
本研究检测的ciaH、eno和pykF基因均与氟抗性相关。细菌在不同生长阶段同一基因的表达水平不同,鉴于3组菌株ciaH、eno和pykF的表达水平在稳定期与对数期比较均明显降低,证明3种基因的表达主要是在细菌生长的对数期。另外,对数期细菌生理特征较稳定,对外界环境作用敏感,无论在对数期还是稳定期,3组细菌基因的表达差异趋势基本相同,所以主要对细菌对数期基因表达水平进行讨论。
ciaH基因编码组氨酸激酶,是双组分调节系统(TCS)中的感受蛋白,负责感受外界的环境变化。研究[11]表明:人工制造的变形链球菌ciaH缺失的突变体生物膜形成明显减少,且在酸环境中较正常菌株显示出明显的生长缺陷,证明ciaRH TCS在细菌生物膜形成及耐酸性中发挥关键作用。牙菌斑就是典型的生物膜,以生物膜形式存在的细菌能抵御更苛刻的外界环境,拥有更高的氟抗性。抑制细菌的耐酸性又是氟抑菌的机制之一。本实验中,与亲代组比较,对数期耐氟组变形链球菌ciaH基因的表达水平差异无统计学意义,但含氟组ciaH基因的表达水平明显升高,表明氟能提高耐氟菌株ciaH基因的表达,可能通过提升耐氟菌株在氟环境下生物膜的形成及耐酸性能力,从而增强细菌的氟抗性。另外,ciaH还调控细菌的胁迫耐受性,可能ciaH TCS能够对氟信号进行接收和转导。ciaH感受外界氟刺激,通过胞内的应答调节子来调节一些基因的表达,从而提升细菌的氟抗性。
Eno编码烯醇酶,pykF编码丙酮酸激酶,且这2种酶催化相邻的步骤。糖酵解中,2-磷酸甘油酸经烯醇酶催化生成PEP,PEP再经丙酮酸激酶催化生产丙酮酸,同时释放ATP。两者共同调节PEP和丙酮酸的比例。PEP是糖转运主要途径PTS系统的必需依赖物,丙酮酸则是糖酵解重要的代谢产物。而氟的抑菌机制主要是抑制细菌糖酵解和糖转运,尤其烯醇酶是其主要作用位点。因此eno和pykF与耐氟菌株的氟抗性密切相关。
本课题组另一实验[12]采用非标记荧光定量技术对变形链球菌亲代及其耐氟菌株的差异蛋白质组学进行了研究,结果显示:在无氟环境中,对数期耐氟菌株eno蛋白表达水平升高,为亲代的3.319倍,pykF蛋白表达水平降低,为亲代的0.332倍。结合本研究结果显示:无氟培养基中,与亲代菌株比较,对数期耐氟菌株pykF mRNA和蛋白表达水平均降低为亲代菌株的0.3倍,两者一致,而Eno mRNA表达水平降低,但蛋白表达水平[12]却升高,这种情况虽然少见,但也有许多研究报道。基因从mRNA翻译为蛋白质的过程还要经历多种因素调节[13],如核糖体开关、调节性RNA等,这些都可能导致mRNA表达水平与蛋白表达水平不一致。另外蛋白的翻译后修饰,如磷酸化等,也可能导致蛋白稳定性增强,从而导致其检测水平升高。目前已在多物种中检测到烯醇酶的翻译后修饰,不排除变链菌耐氟菌株中也存在这种修饰。本研究中,无论对数期还是稳定期,耐氟组较亲代组eno和pykF mRNA表达水平均降低,可能是导致变形链球菌亲代菌株及其耐氟菌株在糖酵解和糖转运上存在差异。与耐氟组比较,含氟组中变形链球菌耐氟菌株eno和pykF mRNA表达水平明显升高,甚至高于亲代组表达水平。结合前述的蛋白表达差异结果,可以合理推测其蛋白表达水平也将升高。本文作者认为:氟对糖酵解和糖转运的抑制反馈性地导致了耐氟菌株eno和pykF基因的表达代偿性升高,部分抵消了氟的抑制作用,从而使耐氟菌株产生氟抗性。研究[14]表明:含氟培养基中,变形链球菌亲代及耐氟菌株的糖摄入量均被抑制,但其对后者的抑制作用明显较弱,说明氟环境中耐氟菌株仍能维持一定的糖转运和糖酵解能力。
关于氟提高ciaH、eno和pykF基因表达水平的机制尚不明确,可能有如下几个原因:① 操纵子调节。操纵子是一些相邻基因组成的DNA片段。操纵子上的调控基因可以结合特定的阻遏蛋白或激活蛋白,从而抑制或激活基因的转录。有时不同的操纵子虽然位于不同的位置,但都受到同一调节蛋白的调控,称为调节子[13]。本研究中eno和pykF的表达水平和趋势相似,且二者催化相邻的酶促反应,不排除其可能受同一调控蛋白调控。② 可能存在某些TCS系统,能感受外界氟离子浓度,继而提高eno和pykF等氟抗性相关基因表达。本实验证明ciaRH TCS很可能就是其中之一。③ 全局调节系统。一些全局调节蛋白,如C反应蛋白(CRP)等,能够监测环境的变化,并与靶基因操纵子结合,调控基因转录[13]。不排除氟抗性全局调节蛋白的存在。④ 代谢产物反馈调节。某些酶催化链反应中,当代谢终产物过多时,可以反馈性抑制酶合成量[15]。同理,氟能竞争性地与烯醇酶结合从而抑制其活性,造成糖酵解终产物的减少,可能反馈性升高eno和pykF基因的表达水平。不过这一过程也常常是通过操纵子或全局调节蛋白等方式起作用。
综上所述,氟环境下变形链球菌耐氟菌株ciaH、eno和pykF基因存在差异表达,且与氟抗性的产生有关。这对于理解细菌基础生理活动和合理用氟防龋等方面具有重要意义。另外,氟抗性的产生机制可能存在于多种层面和多种原因。后续研究仍需探索导致ciaH、eno和pykF表达水平变化的机制,以及在蛋白表达水平上是否存在差异,以便进一步揭开氟抗性产生的原因。
| [1] | 许华, 刘英群. 变异链球菌耐氟菌株的致龋能力[J]. 国际口腔医学杂志, 2013, 40(5): 698–700. DOI:10.7518/gjkq.2013.05.037 |
| [2] | 赵洪岩, 张志民, 朱来宽, 等. 变形链球菌耐氟菌株的体外诱导[J]. 中国实验诊断学, 2010, 14(7): 1095–1096. |
| [3] | Liao Y, Chen J, Brandt BW, et al. Identification and functional analysis of genome mutations in a fluoride-resistant Streptococcus mutans strain[J]. PLoS One, 2015, 10(4): e0122630. DOI:10.1371/journal.pone.0122630 |
| [4] | 卢春英. 变形链球菌耐氟菌株全基因组测序[D]. 长春: 吉林大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10183-1014296052.htm |
| [5] | Mitsuhata C, Puteri MM, Ohara Y, et al. Possible involvement of enolase in fluoride resistance inStreptococcus mutans[J]. Pediat Dent J, 2014, 24(1): 12–16. DOI:10.1016/j.pdj.2013.10.002 |
| [6] | 刘丽慧, 田健, 伍宁丰. 细菌氟抗性研究进展[J]. 中国农业科技导报, 2013, 15(6): 113–118. |
| [7] | Takatoshi M, Nobuhiro H. Contribution of chloride channel permease to fluoride resistance in Streptococcus mutans[J]. FEMS Microbiol Lett, 2016, 363(11): fnw101. DOI:10.1093/femsle/fnw101 |
| [8] | Baker JL, Sudarsan N, Weinberg Z, et al. Widespreadgenetic switches and toxicity resistance proteins for fluoride[J]. Science, 2012, 335(6065): 233–235. DOI:10.1126/science.1215063 |
| [9] | Stockbridge RB, Lim HH, Otten R, et al. Fluorideresistance and transport by riboswitch-controlled CLCantiporters[J]. Proc Natl Acad Sci USA, 2012, 109(38): 15289–15294. DOI:10.1073/pnas.1210896109 |
| [10] | 盛江筠, 朱敏, 黄正蔚, 等. 耐氟菌株及其亲代菌株ATP酶基因的DNA测序[J]. 上海第二医科大学学报, 2005, 25(4): 340–341. |
| [11] | Ahn SJ, Wen ZT, Burne RA. Multilevel control of competence development and stress tolerance in Streptococcus mutans UA159[J]. Infect Immun, 2006, 74(3): 1631–1642. DOI:10.1128/IAI.74.3.1631-1642.2006 |
| [12] | 赵洪岩. 采用非标记定量技术对变形链球菌耐氟菌株的差异蛋白质组学研究[D]. 长春: 吉林大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10183-1011103094.htm |
| [13] | Dale JW, Park SF. Molecular genetics of bacteria 5th ed[M]. Hoboken: Wiley-Blackwell, 2013: 75-122. |
| [14] | 于丹妮. 氟化物对变形链球菌耐氟菌株的葡萄糖摄入量的影响[J]. 天津医药, 2003, 31(7): 414–416. |
| [15] | 姜巨全, 郝林. 微生物生理学[M]. 北京: 中国农业大学出版社,2014: 212-219. |
 2017, Vol. 43
2017, Vol. 43


