扩展功能
文章信息
- 任爱华, 王大伟
- REN Aihua, WANG Dawei
- Hiwi基因靶向沉默对乳腺癌MCF-7/ADM细胞化疗敏感性的影响
- Influence ofHiwigene targeting silencein chemotherapy sensitivity of breast cancerMCF-7/ADMcells
- 吉林大学学报(医学版), 2017, 43(04): 743-746
- Journal of Jilin University (Medicine Edition), 2017, 43(04): 743-746
- 10.13481/j.1671-587x.20170416
-
文章历史
- 收稿日期: 2016-12-25
2. 北华大学基础医学院病理教研室, 吉林 吉林 132013
2. Department of Pathology, School of Basic Medical Sciences, Beihua University, Jilin 132013, China
目前,乳腺癌依然呈现致死率居高不下、发病率逐年上升的趋势, 乳腺癌的治疗主要采取手术切除、化疗及放疗等方式。化疗是乳腺癌重要的治疗手段[1],但是对中晚期乳腺癌治疗效果不佳,尤其化疗过程中较为广泛存在阿霉素耐药, 也是阿霉素治疗乳腺癌失败的主要原因,所以在肿瘤研究中寻找攻克乳腺癌阿霉素耐药的药品及方法已迫在眉睫[2]。乳腺癌阿霉素耐药的机制十分复杂,肿瘤基因治疗耐药性是目前研究的热门方向,研究[3-5]发现:STAT3基因在乳腺癌紫杉醇耐药细胞中的表达明显升高,靶向STAT3基因的RNA干扰能够增强肿瘤化疗药物的疗效;miR-129-3P的高表达可增强乳腺癌细胞的耐药性;下调膜联蛋白A5的表达, 可以增加其对阿霉素的敏感性。应用siRNA抑制多药耐药(MDR1) 基因在MCF7/ADR细胞表达, 可以逆转肿瘤细胞的耐药性[6]。肿瘤的基因治疗是近期最为常用的靶向性抑制特异基因、控制细胞生长的技术,采用基因重组技术抑制细胞内癌基因的表达, 进而特异性抑制肿瘤细胞生长,该方法具有不损伤正常细胞生长的特点。目前,肿瘤发生机制研究常常围绕着干细胞,同时发现Hiwi基因参与干细胞增殖[7],Hiwi基因直接影响干细胞的自我更新。本实验室前期的研究[8]显示:MCF-7乳腺癌细胞系Hiwi基因在mRNA和蛋白质表达水平均升高。Hiwi基因在耐阿霉素乳腺癌MCF-7/ADM细胞株中较非耐药乳腺癌MCF-7细胞表达增高[9]。国内外对于Hiwi基因在乳腺癌阿霉素耐药方面研究鲜有报道,为探讨Hiwi高表达基因是否是产生耐药影响乳腺癌化疗效果的原因,本研究利用RNA干扰技术(RNA沉默技术)靶向沉默Hiwi基因,观察阿霉素对MCF-7/ADM细胞的化疗敏感性。
1 材料与方法 1.1 细胞、材料和主要仪器耐阿霉素人乳腺癌MCF-7/ADM细胞(上海肯强公司)。逆转录试剂盒及定量检测试剂盒(大连宝生物公司),蛋白提取试剂盒和RNA提取试剂盒(北京天恩泽公司),G418、Hiwi蛋白一抗(鼠抗人)和二抗(羊抗鼠)(美国Sigma公司),EndoFectinTM-Plus转染试剂(广州复能公司),pcDNA3.1-Hiwi-2A-EGFP质粒(北华大学惠赠)。紫外分光光度仪(UV1700,日本SHLMADZU公司),荧光定量PCR仪(美国罗氏公司),凝胶成像系统(美国Bio-Rad公司)。
1.2 细胞培养MCF-7/ADM细胞置于含10%灭活胎牛血清的基础培养基, 培养基中加入不同浓度的阿霉素诱导,MCF-7/ADM细胞表现出对阿霉素较高的耐药性。实验前2周置于无阿霉素的培养基中,37℃、5%CO2恒温培养箱内培养,待细胞株融合度达80%~90%,传代,部分冻存。
1.3 Hiwi基因siRNA转染MCF-7/ADM细胞取对数生长期MCF-7/ADM细胞, 接种于24孔细胞培养板,每孔5×104个细胞,细胞融合度达80%~90%时进行基因转染,将细胞分为对照组(Hiwi control)、Hiwi siRNA1组和Hiwi siRNA2组,分别转染Hiwi control、Hiwi siRNA1和Hiwi siRNA2 3种不同载体。靶向Hiwi基因的siRNA由上海生工设计及合成。Hiwi control, 第一链5′-UUCUCCGAACGUGUCACUUTT-3′,互补链5′-ACGUGACACGUUCGGACAATT-3′;Hiwi siRNA1:第一链5′-GCCAGUAAGUGCUUCUACGTT-3′,互补链5′-AGU AGAAGCACUUACUGGCTT-3′;Hiwi siRNA2, 第一链5′-GUGGGCCUUAUAUCAGUAUTT-3′,互补链5′-AUACUGAUAUAACCCCCACTT-3′。根据EndoFectinTMTM-Plus转染试剂盒实验步骤,首先滴加脂质体溶液到含有DNA的试管内,混匀,静置20 min,再加入500 μL培养基(无血清)及DNA-脂质体复合物,恒温培养箱内培养3h,滴加含20%血清的培养基,最后加入400mg·L-1G418进行基因稳定转染细胞筛选。转染24h后,采用Real-time PCR和Western blotting法检测基因干扰后细胞Hiwi基因表达,判断转染效率。
1.4 靶向沉默后Hiwi基因mRNA表达水平检测由上海生工公司设计和合成目的基因。Hiwi基因:上游引物,5′-GCGTTTGGTGGATGATGATTTCT-3′,下游引物,5′-CAGGGCCTCGT-CTTCTACAG-3′,131bp;内参基因β-actin:上游引物,5′-TTCCTGGGCATGGAGTCCT-3′,下游引物,5′-TGATCTTCATTGTGCTGGGTG-3′,187bp。按照试剂盒操作说明书进行细胞RNA提取及逆转录。在冰上配制20μL RT反应液:5× PrimeScriptTM Buffer4 μL,Random 6 mers1 μL,Oligo dT Primer1 μL,PrimeScriptTM RT Enzyme MixⅠ1 μL,RNA1 μg, 用RNase Free dH2O定容至20 μL。37℃、15 min,85℃、5s。置于-20℃冰箱保存。配制20 μLRT-PCR反应体系:ROX Reference Dye(50×) 0.4 μL,cDNA2 μL,Premix Ex TaqTMⅡ(2×)10 μL,上下游引物各0.8 μL,dH2O定容至20 μL。将RT反应液加入RT-PCR反应体系。96℃预变性15s;94℃变性60s,57℃退火60s,71℃延伸60s,共40个循环。凝胶成像系统观察,拍照,记录结果,以各组细胞Hiwi基因和β-actin基因吸光度(A)值比值表示mRNA表达水平。
1.5 靶向沉默后Hiwi基因蛋白表达水平检测加入150μL细胞裂解混合液,吹打数下,4℃低温离心机12 000r· min-1离心5 min,取上清,-80℃冰箱保存。将5×SDS-PAGE蛋白上样缓冲液加入蛋白样品中充分混匀,加热3~5 min,将混合液加入凝胶加样孔中,100V电泳120 min,转膜,封闭60 min,加入一抗抗体,洗膜10 min×3,加入辣根过氧化物酶(HRP)标记的二抗稀释液(1:10)60 min,洗膜10 min×3,加底物,显色,照相,灰度值扫描,记录结果,以目的条带灰度值与参照灰度值比值的百分数表示目的蛋白的相对表达水平。
1.6 MTT法检测细胞存活率取转染后各组MCF-7/ADM细胞,以每孔5×104个细胞均匀种植于96孔板,培养箱中培养24 h。加入浓度分别为0、0.1、0.5和1.0 mg· L-1阿霉素,0 mg· L-1阿霉素组为对照组,每组设5个复孔,培养箱中培养48 h,每孔加入20 μLMTT溶液(5 g·L-1),培养4 h,加入150 μLDMSO,振荡15 min,用酶标仪检测490nm波长处各孔A值。计算转染后各组MCF-7/ADM细胞存活率,代表细胞的耐药敏感性,细胞存活率=处理组A值/对照组A值×100%,各组实验重复3次。
1.7 统计学分析采用SPSS 13.0统计软件及Excell软件进行统计学分析。3组细胞Hiwi mRNA和蛋白表达水平及存活率均以x± s表示,多组间样本均数比较采用单因素方差分析,组间两两比较均采用t检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 Hiwi基因靶向沉默后各组细胞中Hiwi mRNA和蛋白表达水平对照组、Hiwi siRNA1组和Hiwi siRNA2组细胞转染24h后,采用Real-time PCR和Western blotting法检测HiwimRNA和蛋白表达水平。与对照组(0.827±0.020) 比较,Hiwi siRNA1和Hiwi siRNA2组Hiwi mRNA表达水平(0.179±0.018和0.212±0.024) 明显降低(P < 0.01),Hiwi siRNA1组与Hiwi siRNA2组比较差异无统计学意义(P>0.05)。与对照组(80.82%±12.58%)比较,Hiwi siRNA1和Hiwi siRNA2组Hiwi蛋白表达水平(20.52%±9.28%和24.35%±8.99%)明显降低(P < 0.01),Hiwi siRNA1组与Hiwi siRNA2组比较差异无统计学意义(P>0.05)。Hiwi蛋白表达结果见图 1。
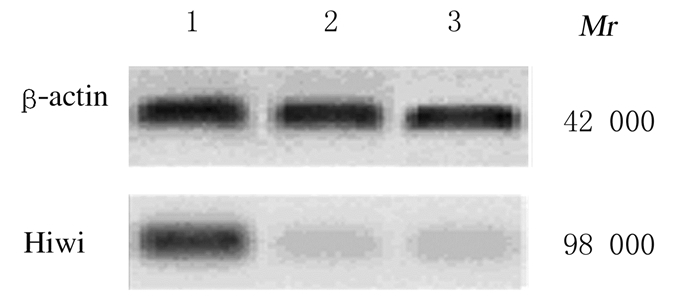
|
| Lane1: siRNA control group; Lane2:Hiwi siRNA1 group; Lane 3: Hiwi siRNA2 group. 图 1 Western blotting法检测各组MCF-7/ADM细胞中Hiwi蛋白表达电泳图 Figure 1 Electrophoregram of expressions of Hiwi protein in MCF-7/ADM cells in various groups detected by Western blotting method |
|
|
沉默MCF-7/ADM细胞中Hiwi基因后应用不同剂量阿霉素作用, MTT法检测细胞对化疗药物的耐药敏感性。对照组细胞存活率略微降低,Hiwi siRNA1和Hiwi siRNA2组随着阿霉素浓度的增加细胞存活率明显降低,阿霉素浓度为1.0mg·L-1时,Hiwi siRNA1和Hiwi siRNA2组细胞存活率分别为(48.15±6.28)%和(41.73±6.17)%, 与对照组(100%)比较,Hiwi siRNA1和Hiwi siRNA2组MCF-7/ADM细胞存活率明显降低(P < 0.01),即对阿霉素的耐药敏感性明显增强;Hiwi siRNA1与Hiwi siRNA2组比较差异无统计学意义(P>0.05)。见图 2。
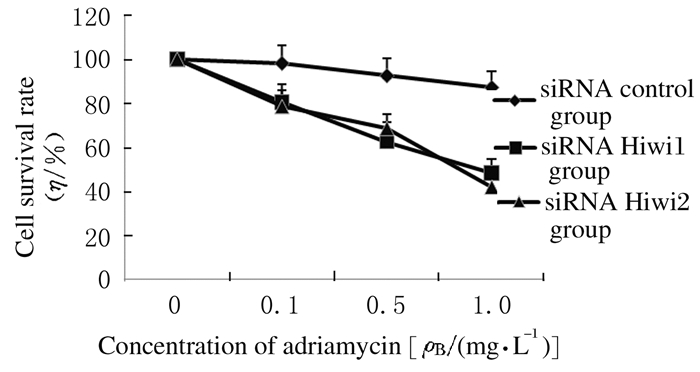
|
| 图 2 不同浓度阿霉素处理后各组MCF-7/ADM细胞存活曲线 Figure 2 Survival curvesofMCF-7/ADM cellsin various groups after treated with different concentrations of adriamycin |
|
|
乳腺癌是女性群体中最常见恶性肿瘤之一[10]。乳腺癌化疗药物中最为常用药物就是阿霉素,但部分乳腺癌细胞对阿霉素耐药,所以在化疗过程中限制了阿霉素的应用。在癌细胞化疗中采用了RNA干扰技术,为高效特异阻断癌基因表达提供了强有力的手段,此技术加快了肿瘤基因治疗的发展[11]。研究[12-13]显示:Hiwi基因表达与肿瘤恶性程度相关,甚至具有致瘤作用,肿瘤中Hiwi的表达可以预测肿瘤预后。研究[14]显示:Hiwi基因在膀胱移行细胞癌中高表达, 且Hiwi基因表达可以辅助判断膀胱移行细胞癌的恶性程度, 而靶向沉默Hiwi基因, 可以作为膀胱癌的辅助治疗。在乳腺癌组织中Hiwi与Hili的表达明显升高, 高表达的Hiwi可导致乳腺癌患者预后较差[15]。上述研究结果与本实验室前期研究[8]结果一致。进一步研究[9]显示:乳腺癌耐药MCF-7/ADM细胞中Hiwi基因呈高表达。为探讨MCF-7/ADM的耐药性是否与Hiwi基因相关,本研究采取Hiwi基因靶向沉默观察乳腺癌耐药细胞化疗敏感性。本研究结果显示:Hiwi siRNA1组和Hiwi siRNA2组细胞中Hiwi基因mRNA和蛋白表达水平明显降低,表明本研究所选取的靶向Hiwi基因siRNA是高效的。本研究结果显示:加入不同浓度的阿霉素,转染HiwisiRNA1和Hiwi siRNA2组细胞存活率明显降低,由此可以证明Hiwi基因在MCF-7/ADM产生耐药性中起到至关重要的作用,本研究为进一步探讨基因治疗结合化疗药物抗耐药的作用机制,以及全面、深入认识Hiwi基因对MCF-7/ADM细胞的调控作用提供了实验依据,为耐药乳腺癌细胞基因靶向治疗提供新的研究方向。
| [1] | Montagnae E, Cancellog G, Dellapasquas S, et al. Metronomic therapy and breast cancer:a systematic review[J]. Cancer Treat Rev, 2014, 40: 942–950. DOI:10.1016/j.ctrv.2014.06.002 |
| [2] | Ta HQ, Thomas KS, Schrecengost RS, et al. A novel association between p130Cas and resistance to the chemotherapeutic drug adriamycin in human breast cancer cells[J]. Cancer Res, 2008, 68(21): 8796–804. DOI:10.1158/0008-5472.CAN-08-2426 |
| [3] | 司方莹. STAT3基因在乳腺癌紫杉醇耐药细胞中的表达及对紫杉醇化疗耐药的影响[D]. 郑州: 郑州大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10459-1015301867.htm |
| [4] | 张媛. miR-129促进乳腺癌细胞多西紫杉醇耐药的探索性研究[D]. 西安: 第四军医大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-90032-1013033484.htm |
| [5] | 张欣. shRNA干扰下调膜联蛋白A5基因表达逆转乳腺癌耐阿霉素细胞株MCF-7/ADR耐药性的研究[D]. 大连: 大连医科大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10161-1015625117.htm |
| [6] | 李臣宾, 张峰, 史玉荣, 等. 小干扰RNA引发多药耐药乳腺癌细胞内MDR1基因沉默的研究[J]. 中华实验外科杂志, 2004, 21(10): 1199–1201. DOI:10.3760/j.issn:1001-9030.2004.10.018 |
| [7] | 胡小辉, 黄胜超, 吴海滨, 等. 靶向Hiwi基因的RNAi对乳腺癌细胞增殖和凋亡的影响[J]. 中国普通外科杂志, 2014, 23(5): 685–688. |
| [8] | 王大伟. Hiwi基因在乳腺癌中的表达及其对乳腺癌细胞生长的影响[D]. 长春: 吉林大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10183-1015590900.htm |
| [9] | 任爱华, 王大伟. Hiwi基因在耐药MCF-7/ADM乳腺癌细胞株中的表达[J]. 北华大学学报:自然科学版, 2017, 18(1): 50–52. |
| [10] | Hsieh CC, Hernandez-Ledesma B, de Lumen BO. Lunasin, a novel seed peptide, sensitizes human breast cancer MDA-MB-231 cells to aspirin-arrested cell cycle and induced apoptosis[J]. Chemi Biol Interact, 2010, 186(2): 127–134. DOI:10.1016/j.cbi.2010.04.027 |
| [11] | Zamore PD. Ancient pathways programmed by small RNAs[J]. Science, 2002, 296(5571): 1265–1269. DOI:10.1126/science.1072457 |
| [12] | Siddiqi S, Terry M, Matushansky I. Hiwimediated tumorigenesis is associated with DNA hypermethylation[J]. Plos One, 2012, 7(3): e33711. DOI:10.1371/journal.pone.0033711 |
| [13] | 高鑫, 李艳琴, 韩代花, 等. HIWI在子宫内膜癌组织中的表达及临床意义[J]. 实用肿瘤杂志, 2016, 31(5): 437–441. |
| [14] | 陈岐辉. 靶向Hiwi基因的RNAi对膀胱癌细胞生物学行为的影响[D]. 长春: 吉林大学, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10183-2009094566.htm |
| [15] | 曹冀为. 高表达的HIWI调节TβR和CDK与乳腺癌预后关系的研究[D]. 苏州: 苏州大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10285-1015404478.htm |
 2017, Vol. 43
2017, Vol. 43


