扩展功能
文章信息
- 王丽萍, 冯若, 邹立洋, 丁一
- WANG Liping, FENG Ruo, ZOU Liyang, DING Yi
- 五倍子酸对人胃癌SGC-7901细胞迁移能力的影响
- Influence of gallic acid in migration ability of human gastric carcinoma SGC-7901 cells
- 吉林大学学报(医学版), 2017, 43(04): 739-742
- Journal of Jilin University (Medicine Edition), 2017, 43(04): 739-742
- 10.13481/j.1671-587x.20170415
-
文章历史
- 收稿日期: 2016-04-21
2. 解放军第301医院输血科, 北京 100853
2. Department of Blood Transfusion Room, No. 301 Hospital of PLA, Beijing 100853, China
五倍子酸(gallic acid, GA)是一种具有抗氧化活性的天然化合物,广泛存在于不同植物中,如五倍子、葡萄、漆树、绿茶、苹果皮、柠檬、菠萝和红葡萄酒[1-3]等,具有多种生物活性,如抗菌、抗病毒、抗炎、抗氧化和抗肿瘤等[4-8]。近年来,国内外学者对GA的抗肿瘤作用进行了大量研究,初步探讨了其抗肿瘤作用的可能机制。本课题组前期研究[9]显示:GA对小鼠胃癌MFC细胞具有较强的体内和体外抑制作用,但其对人胃癌SGC-7901细胞作用的研究尚未见报道。本文作者通过研究GA对体外培养人胃癌SGC-7901细胞生长的影响,旨在探讨GA对人胃癌生长的作用及其机制。
1 材料与方法 1.1 主要试剂和仪器RPMI-1640培养液(美国Hyclone公司),0.25%胰酶和小牛血清(美国Gibco公司),二甲基亚砜(DMSO)和噻唑蓝(MTT)(美国Sigma公司),血管内皮生长因子(VEGF)抗体及SABC免疫组织化学染色试剂盒(武汉博士德公司)。CB150型CO2培养箱(德国Binder公司),PLUS384型全自动酶标仪(美国MDC公司),Ⅸ-70型倒置显微镜(日本Olympus公司)。
1.2 细胞分组和处理取对数生长期的人胃癌SGC-7901细胞(郑州大学组织学与胚胎学教研室保存),制成单细胞悬液,调整细胞浓度为1×105mL-1,接种于96孔板细胞培养板,24h后分别加入不同剂量(0、3.125、6.250、12.500、25.000、50.000和100.000mg·L-1)GA,进行MTT检测。再将细胞浓度调整为1×105mL-1,接种于6孔板,分别采用不同剂量(0、6.250、12.500和25.000 mg·L-1)GA作用24 h,用于细胞划痕实验和免疫细胞化学实验。每组设5个复孔,以0 mg·L-1GA组为对照组。
1.3 MTT法检测SGC-7901细胞增殖抑制率各组细胞培养48 h, 实验终止前每孔加入20 μLMTT并继续培育4 h, 弃去上清液后,每孔分别加入150 μL DMSO,震荡10 min后于全自动酶标仪上测定各孔570nm处的吸光度(A)值,计算细胞增殖抑制率,细胞抑制率=(1-给药孔A值/对照孔A值)×100%。
1.4 细胞划痕实验检测细胞划痕愈合率将对数生长期的SGC-7901细胞常规胰酶消化后制成单细胞悬液加入6孔板中,培养24h后,换成无血清培养基,贴壁形成单层细胞后,用消毒20 μL枪头均匀划4条横线,用PBS洗涤细胞3次,去除划下的细胞,加入不同剂量GA,置入37℃、5%CO2的培养箱中继续培养。0和24h时显微镜下拍照。通过测量划痕宽度计算划痕愈合率,划痕愈合率=(0h划痕宽度-24h划痕宽度)/0h划痕宽度×100%。
1.5 免疫细胞化学法检测VEGF蛋白表达水平将SGC-7901细胞培养在内有洁净盖玻片的6孔板中,让细胞爬片生长,待其生长到对数生长期时,加入不同剂量GA作用24h后,收集玻片,冷丙酮固定10 min,PBS清洗后按SABC法进行操作,一抗为兔抗人VEGF(1:100),湿盒中4℃冰箱过夜。滴加生物素化二抗(1:200),室温30 min,滴加辣根酶标记链霉素亲和素,室温30 min,DAB显色。结果经显微分光光度计定量:每组取3~5张有代表性的标本,随机框取90个细胞测其平均A值,代表VEGF蛋白表达水平。
1.6 统计学分析采用SPSS19.0统计软件进行统计学分析。细胞增殖抑制率、划痕愈合率和VEGF蛋白表达水平均以x± s表示,组间比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 GA作用48 h后各组SGC-7901细胞增殖抑制率不同剂量GA作用于SGC-7901细胞48 h,随着剂量增加,GA对胃癌细胞的抑制作用明显增强。与对照组比较,不同剂量GA组细胞增殖抑制率明显增加(F=59.451,P < 0.01)。见表 1。
| (n=5, x± s, η/%) | ||
| Group | Dose (mg·L-1) | Inhibitory rate of proliferation |
| Control | 0 | 0 |
| GA | 3.125 | 29.162±1.843 |
| 6.250 | 47.943±2.211 | |
| 12.500 | 60.236±2.167 | |
| 25.000 | 69.581±1.709 | |
| 50.000 | 80.192±3.298 | |
| 100.000 | 88.206±2.529 | |
| F | 59.451 | |
| P | < 0.01 | |
采用细胞划痕实验检测各组细胞迁移能力, 细胞划痕后加入无血清培养基, 排除对细胞增殖的影响。GA作用24 h后,6.250、12.500和25.000mg·L-1GA组划痕愈合率分别约35.721%±5.704%、15.343%±7.952%和13.734%±6.252%,与对照组(76.346%±9.564%)比较,不同剂量GA组SGC-7901细胞的划痕愈合率明显降低(P < 0.01)。见图 1(插页四)。
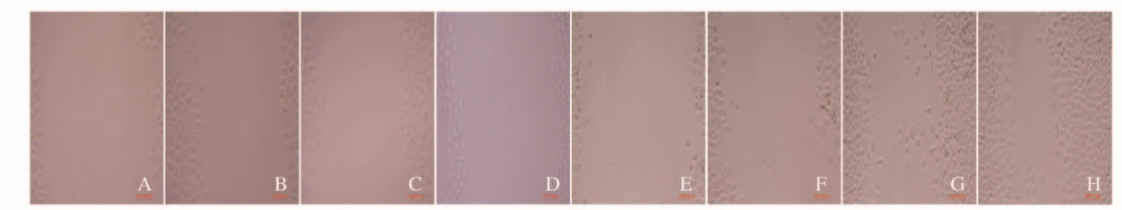
|
| A-D: 0 h; E-H: 24 h; A, E: 25.000 mg ·L-1GA group; B, F: 12.500 mg ·L-1GA group; C, G: 6.250 mg ·L-1GA group; D, H: control group. 图 1 各组SGC-7901细胞的划痕愈合实验结果(×100) Figure 1 Scratch healing test results of SGC-7901 cells in various groups(×100) |
|
|
免疫细胞化学染色显示:VEGF蛋白主要表达于细胞质,VEGF存在部位有棕黄色反应物。对照组细胞染色呈棕褐色,表明VEGF大量存在于细胞中。GA处理24h,6.250mg ·L-1GA组细胞染色与对照组比较无明显差别,12.500和25.000mg ·L-1GA组细胞染色与对照组比较明显减弱(图 2,见封三)。12.500和25.000mg ·L-1GA组VEGF蛋白表达水平分别为0.085±0.017和0.069±0.012,明显低于对照组(0.134±0.013)(P < 0.05)。
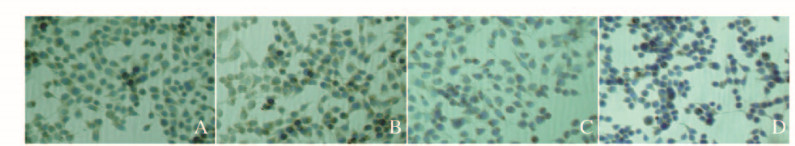
|
| A: Control group; B-D: 6.250, 12.500, and 25.000 mg ·L-1 GA groups. 图 2 各组SGC-7901细胞中VEGF蛋白表达(免疫细胞化学, ×200) Figure 2 Expressions of VEGF protein in SGC-7901 cells in various groups (Immunocytochemistry, ×200) |
|
|
胃癌是我国常见的恶性肿瘤之一,在全球范围内其发病率位于恶性肿瘤第4位,而病死率位居第2位[10]。若能早期诊断,胃癌患者可通过以手术为主的综合治疗达到很好的治疗效果,但多数患者发现时已属中晚期,预后较差。因此,寻找有效的抗肿瘤药物十分必要。GA是一种多酚类化合物,对多种肿瘤具有抑制作用[11]。本研究结果显示:不同剂量GA对人胃癌SGC-7901细胞均具有明显的抑制作用,且具有明显的剂量依赖效应。
侵袭和转移是癌细胞的一个重要特征,与癌症预后密切相关,也是造成癌症患者死亡的主要原因[12]。Heridarian等[13]发现:GA对前列腺癌具有明显的抑制增殖和转移作用;Chen等[14]发现:GA通过抑制基质蛋白酶9的表达抑制乳腺癌MCF-7细胞的转移和侵袭。但GA对人胃癌SGC-7901细胞的作用尚未见报道。本研究结果显示:GA可明显降低人胃癌SGC-7901细胞的划痕愈合率,说明其可以抑制该细胞的迁移。
肿瘤转移是一个多步骤、多因素共同参与的复杂过程,在此过程中, 肿瘤细胞脱离原发灶, 侵袭并播散到其他部位形成转移灶, 该过程需要多分子参与, 如黏附分子、基质降解酶及多种生长因子等。不同因素诱导下, 肿瘤转移的机制不尽相同[15-16]。研究[17]表明:新生血管和淋巴管的形成在肿瘤的发生发展及转移过程中起极其重要的作用,而VEGF通过作用于特异的VEGF受体(VEGFR),参与了肿瘤新生血管、淋巴管的形成过程,与肿瘤的恶性程度及预后有密切关联。为进一步探讨GA调控胃癌转移的可能机制,本文作者检测了GA对肿瘤转移相关指标VEGF的影响,结果显示:中、高剂量GA组胃癌SGC-7901细胞中VEGF表达水平明显降低,提示胃癌细胞可能是通过表达VEGF来诱导其转移。本研究结果显示:应用小剂量GA(6.250mg ·L-1)时即可明显抑制SGC-7901细胞的迁移,而同样剂量下与对照组比较,VEGF蛋白表达水平差异无统计学意义,提示细胞的迁移是一个复杂的过程,细胞内各信号通路相互联系、相互作用,可能还存在其他调控机制。因此,尚需进一步通过动物实验和临床试验来探讨胃癌转移的机制。
| [1] | Johnson JJ, Bailey HH, Mukhtar H. Green tea polyphenols for prostate cancer chemoprevention:a translational perspective[J]. Phytomedicine, 2010, 17(1): 3–13. DOI:10.1016/j.phymed.2009.09.011 |
| [2] | Rasool MK, Sabina EP, Ramya SR, et al. Hepatoprotective and antioxidant effects of gallic acid in paracetamol-induced liver damage in mice[J]. J Pharm Pharmacol, 2010, 62(5): 638–643. DOI:10.1111/(ISSN)2042-7158 |
| [3] | Hsu JD, Kao SH, Ou TT, et al. Gallic acid induces G2/M phase arrest of breast cancer cell MCF-7 through stabilization of p27(Kip1) attributed to disruption of p27(Kip1)/Sk2 complex[J]. J Agric Food Chem, 2011, 59(5): 1996–2003. DOI:10.1021/jf103656v |
| [4] | Hsu WC, Chang SP, Lin LC, et al. Limonium sinense and gallic acid suppress hepatitis C virus infection by blocking early viral entry[J]. Antiviral Res, 2015, 118: 139–147. DOI:10.1016/j.antiviral.2015.04.003 |
| [5] | Kang N, Lee JH, Lee W, et al. Gallic acid isolated from Spirogyra sp. improves cardiovascular disease through a vasorelaxant and antihypertensive effect[J]. Environ Toxicol Pharmacol, 2015, 39(2): 764–772. DOI:10.1016/j.etap.2015.02.006 |
| [6] | Liang W, Li X, Li Y, et al. Gallic acid induces apoptosis and inhibits cell migration by upregulating miR-518b in SW1353 human chondrosarcoma cells[J]. Int J Oncol, 2014, 44(1): 91–98. |
| [7] | You BR, Moon HJ, Han YH, et al. Gallic acid inhibits the growth of HeLa cervical cancer cells via apoptosis and/or necrosis[J]. Food Chem Toxicol, 2010, 48(5): 1334–1340. DOI:10.1016/j.fct.2010.02.034 |
| [8] | Lo C, Lai TY, Yang JS, et al. Gallic acid inhibits the migration and invasion of A375.S2 human melanoma cells through the inhibition of matrix metalloproteinase-2 and Ras[J]. Melanoma Res, 2011, 21(4): 267–273. DOI:10.1097/CMR.0b013e3283414444 |
| [9] | 王丽萍, 曾宪旭, 牛凤兰, 等. 五倍子酸对小鼠胃癌MFC和肝癌H22细胞增殖的抑制作用[J]. 郑州大学学报:医学版, 2012, 47(3): 339–341. |
| [10] | Lozano R, Naghavi M, Foreman K, et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010:a systematic analysis for the Global Burden of Disease Study 2010[J]. Lancet, 2012, 380(9859): 2095–2128. DOI:10.1016/S0140-6736(12)61728-0 |
| [11] | 郗艳丽, 许娜, 李澍, 等. 没食子酸对人非小细胞肺癌A549细胞增殖的抑制作用[J]. 吉林大学学报:医学版, 2016, 42(6): 1092–1098. |
| [12] | 温剑平, 崔永生, 张雄基. 转染EGFRL858R的肺腺癌细胞中IL-6和VEGF表达水平及其意义[J]. 吉林大学学报:医学版, 2016, 42(3): 502–505. |
| [13] | Heidarian E, Keloushadi M, Ghatreh-Samani K, et al. The reduction of IL-6 gene expression, pAKT, pERK1/2, pSTAT3 signaling pathways and invasion activity by gallic acid in prostate cancer PC3 cells[J]. Biomed Pharmacother, 2016, 84: 264–269. DOI:10.1016/j.biopha.2016.09.046 |
| [14] | Chen YJ, Lin KN, Jhang LM, et al. Gallic acid abolishes the EGFR/Src/Akt/Erk-mediated expression of matrix metalloproteinase-9 in MCF-7 breast cancer cells[J]. Chem Biol Interact, 2016, 252: 131–140. DOI:10.1016/j.cbi.2016.04.025 |
| [15] | Qin Q, Wei F, Zhang J, et al. miR-134 suppresses the migration and invasion of non-small cell lung cancer by targeting ITGB1[J]. Oncol Rep, 2017, 37(2): 823–830. |
| [16] | Stivarou T, Patsavoudi E. Extracellular molecules involved in cancer cell invasion[J]. Cancers (Basel), 2015, 7(1): 238–265. DOI:10.3390/cancers7010238 |
| [17] | Chen H, Li L, Wang S, et al. Reduced miR-126 expression facilitates angiogenesis of gastric cancer through its regulation on VEGF-A[J]. Oncotarget, 2014, 5(23): 11873–11885. DOI:10.18632/oncotarget.v5i23 |
 2017, Vol. 43
2017, Vol. 43


