扩展功能
文章信息
- 杨洁, 马英慧, 崔秀成, 王红梅, 董微丽, 谭小波
- YANG Jie, MA Yinghui, CUI Xiucheng, WANG Hongmei, DONG Weili, TAN Xiaobo
- 三七多糖对糖尿病模型大鼠的降血糖作用和眼视网膜病变的治疗作用及其机制
- Hypoglycemic effect of panaxnotoginseng polysaccharides in diabetic model ratsand its therapeutic effect on diabetic retinopathy and their mechanisms
- 吉林大学学报(医学版), 2017, 43(04): 734-738
- Journal of Jilin University (Medicine Edition), 2017, 43(04): 734-738
- 10.13481/j.1671-587x.20170414
-
文章历史
- 收稿日期: 2016-10-11
近年来,代谢疾病在我国的发病率上升速度极快,已经成为除心血管疾病和癌症以外的人类健康“第三杀手”。糖尿病视网膜病变是指机体处于长期高血糖状态出现的视网膜血管自我调节紊乱的疾病。在视网膜病变前期,视网膜血管会出现阻塞,诱发晶状体的改变从而产生视力下降。如血糖持续过高则有可能造成血管增生而导致视网膜剥落,引起失明[1]。对于糖尿病视网膜病变,主要以降血糖为主同时配合神经、血管保护剂对症治疗[2]。现代医学研究[3]显示:许多具有活血化瘀保护血管作用的中药及其提取物,同时具有一定的降血糖作用。三七是具有化瘀作用的中药,是秘方“云南白药”的主要成分之一,具有“止血不留瘀”的功效[4]。研究[5]表明:三七多糖是三七主要有效成分之一,且三七中的多种成分均有一定的降糖作用。目前,国内外尚无使用三七主要有效成分三七多糖治疗糖尿病视网膜病变的相关报道。本研究采用链脲佐菌素(STZ)配合高脂饲料喂养制备2型糖尿病及视网膜病变模型,探讨三七多糖的降糖作用和对糖尿病视网膜病变的治疗作用,同时通过Q-PCR法检测治疗后大鼠视网膜血管内皮生长因子(vascular endothelial growth factor,VEGF)及诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)表达的变化,探讨三七多糖的降糖作用及改善视网膜病变的作用,初步阐明其作用机制。
1 材料与方法 1.1 实验动物和饲料SD大鼠70只,雄性,SPF级,体质量180~220 g,购自河北省实验动物中心,动物许可证号:SCXK(冀)2009-0022。于SPF级别环境中饲养,温度22℃~25℃,湿度50%。高脂饲料含有脂肪类47%,购于河北省实验动物中心。
1.2 主要试剂、药物和仪器STZ、柠檬酸钠和柠檬酸三钠(美国Sigma公司),肝糖原检测试剂盒、一氧化氮(NO)检测试剂盒和谷胱甘肽(GSH)检测试剂盒(南京建成生物工程研究所),Trizol、RevertAid First Strand cDNA Synthesis Kit和MaxinmaSYBR Green/ROX QpcrMastr Mix(美国Thermo公司),其他化学试剂均为国产分析纯。二甲双胍,购于宝芝林药业有限公司,每次灌胃前用蒸馏水配成药物溶液;三七多糖购于西安天瑞生物科技有限公司,采用超声法进行提取,每次灌胃前用蒸馏水配制成所需浓度。荧光定量PCR仪和高速低温离心机(美国Thermo公司),血糖仪及其试纸(瑞士罗氏公司),万分之一天平(瑞士梅特勒公司)。
1.3 动物分组及给药70只SD雄性大鼠分为对照组(10只)和造模组(60只),造模组大鼠给予高脂饲料喂养。2周后,造模组大鼠腹腔注射35mg·kg-1 STZ制备高血糖模型。3 d后,禁食不禁水12h检测空腹血糖(FBG)水平,以FBG>11.1mmol·L-1为造模成功标准。选取造模成功的大鼠,随机分为模型组,二甲双胍(150mg·kg-1)组,三七多糖低、中、高剂量(75、150和300 mg·kg-1)组。各给药组大鼠按给药剂量共灌胃给药8周,每天1次;对照组和模型组大鼠灌胃等量的蒸馏水。
1.4 大鼠血糖和糖耐量检测分别于注射STZ的第3天、第5周和第8周,提前12h禁食不禁水,取大鼠尾部静脉血,采用罗氏血糖仪检测FBG水平。末次给药前12 h,大鼠禁食不禁水,末次给药1 h后,取大鼠尾静脉血检测FBG,作为0时刻血糖值;随后灌胃50%葡萄糖溶液,分别于灌胃后30、60及120 min同样方法采血测定血糖值。按照以下公式计算糖耐量:糖耐量= (FBG0h+FBG30 min)×0.25+(FBG30 min+FBG60 min)×0.25+(FBG60 min+FBG120 min)/2。
1.5 大鼠血清中GSH和NO水平检测末次给药,完成糖耐量检测后,采用4%戊巴比妥钠麻醉大鼠,腹主动脉取血。静置2 h待血液凝固后,3000 r· min-1离心10 min取血清,于-80℃冰箱冻存。第2天按照试剂盒说明检测GSH和NO水平。
1.6 大鼠肝糖原水平检测末次给药取血完成后,剪取分离大鼠肝脏,称质量后置于超低温冰箱冻存。第2天解冻后,按照南京建成试剂盒说明,检测大鼠肝糖原水平。
1.7 大鼠视网膜VEGF及iNOS基因表达水平检测取血完成后,拉紧大鼠眼睑附近皮肤使得大鼠眼球充分突出,使用刀片划破角膜,使得房水、玻璃体等连同视网膜一起剥落,为保证取得视网膜完整,每片刀片使用2次即弃用,保证可以快速地划破角膜。取得的玻璃体和视网膜等置于体式显微镜下逐步分离得到视网膜,整个分离过程在冰上进行。取部分视网膜置于Trizol内保存,随后按照试剂盒说明提取RNA,逆转录后按照Maxinma SYBR Green/ROX QpcrMastr Mix试剂盒说明检测VEGF和iNOS基因表达水平。引物见表 1。以对照组作为参照,采用2-△△Ct法分析并计算基因表达水平。扩增条件:95℃、2min;95℃、5s,60℃、32s,共40个循环。
| Gene | Sequence(5′-3′) |
| iNOS | GCAACATCAGGTCGGCCATTACT AGCCCAGGTCGATGCACAAC |
| VEGF | GTCCAAGATCCGCAGACGTGT ACCCAAAGTGCTCCTCGAAGAGT |
| β-actin | CTGAACCCTAAGGCCAACCGTGAAA TGAAGCTGTAGCCACGCTCGGTC |
分离得到大鼠视网膜,部分视网膜固定于4%的多聚甲醛中,HE染色后镜下观察大鼠视网膜组织形态表现。
1.9 统计学分析采用SPSS 14.0统计软件进行统计学分析。FBG、糖耐量、肝糖原、GSH、NO水平及视网膜VEGF和iNOS基因表达水平以x± s表示,多组间样本均数比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 大鼠造模成功率和三七多糖治疗5及8周后各组大鼠FBG水平60只大鼠共成模53只,造模成功率为88.3%。造模3d后,与对照组比较,STZ造模组大鼠FBG水平明显升高(P < 0.01)。灌胃5周后,与对照组比较,模型组大鼠FBG水平明显升高(P < 0.01);与模型组比较,二甲双胍组和中剂量三七多糖组大鼠FBG水平明显降低(P < 0.05或P < 0.01)。灌胃8周后,与对照组比较,模型组大鼠FBG水平明显升高(P < 0.01);与模型组比较,二甲双胍组和各剂量三七多糖组大鼠血糖水平明显降低(P < 0.01)。见表 2。
| [x± s,cB/(mmol·L-1)] | ||||
| Group | n | FBG | ||
| 3 d after modeling | 5 weeks later | 8 weeks later | ||
| Control | 10 | 4.72±0.62 | 5.13±0.42 | 5.11±0.15 |
| Model | 10 | 18.25±1.36* | 19.94±2.46* | 18.21±2.01* |
| Melbine | 10 | 17.28±2.19* | 8.72±1.10△△ | 7.11±1.29△△ |
| PNP | ||||
| Low dose | 11 | 18.88±1.13* | 15.09±1.73 | 13.00±1.25△△ |
| Middle dose | 11 | 17.92±1.61* | 12.28±1.83△ | 11.62±0.77△△ |
| High dose | 11 | 17.79±1.29* | 13.77±2.99 | 9.14±1.12△△ |
| * P < 0.01 compared with control group; △P < 0.05, △△P < 0.01 compared with model group. | ||||
与对照组比较,模型组大鼠糖耐量水平明显升高(P < 0.01),肝糖原水平明显降低(P < 0.01)。与模型组比较,二甲双胍组和各剂量三七多糖组大鼠糖耐量水平明显降低(P < 0.05或P < 0.01),肝糖原水平明显升高(P < 0.01)。见表 3。
| (x± s) | |||
| Group | n | Sugar tolerance [cB/(mmol·L-1)] | Hepatic glycogen [wB/(mg·g-1)] |
| Control | 10 | 8.33±1.27 | 19.42±1.65 |
| Model | 10 | 59.55±2.91* | 8.33±0.42* |
| Melbine | 10 | 31.73±3.71△△ | 18.98±2.81△△ |
| PNP | |||
| Low dose | 11 | 37.82±3.01△ | 17.28±1.72△△ |
| Middle dose | 11 | 37.11±2.71△ | 17.29±1.95△△ |
| High dose | 11 | 32.37±4.72△△ | 18.13±1.27△△ |
| * P < 0.01 compared with control group; △P < 0.05, △△P < 0.01 compared with model group. | |||
与对照组比较,模型组大鼠血清中GSH水平明显降低,NO水平明显升高(P < 0.01)。与模型组比较,二甲双胍组大鼠GSH水平明显升高(P < 0.05),NO水平明显降低(P < 0.05);高剂量三七多糖组大鼠血清中GSH水平明显升高(P < 0.01),NO水平明显降低(P < 0.05)。见表 4。
| (x± s) | |||
| Group | n | GSH [wB/(mg·g-1)] | NO [wB/(μg·g-1)] |
| Control | 10 | 50.53±4.73 | 30.23±2.17 |
| Model | 10 | 33.65±3.64* | 40.61±1.18* |
| Melbine | 10 | 38.43±3.44△ | 35.27±1.14△ |
| PNP | |||
| Low dose | 11 | 34.75±2.64 | 37.87±2.25 |
| Middle dose | 11 | 35.94±3.74 | 36.12±1.22 |
| High dose | 11 | 40.71±2.19△△ | 34.73±1.44△ |
| * P < 0.01 compared with control group; △P < 0.05, △△ P < 0.01 compared with model group. | |||
与对照组比较,模型组大鼠视网膜中VEGF和iNOS基因表达水平明显上调(P < 0.01)。与模型组比较,高剂量三七多糖组VEGF和iNOS基因表达水平明显降低(P < 0.05)。见表 5。
| (x± s) | |||
| Group | n | VEGF | iNOS |
| Control | 10 | 1.010±0.070 | 1.007±0.056 |
| Model | 10 | 1.713±0.011* | 1.572±0.022* |
| Melbine | 10 | 1.701±0.061 | 1.302±0.081 |
| PNP | |||
| Low dose | 11 | 1.759±0.019 | 1.468±0.091 |
| Middle dose | 11 | 1.681±0.071 | 1.409±0.094 |
| High dose | 11 | 1.353±0.032△ | 1.281±0.027△ |
| * P < 0.01 compared with control group; △P < 0.05 compared with model group. | |||
对照组大鼠视网膜表面光滑,结构清晰,未见异常的增生。模型组大鼠视网膜内可见部分小血管增生,视网膜外有萎缩的现象,出现凹凸不平状态。二甲双胍组大鼠视网膜外层光滑,未见视网膜萎缩。低、中剂量三七多糖组大鼠视网膜可见部分血管增生,未见视网膜萎缩;高剂量三七多糖组大鼠未见视网膜萎缩,血管增生状态明显改善。见图 1(插页四)。
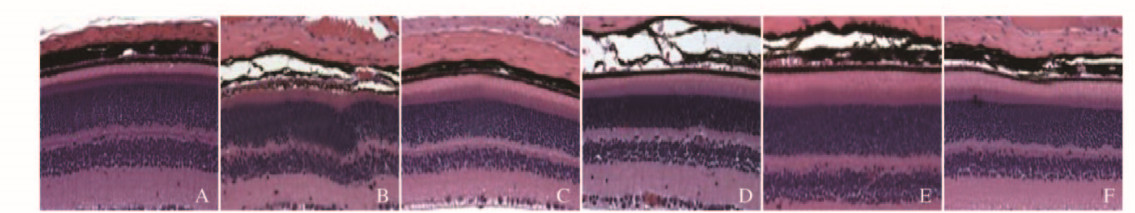
|
| A: Control group; B: Model group; C: Melbine group; D: Low dose of PNP group; E:Middle dose of PNP group; F: High dose of PNP group. 图 1 各组大鼠视网膜HE染色结果(×200) Figure 1 Results of HE staining of retina of rats in various groups(×200) |
|
|
糖尿病的发病率在我国呈迅速上升趋势,流行病学[6]统计显示:在2008年我国糖尿病的发病率为9.6%。糖尿病视网膜病变是由糖尿病诱发的、以微血管损伤为主要特征的糖尿病并发症之一[7-8]。糖尿病眼病的发生主要是由于微血管长期存在于高血糖的状态之下,引起了视网膜微血管代谢能力的失常,从而诱发疾病,若不及时治疗最终会导致患者失明[9]。中医学研究[10]认为:糖尿病视网膜病变属于血瘀证的范畴,需要活血化瘀。三七是重要的活血化瘀药物之一,本研究观察了三七主要成分三七多糖对糖尿病及其引起的视网膜病变的治疗作用。
本研究结果显示:三七多糖可以降低糖尿病大鼠的随机血糖、糖耐量和肝糖原水平,起到一定控制血糖的作用;给药第5周时,中和高剂量三七多糖降血糖水平相近,表明5周时中剂量三七多糖即可达到良好的降糖效果;但从肝糖原水平上看,高剂量三七多糖降糖效果仍较明显。糖尿病视网膜病变的主要原因是高血糖引发的机体氧化应激反应,表现为抗氧化物质GSH水平的降低和氧化炎症因子NO水平的升高[11-12]。而GSH水平降低和NO水平升高会导致视网膜血流的改变,增加白细胞黏滞,促进视网膜基底膜的增厚,逆转这2种因子的表达可以起到改善视网膜血流的作用[13]。本研究结果显示:三七多糖可以逆转GSH和NO水平变化引起的视网膜病理变化。此外,研究[14]显示:糖尿病视网膜病变患者的VEGF基因表达水平升高,最终导致视网膜血管通透性增加,加剧了视网膜破损和渗血。本研究结果显示:三七多糖可以抑制视网膜VEGF基因表达,降低血管通透性,从而缓解糖尿病诱发的视网膜病变。
综上所述,三七多糖具有降血糖的作用,同时可以通过升高GSH和NO水平,提高VEGF和iNOS基因表达,起到改善糖尿病引起的视网膜病变的作用。
| [1] | McDowell RE, McGahon MK, Augustine J, et al. Diabetes impairs the aldehyde detoxifying capacity of the retina[J]. Invest Ophthalmol Vis Sci, 2016, 57(11): 4762–4771. DOI:10.1167/iovs.16-19424 |
| [2] | 唐洪梅, 涂星, 柴玉娜, 等. 丹参对葛根治疗糖尿病眼病的协同增效作用机理研究[C]. 广州: 2014年广东省药师周大会, 2014. |
| [3] | 连小燕. 中医"治未病"思想与早期糖尿病眼病危险因素的分析研究[J]. 糖尿病新世界, 2015, 35(4): 215. |
| [4] | 张立海, 慈慧, 管涛. 三七止血与活血化瘀双向调节作用的临床应用[J]. 首都医药, 2014, 21(18): 65–66. DOI:10.3969/j.issn.1005-8257.2014.18.040 |
| [5] | 钟振东, 王春梅, 汪为, 等. 三七总皂苷的抗糖尿病机理及其降血糖成分研究[J]. 四川大学学报:医学版, 2014, 45(2): 235–239. |
| [6] | 翁建平. 对糖尿病流行病学、循证医学及基础研究的探索[J]. 中山大学学报:医学科学版, 2010, 31(2): 166–171, 178. |
| [7] | 韩凤芹. 芪黄明目胶囊治疗非增殖期糖尿病视网膜病变临床疗效观察[J]. 中国实用医药, 2012, 7(7): 178–179. |
| [8] | Mishra M, Zhong Q, Kowluru RA. Epigenetic modifications of Nrf2-mediated glutamate-cysteine ligase:implications for the development of diabetic retinopathy and the metabolic memory phenomenon associated with its continued progression[J]. Free Radic Biol Med, 2014, 10(75): 129–139. |
| [9] | Lahouaoui H, Coutanson C, Cooper HM, et al. Diabetic retinopathy alters light-induced clock gene expression and dopamine levels in the mouse retina[J]. Mol Vis, 2016, 22: 959–969. |
| [10] | 蔡厚田, 刘凤环. 中医辨证治疗糖尿病视网膜病变43例[J]. 河南中医, 2014, 34(9): 1786–1787. |
| [11] | Emery M, Nanchen N, Preitner F, et al. Biological Characterization of Gene Response to Insulin-Induced Hypoglycemia in Mouse Retina[J]. PLoS One, 2016, 11(2): e150266. |
| [12] | Carpi-Santos R, Ferreira MJ, Pereira NA, et al. Early changes in system[J]. Exp Eye Res, 2016, 5(146): 35–42. |
| [13] | 钟春梅. 丹红化瘀口服液对糖尿病视网膜病变的防治作用及机制研究[D]. 广州: 广州中医药大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10572-1014355185.htm |
| [14] | 朱洪丽. 血管内皮细胞生长因子(VEGF)与增殖型糖尿病视网膜病变相关性的研究[D]. 沈阳: 中国医科大学, 2008. http://cdmd.cnki.com.cn/Article/CDMD-10159-2009162308.htm |
 2017, Vol. 43
2017, Vol. 43


