扩展功能
文章信息
- 白静, 冀晓茹, 韩婷, 安春娜, 勾向博, 苏鹏, 王妍
- BAI Jing, JI Xiaoru, HAN Ting, AN Chunna, GOU Xiangbo, SU Peng, WANG Yan
- 芦丁对链脲佐菌素诱导的糖尿病小鼠肾组织形态表现的影响
- Influence of rutin in renal tissue morphology in STZ-induced diabetes mice
- 吉林大学学报(医学版), 2017, 43(04): 729-733
- Journal of Jilin University (Medicine Edition), 2017, 43(04): 729-733
- 10.13481/j.1671-587x.20170413
-
文章历史
- 收稿日期: 2016-10-26
- 网络出版时间: 2017-07-04 09:25:39
2. 华北理工大学冀唐学院, 河北 唐山 063000
2. Jitang School, North China University of Science and Technology, Tangshan 063000, China
糖尿病肾病(diabetic nephropathy, DN)是糖尿病最常见且最严重的微血管并发症之一[1-2]。现阶段治疗主要是根据病期的不同采取相应的措施,如控制血糖以改善肾血流动力学,采用罗格列酮及厄贝沙坦药物治疗等。对早期DN的治疗,抑制早期DN患者的病变,减慢其向终末期肾病的发展速度,对于延缓DN的进展具有重要意义[3]。
黄酮类化合物是一类植物次生代谢产物,广泛存在于多种植物中,本研究室前期研究[4-7]显示:黄酮类化合物具有降糖、降脂、抗氧化和清除自由基等作用。芦丁为荞麦黄酮的主要成分之一,研究[8-10]表明:芦丁具有抗氧化、抗肿瘤、抗炎、免疫调节、降糖、降脂及心脑血管保护等多种功效,临床上早期主要用于防治脑出血等疾病。近年国内外学者报道芦丁具有降糖降脂作用,并取得了许多重要成果,但尚未见芦丁对糖尿病小鼠肾组织损害治疗作用的报道。本实验通过建立1型糖尿病小鼠模型,探讨芦丁对链脲佐菌素(STZ)诱导的1型糖尿病小鼠肾组织形态表现的影响及治疗作用。
1 材料与方法 1.1 实验动物、药品与试剂健康普通级雄性昆明小鼠70只,体质量(35±10) g,军事医学科学院卫生学环境医学研究所培养,动物许可证号:0000349。STZ(德国VETEC公司),羧甲基纤维素钠(CMC,国药集团化学试剂有限公司),芦丁(英国Abcam公司),厄贝沙坦片[批号5A195,赛诺菲(杭州)制药有限公司],Masson三色染色试剂盒(中国Solarbio公司)。
1.2 主要仪器5D系列血糖仪和血糖仪试纸[京药监械(准)字2012第2400599号,北京怡成生物电子技术股份有限公司], Chemray 240型全自动生化分析仪(美国Rayto公司),低温高速离心机(德国Eppendorf公司),BX-53型光学显微镜(日本O lympus公司),日立H-7650透射电子显微镜(日本日立公司)。
1.3 1型糖尿病小鼠模型的建立和给药70只健康雄性昆明小鼠在动物实验中心开放性饲养1周,其中12只小鼠作为正常组,其余58只小鼠制备1型糖尿病模型。小鼠腹腔注射62.5mg·kg-1STZ,每日1次,连续5d;72h后尾部静脉取血测定小鼠血糖水平,随机餐后血糖水平大于16.6mmol·L-1即认为造模成功。造模成功57只小鼠,成模率为98%。随机选取48只造模成功小鼠分为模型组、低剂量芦丁组、高剂量芦丁组和厄贝沙坦组,每组12只。厄贝沙坦组小鼠给予45mg·kg-1厄贝沙坦混悬液,低剂量芦丁组小鼠给予50mg·kg-1芦丁,高剂量芦丁组小鼠给予100mg·kg-1芦丁[11],正常组和模型组小鼠给予10mg·kg-1 0.1%CMC。各组小鼠均经口灌胃给药,每日1次,持续8周。
1.4 实验指标检测8周后,小鼠尾静脉取血采用血糖仪测定各组小鼠的随机血糖,称量各组小鼠体质量;各组小鼠禁食12h,麻醉后摘除眼球取血,4℃、3000r·min-1离心10 min,吸取上清液,采用Rayto全自动生化分析仪测定血肌酐(Cre)和尿素氮(BUN)。小鼠处死后立即对其进行解剖,迅速摘取两侧肾脏,去除表面被膜,经生理盐水清洗,滤纸吸干后称质量,一部分放入4%多聚甲醛中固定,一部分放入2%戊二醛中保存;计算肾脏指数,肾脏指数=双肾平均肾质量(mg)/体质量(g)。
1.5 光镜和电镜下观察肾组织形态表现4%多聚甲醛固定肾脏组织,冲水,梯度酒精脱水、二甲苯透明,浸蜡、包埋、切片,HE染色及Masson染色,光镜下观察肾组织形态表现和肾组织纤维化程度。2.5%戊二醛固定肾组织,采用透射电镜观察肾组织超微结构。
1.6 统计学分析采用SPSS 17.0统计软件进行统计学分析。各组小鼠体质量、血糖、血Cre、血BUN和肾脏指数均以x± s表示,组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果 2.1 给药前后各组小鼠体质量给药前各组小鼠体质量比较差异无统计学意义(P>0.05);与正常组比较,给药后各组小鼠体质量均明显下降(P<0.05)。见表 1。
| (n=12, x± s, m/g) | ||||
| Group | Dose(mg·kg-1) | Bodyweight before adminstration | Bodyweight after administration | |
| 4 week | 8 week | |||
| Normal | 0 | 40.88±0.91 | 42.64±1.99 | 45.37±2.34 |
| Model | 0 | 40.60±1.86 | 37.19±2.77* | 38.43±3.84* |
| Rutin | ||||
| Low dose | 50 | 42.60±1.56 | 35.80±3.31* | 36.81±2.50* |
| High dose | 100 | 41.84±1.24 | 34.45±2.87* | 35.69±2.95* |
| Irbesartan | 45 | 42.00±2.37 | 36.05±1.93* | 34.57±2.17* |
| *P < 0.05 vs normal group. | ||||
与正常组比较,给药前模型组、低剂量芦丁组、高剂量芦丁组和厄贝沙坦组小鼠血糖水平明显升高(P<0.05)。给药4周后,与模型组比较,低、高剂量芦丁组小鼠血糖水平明显降低(P<0.05);与厄贝沙坦组比较,低、高剂量芦丁组小鼠血糖水平也明显降低(P<0.05);8周后血糖水平下降不明显。见表 2。
| [n=12, x± s, cB/(mmol·L-1)] | ||||
| Group | Dose(mg·kg-1) | Blood glucose before administration | Blood glucose afteradministration | |
| 4 week | 8 week | |||
| Normal | 0 | 7.41±10.11 | 5.12±0.80 | 6.88±1.50 |
| Model | 0 | 22.74±5.93* | 25.07±3.23* | 24.40±2.63* |
| Rutin | ||||
| Low dose | 50 | 19.56±2.34* | 19.47±2.58*△# | 21.64±1.43* |
| High dose | 100 | 18.87±5.88* | 19.98±2.86*△# | 22.10±1.73* |
| Irbesartan | 45 | 20.83±6.31* | 24.25±4.53* | 24.40±3.41* |
| *P < 0.05 vs normalgroup; △P < 0.05 vs modelgroup; #P < 0.05 vs Irrbesartan group. | ||||
与正常组比较,模型组小鼠血Cre、BUN和肾脏指数均明显升高(P<0.05);与模型组比较,各剂量芦丁组小鼠血Cre和BUN水平明显降低(P<0.05),厄贝沙坦组小鼠血BUN水平下降不明显(P>0.05);与模型组比较,高剂量芦丁组小鼠肾脏指数明显降低(P<0.05),低剂量芦丁组和厄贝沙坦组小鼠肾脏指数下降不明显(P>0.05)。见表 3。
| (n=12,x± s) | ||||
| Group | Dose (mg·kg-1) | Cre [cB/(μmol·L-1)] | BUN [cB/(mmol·L-11)] | Kidney index |
| Normal | 0 | 25.20±3.40 | 8.67±1.60 | 6.22±0.63 |
| Model | 0 | 37.00±6.30* | 23.93±7.16* | 7.86±0.47* |
| Rutin | ||||
| Low dose | 50 | 29.83±5.67△ | 14.61±7.51△ | 7.26±0.73* |
| High dose | 100 | 29.20±4.60△ | 14.07±5.84△ | 6.98±0.69△ |
| Irbesartan | 45 | 27.00±4.00△ | 18.16±4.90* | 7.13±0.82* |
| *P < 0.05 vs normal group; △P < 0.05 vs model group. | ||||
给药8周后,正常组小鼠肾组织中的肾小球及肾小管形态正常;与正常组比较,模型组小鼠细胞核增多,系膜区增宽,肾小球固缩明显,囊腔增大;与模型组比较,各剂量芦丁组和厄贝沙坦组小鼠上述情况均明显改善。见图 1(插页四)。

|
| A:Normal group; B:Model group; C:Low dose of rutin group; D:High dose of rutin group; E:Irbesartan group. 图 1 各组小鼠肾组织形态表现(HE, ×400) Figure 1 Morphology of kidney tissue of mice in various groups(HE, ×400) |
|
|
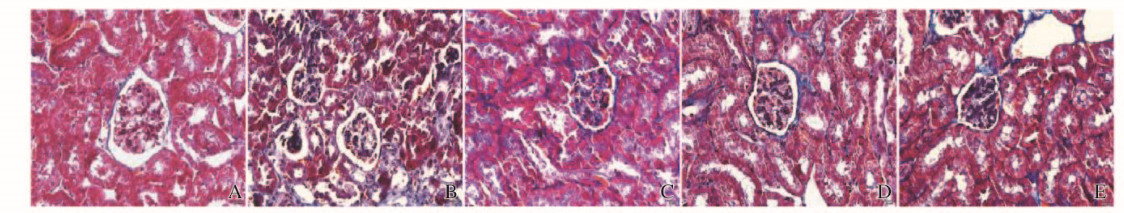
给药8周后, 正常组小鼠肾小球清晰,大小正常,仅在肾小球基底处有少许被染成蓝色的胶原纤维,纤维化程度极低; 与正常组比较,模型组小鼠肾间质蓝染胶原纤维增多,组织纤维化程度严重;与模型组比较,各剂量芦丁组和厄贝沙坦组小鼠肾组织纤维化程度均有不同程度的改善。见图 2(插页四)。
|
| A:Normal group; B:Model group; C:Low dose of rutin group; D:High dose of rutin group; E:Irbesartan group. 图 2 各组小鼠肾组织Masson染色结果(×400) Figure 2 Results of Masson staining of kidney tissue of mice in various groups(×400) |
|
|
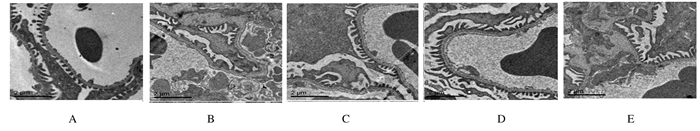
给药8周后,电镜下观察:正常组小鼠肾组织中肾小球基底膜厚度均匀、平滑,足细胞结构完整,足突排列整齐清晰,无融合现象;与正常组比较,模型组小鼠肾小球基底膜弥漫性增厚,足细胞数量减少,足突排列不整齐、增宽,出现融合甚至消失;与模型组比较,各剂量芦丁组和厄贝沙坦组小鼠肾组织上述现象均不同程度改善,高剂量芦丁组改善情况最明显。见图 3。
|
| A:Normal group; B:Modelgroup; C:Lowdose of rutin group; D:Highdose of rutin group; E:Irbesartangroup. 图 3 各组小鼠肾组织超微结构(bar=2 μm) Figure 3 Ultrastructures of kidney tissue of mice in various groups (bar=2 μm) |
|
|
近年来,越来越多的糖尿病患者死于DN,延缓DN病程及控制DN患者的血糖目前仍以药物为主,选用的药物要对肾损伤小且肾负担小[12-13]。研究[14]表明:芦丁具有降糖、降脂、抗炎、抗肿瘤和抗氧化作用。肾组织纤维化是DN的常见表现,是慢性肾病转化为肾功能衰竭的主要病理特征和共同途径[15]。由于HE染色不能清晰地显示出肾组织胶原纤维,难以辨别轻度的纤维化,故采用Massson染色来观察肾组织纤维化的程度。Massson染色是传统的经典胶原纤维染色法,在慢性炎症和机化等病变中可出现胶原纤维增生,Massson染色可以辅助HE染色判断组织纤维化程度,此法在病理诊断、疾病鉴别及研究工作中有非常重要的作用。足细胞是高度分化的细胞,不可再生,足细胞损伤在DN中有重要意义,足细胞数量减少和肾组织基底膜增厚造成的肾小球滤过屏障破坏无法修复[16]。
本研究采用腹腔注射STZ破坏小鼠体内胰岛β细胞,制备1型糖尿病模型,测定造模后小鼠的随机血糖浓度,大于16.6mmol·L-1者视为造模成功,此法成模率高达98%。本研究中与正常组比较,其余各组小鼠血糖水平均明显升高;低、高剂量芦丁组小鼠的精神状态较模型组小鼠改善明显,多饮、多食和多尿症状减缓;与正常组比较,模型组小鼠血Cre、BUN和肾脏指数明显升高,表明该造模方式能造成肾损害;与模型组比较,低、高剂量芦丁组小鼠血Cre与BUN水平和肾脏指数均明显降低,表明芦丁可在一定程度上减轻肾损害,且有一定的降血糖功效,给予较高剂量芦丁治疗效果更为明显。本研究中光镜及电镜观察结果显示:与正常组比较,模型组小鼠肾组织的形态表现为细胞核增多、系膜区扩张和肾小球固缩,肾小球系膜细胞增殖及肾小管间质纤维化,肾小球基底膜弥漫性增厚,足细胞数量减少,足突排列不整齐、增宽,出现融合甚至消失等;与模型组比较,各治疗组小鼠上述情况均明显改善。本研究组织形态表现观察结果表明:芦丁对糖尿病小鼠肾脏有一定的保护作用。本研究结果为采用芦丁治疗DN、改善肾组织形态表现提供了依据。
综上所述,芦丁可降低糖尿病小鼠血糖,减缓糖尿病的症状,改变肾组织形态,并能降低Cre、BUN水平和肾脏指数,从而改善STZ诱导的糖尿病小鼠肾功能和肾组织的损害程度,对高血糖引起的肾疾病有一定的治疗作用。
| [1] | 毛志敏, 万毅刚, 孙伟, 等. 黄葵胶囊抑制糖尿病肾病肾组织氧化应激和p38MAPK信号通路活性改善肾纤维化的作用和机制[J]. 中国中药杂志, 2014, 39(21): 4110–4117. |
| [2] | 韦晓虹, 徐芬, 周丹莉, 等. 链脲佐菌素诱导的1型糖尿病小鼠肾脏COX-2/PGE2/EPs的表达[J]. 中山大学学报, 2015, 36(1): 88–96. |
| [3] | Cherney DZ. Advances in the treatment of diabetic nephropathy[J]. Nephrol News Issues, 2013, 27(5): 18, 33. |
| [4] | Abdel-Raheem IT. Gastroprotective effect of rutin against indomethacin-induced ulcers in rats[J]. Basic Clin Pharmacol Toxicol, 2010, 107(3): 742–750. DOI:10.1111/j.1742-7843.2010.00568.x |
| [5] | 陈秋荣. 黄酮类化合物药理作用的分析[J]. 中国实用医药, 2012, 7(21): 254–255. DOI:10.3969/j.issn.1673-7555.2012.21.198 |
| [6] | Zielińska D, Turemko M, Kwiatkowski J, et al. Evaluation of flavonoid contents and antioxidant capacity of the aerial parts of common and tartary buckwheat plants[J]. Molecules, 2012, 17(8): 9668–9682. |
| [7] | Zhang BN, Han SY, Wang ZL, et al. Protective effects of rutin from buckwheat flowers and leaves on diabetic cardiomyopathy[J]. Lat Am J Pharm, 2013, 32(5): 674–678. |
| [8] | Hatamnia AA, Rostamzad A, Malekzadeh P, et al. Antioxidant activity of different parts of Pistacia khinjuk Stocks fruit and its correlation to phenolic composition[J]. Nat Prod Res, 2016, 30(12): 1445–1450. DOI:10.1080/14786419.2015.1060593 |
| [9] | Han Y, Lu JS, Xu Y, et al. Rutin ameliorates renal fibrosis and proteinuria in 5/6-nephrectomized rats by anti-oxidation and inhibiting activation of TGF-β1-smad signaling[J]. Int J Clin Exp Pathol, 2015, 8(5): 4725–4734. |
| [10] | 潘敬芳, 刘云涛, 简磊. 芦丁对糖尿病小鼠降血糖作用研究[J]. 解放军药学学报, 2016, 32(3): 243–245. |
| [11] | 苗建红, 白静, 李响, 等. 芦丁对2型糖尿病大鼠糖脂代谢及肾功能的影响[J]. 中药药理与临床, 2014, 30(6): 48–51. |
| [12] | Tu X, Ye X, Xie C, et al. Combination therapy with Chinese medicine and ACEI/ARB for the management of diabetic nephropathy:The promise in research fragments[J]. Curr Vasc Pharmacol, 2015, 13(4): 526–539. DOI:10.2174/1570161112666141014153410 |
| [13] | Kowalski A, Krikorian A, Lerma EV. Diabetic nephropathy for the primary care provider:new understandings on early detection and treatment[J]. Ochsner J, 2014, 14(3): 369–379. |
| [14] | Babu PV, Liu D, Gilbert ER. Recent advances in understanding the anti-diabetic actions of dietary flavonoids[J]. J Nutr Biochem, 2013, 24(11): 1777–1779. DOI:10.1016/j.jnutbio.2013.06.003 |
| [15] | Sun YM, Su Y, Li J, et al. Recent advances in understanding the biochemical and molecular mechanism of diabetic nephropathy[J]. Biochem Biophys Res Commun, 2013, 433(4): 359–361. DOI:10.1016/j.bbrc.2013.02.120 |
| [16] | 苗建红, 白静, 李建成, 等. 芦丁对糖尿病肾病大鼠肾功能及肾组织病理变化的影响[J]. 中国实验方剂学杂志, 2015, 21(13): 122–125. |
 2017, Vol. 43
2017, Vol. 43
