扩展功能
文章信息
- 刘微, 罗晓华, 陈文婧, 董媛, 朱洁, 郭健, 姜勇, 张磊, 孟桂先, 王会岩
- LIU Wei, LUO Xiaohua, CHEN Wenjing, DONG Yuan, ZHU Jie, GUO Jian, JIANG Yong, ZHANG Lei, MENG Guixian, WANG Huiyan
- HSV-2糖蛋白D在昆虫-杆状病毒表达系统中的表达及免疫原性分析
- Expression and immunization assessment of HSV-2 glycoprotein D in baculovirus expression vector system
- 吉林大学学报(医学版), 2017, 43(04): 720-724
- Journal of Jilin University (Medicine Edition), 2017, 43(04): 720-724
- 10.13481/j.1671-587x.20170411
-
文章历史
- 收稿日期: 2016-10-20
生殖器疱疹(genital herpes,GH)在全球范围内已经成为感染率最高的性传播疾病之一,近年来已引起人们的广泛关注[1-2]。Ⅱ型单纯疱疹病毒(herpes simplx virus 2,HSV-2) 是引发GH最主要的病原体,HSV-2是典型的嗜神经病毒[3],一旦感染终身潜伏于宿主体内,亦可通过胎盘和产道感染新生儿,导致流产及新生儿死亡,目前尚无任何有效药物可以将其清除,所以开发有效的HSV-2疫苗是控制病毒传播最有效的手段。HSV-2糖蛋白D(HSV-2 glycoprotein D, gD2) 是介导病毒侵染宿主的一个非常重要的蛋白,具有丰富的中和抗体表位和T细胞表位,能刺激机体产生高水平的中和抗体和病毒特异性的CD4+ T细胞,是目前应用最为广泛的HSV-2疫苗靶点。以gD2为抗原的疫苗种类较多,而重组亚单位疫苗是最早进入临床研究的疫苗形式,英国GSK公司的gD2单价亚单位疫苗和美国Chiron公司的gB2和gD2双价亚单位疫苗均在动物模型上获得了很好的预防效果[4-6],其分别以中国仓鼠卵巢细胞(cricetulus hamster chinese ovary, CHO细胞)和鸡胚成纤维细胞(chicken embryo fibroblast, CEF细胞)为受体进行表达。目前,昆虫-杆状病毒表达系统(baculovirus expression vector system,BEVS)因具有容纳大片段外源基因、表达量高和产物能进行翻译后的加工修饰等优点被广泛应用于基础研究和疫苗生产中[7-8]。本研究利用BEVS表达、纯化gD2胞外区蛋白,并评价其免疫原性,为HSV-2疫苗的研究提供基础和指导方向。
1 材料与方法 1.1 菌株、质粒和主要试剂HSV-2 G病毒株、E.coli DH10 Bac、E.coli DH5α、sf9细胞、Vero细胞和pFastBacⅠ载体均由吉林大学艾滋病疫苗国家工程实验室保存。BALB/c小鼠由长春生物制品所提供。Cell fectinⅡ转染试剂、杆状质粒提取试剂盒购自美国Invitrogen公司,sf-900Ⅲ SFM无血清培养基购自美国Gibico公司,Prime star高保真DNA聚合酶、限制性内切酶BglⅡ和XhoⅠ购自日本TaKaRa公司,T4连接酶购自美国Promega公司,gD2多克隆抗体由吉林大学艾滋病疫苗国家工程实验室制备保存,HRP标记的羊抗兔二抗、凝胶DNA回收试剂盒和质粒小量提取试剂盒购自北京天根生化科技有限公司,Ni SepharoseTM 6 Fast Flow基质购自美国GE公司,病毒基因组提取试剂盒购自上海生工生物工程有限公司。
1.2 gD2基因的克隆参照NCBI中HSV-2 HG52病毒株(Genbank No. Z86099.2) gD2的基因序列,利用Primer Premier 5.0软件设计含有His标签的gD2胞外区基因引物:上游引物5 ′-CCGGAATTCATGCATCACCATCACCATCAC-CAT CACAAGTACGCCCTGGCCG-3′,下游引物5′-CCCAAGCTTCTAGTCCTCCAGAAGTGCG-CT -3′,gD2基因两端带有BglⅡ和XhoⅠ酶切位点,引物由上海生工生物工程有限公司合成。取HSV-2 G株感染的Vero细胞,反复冻融3次后,3000 r·min-1离心10 min,于上清液中提取HSV-2基因组,作为扩增gD2的模板。PCR反应体系:模板DNA 2 μL,上、下游引物各1 μL,Prime star聚合酶1 μL,dNTP 4 μL,10×PCR buffer 5 μL,去离子水37 μL。PCR反应条件:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min;72 ℃终延伸10 min。PCR产物用0.8%琼脂糖凝胶电泳进行鉴定。
1.3 pFastBac-gD2的构建由于gD2基因引物5′端带有保护性碱基,可直接酶切,用BglⅡ和XhoⅠ对gD2片段和pFastBacⅠ载体进行双酶切,胶回收后连接过夜,连接产物转入E.coli DH5α感受态细胞,筛选阳性克隆,测序。
1.4 gD2-Bacmind杆粒的构建和鉴定将10 μL pFastBac-gD2质粒转入E.coli DH10 Bac感受态细胞中,冰浴30 min,42 ℃热激90 s,冰浴2 min,加入800 μL无抗性LB培养基,220 r·min -1震荡1 h,37℃,菌体短暂离心后涂布至含有四环素(15 mg·L-1)、卡那霉素(50 mg·L-1)、庆大霉素(50 mg·L-1)、X-gal(20 mg·L-1)和IPTG(40 mg·L-1)的固体培养基上,37℃培养过夜,挑取白斑,接种于含有3种抗性的LB培养基中,提取杆状病毒骨架质粒,具体步骤参照试剂盒说明书操作,PCR鉴定质粒小提产物,以0.8%琼脂糖凝胶电泳进行检测。
1.5 重组杆状病毒的制备将构建好的gD2-Bacmind与转染试剂Cell fectinⅡ置于不完全培养基中充分混合15~45 min后,加入到含有70%~80%融合的sf9细胞6孔板中,27 ℃孵育5 h,吸去上清液,加入完全培养基2 mL,27 ℃培养72 h,1000g离心5 min收获上清,即为第1代重组病毒(P1),继续感染sf9细胞3次后即获得第4代重组病毒(P4),待感染细胞出现明显病变反应时收获病毒。
1.6 病毒滴度的测定将sf9细胞浓度调整至2×105mL-1,接种于24孔板中,每孔500 μL,待完全贴壁后,弃去培养基,将P4代病毒液做系列10倍梯度稀释:10-3~10-8,细胞和病毒稀释液27℃共同培养1 h。吸弃液体,将2%低熔点琼脂糖与等体积2×维持培养基混匀,覆于细胞表面,注意避免产生气泡。待琼脂糖凝固后于27℃培养10d,每天观察空斑的变化,第11天用结晶紫染色,计数噬斑。病毒滴度(pfu·L-1)=噬斑个数×稀释倍数/每孔病毒液体积。
1.7 重组gD2大量表达和纯化取对数生长期(2×106mL-1)悬浮培养sf9细胞。采用P4病毒进行感染,27 ℃、110 r·min-1悬浮培养。收获感染细胞上清,采用Ni-NTA亲和层析柱纯化上清液,以含50、100、300和500 mmol·L-1咪唑的变性缓冲液进行梯度洗脱,收集各梯度洗脱液,SDS-PAGE及Western blotting法分析蛋白纯化情况,采用Gel DOCTM凝胶成像系统分析各样品中重组蛋白表达量占总蛋白量的百分比。
1.8 免疫小鼠将BALB/c小鼠随机分为2组,每组5只,采用纯化后的gD2重组蛋白进行皮下免疫(gD2组),以PBS作为阴性对照(PBS组)。免疫时间为第0、2和4周,初次免疫使用弗氏完全佐剂,加强免疫使用弗氏不完全佐剂,第6周小鼠尾静脉取血,4℃放置过夜,分离血清,-80℃保存备用。
1.9 gD2特异性IgG抗体滴度检测采用1.25 mg·L-1原核表达的gD2重组蛋白包被96孔酶标板,每孔100 μL,4℃过夜;用含3%脱脂奶粉的PBS于37℃封闭2 h;PBST洗涤3次后依次加入1:200起始梯度稀释的血清标本,每孔100 μL,37℃孵育1 h;PBST洗涤3次后加入1:5000稀释的HRP标记山羊抗小鼠IgG二抗,每孔100 μL,37℃孵育1 h;PBST洗涤3次后加入TMB显色10~15 min;2 mmol·L-1硫酸终止;酶标仪检测450nm处的吸光度(A)值,各实验组均设空白和复孔,目测颜色反应,以实验组A值/空白组A值≥2为阳性结果,计算Cut-off值。
1.10 统计学分析采用SPSS 10.0统计软件进行统计学分析。2组小鼠在第2、4和6周时血清中gD2特异性IgG抗体滴度以x± s表示,组间比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 重组质粒pFastBac-gD2的构建和鉴定以HSV-2基因组为模板,PCR扩增获得一条940bp左右的DNA片段,与预期相符(图 1)。将gD2胞外区基因克隆至pFastBacⅠ上,经BglⅡ和XhoⅠ双酶切鉴定,得到940和4775 bp 2条DNA条带,与预期相符(图 2)。将鉴定后的pFastBac-gD2送测序,结果正确。
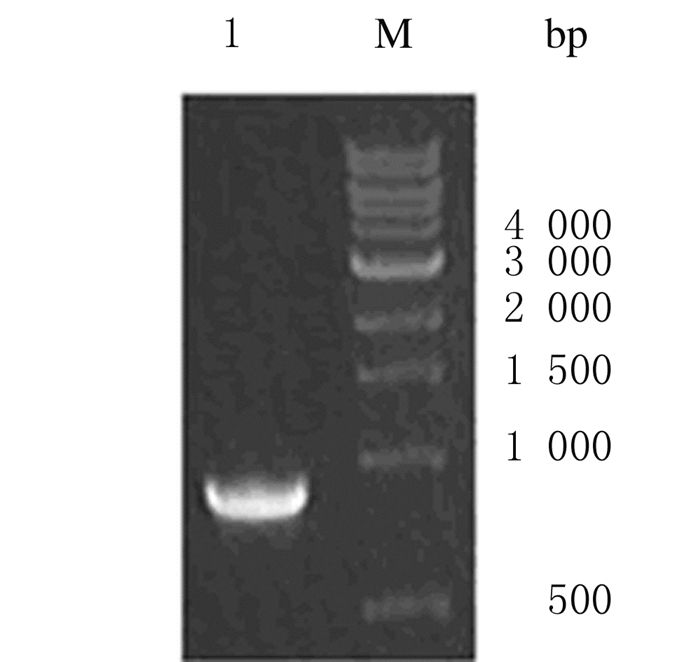
|
| M: 1000bp marker; Lane 1:gD2. 图 1 gD2胞外区基因PCR扩增电泳图 Figure 1 Electrophoregram of gD2 extracellular domain fragment gene amplified by PCR |
|
|
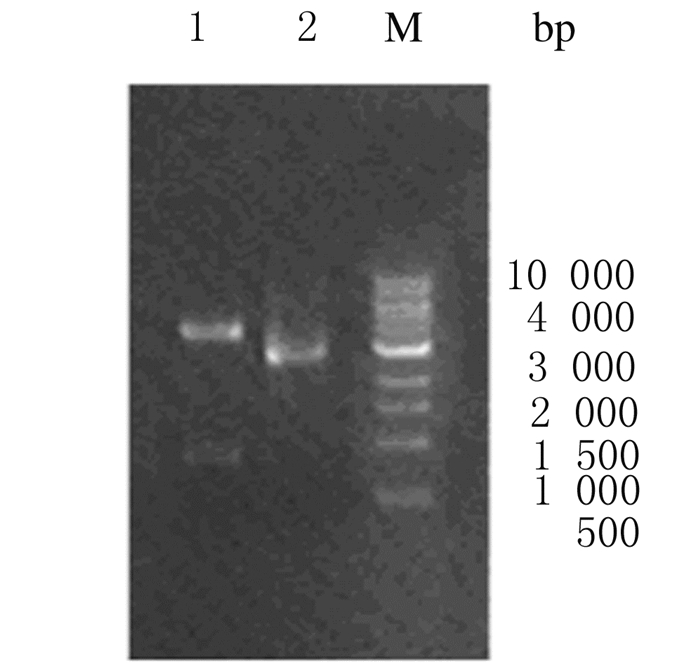
|
| M: 1000bp marker; Lane 1:Restriction of pFastBac-gD2(BglⅡ/XhoⅠ); Lane 2:pFastBac-gD2 plasmid. 图 2 重组质粒pFastBac-gD2酶切鉴定电泳图 Figure 2 Electrophoregram of digestion identification of recombinant plasmid pFastBac-gD2 |
|
|
gD2-Bacmind杆粒经2次PCR鉴定:采用gD2特异性引物进行扩增,产生一条940bp左右的片段,与预期相符;采用杆状病毒M13通用引物进行扩增,产生一条约3500bp的片段,与预期相符(图 3)。
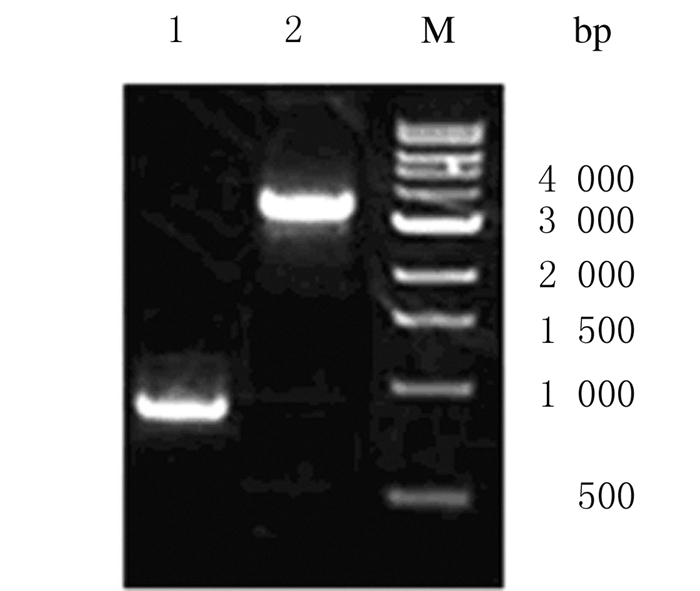
|
| M: 1000bp marker; Lane 1;PCR identification by gD2 specific primer; Lane 2;PCR identification by M13 primer. 图 3 重组杆粒gD2-Bacmind PCR鉴定电泳图 Figure 3 Electrophoregram of identification of recombinant bacmid gD2-Bacmind by PCR |
|
|
将重组杆状病毒质粒gD2-Bacmind转染Sf9细胞,P1代病毒未出现明显的细胞病变反应,P2~P4代病毒可观察到细胞变大、变圆、轮廓模糊等病变特征,甚至部分细胞出现破裂死亡,说明重组杆状病毒包装成功。通过空斑实验检测P4代病毒滴度为2.0×109 pfu·mL-1。Western blotting法检测,P1代病毒感染的细胞未表达gD2重组蛋白,P2~P4代病毒感染的细胞明显表达gD2重组蛋白,相对分子质量约为37000(图 4),且蛋白表达量随感染代次的递增而升高。P4代病毒大量感染细胞,超声上清经Ni-NTA亲和树脂纯化,梯度浓度咪唑洗脱结果显示:300 mmol·L-1咪唑浓度洗脱量最大,纯度达90%以上(图 5)。
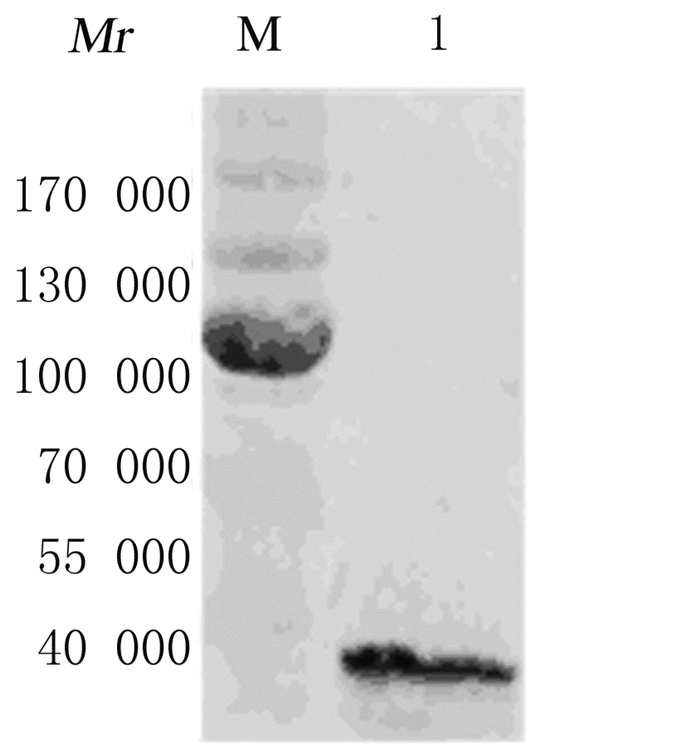
|
| M:Protein marker; Lane 1:Supernatant of sf9 cells infected by P4 recombinant baculovirus. 图 4 Western blotting法检测P4代重组病毒gD2重组蛋白表达电泳图 Figure 4 Western blotting analysis of gD2 expression of P4 recombinant baculovirus |
|
|
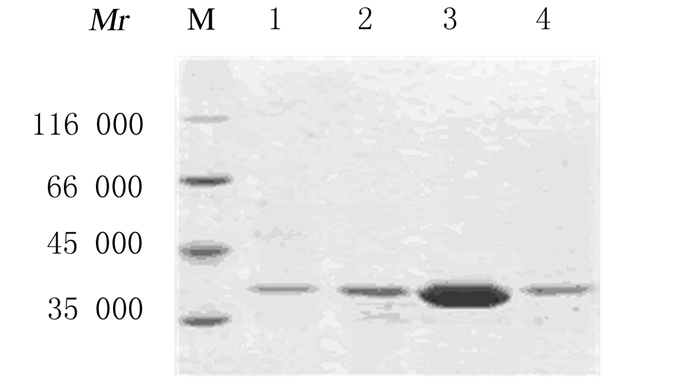
|
| M: Protein marker; Lane 1-4:Supernatant eluted by 50, 100, 300 and 500 mmol·L-1imidazole. 图 5 重组gD2蛋白亲和层析纯化电泳图 Figure 5 Electrophoregram of Ni-NTA affinity chromatography of gD2 recombinant protein |
|
|
gD2组小鼠产生gD2特异性IgG抗体。小鼠初次免疫后血清中抗体的效价较低,IgG抗体滴度Log10平均值约为3.61,经2次加强免疫,小鼠血清抗体滴度明显升高,平均值达到4.34,与PBS组比较差异有统计学意义(P < 0.01)。PBS组小鼠无阳性反应(表 1)。
| (n=5, x± s) | |||
| Group | gD2-specific IgG | ||
| 2nd week | 4th week | 6th week | |
| PBS | 0.84±0.69 | 0.84±0.69 | 0.90±0.74 |
| gD2 | 3.61±0.16* | 3.99±0.10* | 4.34±0.12* |
| * P < 0.01 compared with PBS group. | |||
截至2008年,全球每年GH新发病例约2 300万。GH分为原发感染和复发感染,原发感染者临床症状不明显,复发感染病情严重,患者会出现生殖器水疱、糜烂和溃疡等症状,甚至并发全身症状如发热、头痛、全身不适和肌肉酸痛等。HSV-2是诱发GH的主要病原体,病毒在原发感染之后,沿感觉神经的轴突传递到中枢神经系统的背根神经节进行潜伏,并会受某些因素活化而形成复发感染,如激素分泌、免疫力降低、紫外线照射和发热等[9-10]。目前临床上尚无可以彻底清除HSV-2的药物,因此开发有效的疫苗是控制病毒蔓延和治疗生殖器疱疹的有利武器,但由于对HSV-2的致病机制缺乏认识,至今仍无疫苗被批准上市。
HSV-2通过其表面糖蛋白gD2与宿主细胞的HVEM和Nectin-1等受体进行特异性识别[11-13],进而侵染宿主细胞。研究[14-15]表明:gD2的胞外结构域(1~305位氨基酸区间的片段)发挥着介导病毒包膜与宿主细胞膜融合的重要作用。重组亚单位疫苗是目前研究最为成熟的HSV-2疫苗形式,已被证明具有较高的安全性,并可激发高水平的中和抗体和细胞免疫应答。重组蛋白表达系统包括原核表达系统和真核表达系统,原核表达系统表达的重组蛋白常常因重组蛋白分子内和分子间二硫键的错配,形成不溶性的包涵体聚合物,产生无活性的蛋白质,因此该原核蛋白表达系统不适合应用于HSV-2亚单位疫苗的研究。BEVS是利用携带有外源目的基因的重组杆状病毒作为载体,在昆虫细胞内进行表达的一个重组蛋白表达系统,与哺乳动物表达系统比较,昆虫细胞的培养条件相对容易满足,培养成本低廉,更适合疫苗的大规模生产。
本研究采用BEVS表达gD2胞外区基因,目的是获得更接近天然结构和活性的gD2重组蛋白。本研究通过PCR扩增将获得的目的基因构建至杆状病毒骨架质粒上并转染sf9细胞,包装成重组杆状病毒。Western blotting法分析显示:P1代病毒不表达目标蛋白,P2、P3和P4代病毒均可表达目标蛋白,经镍柱亲和层析纯化后,纯度达90%以上,将纯化后的重组蛋白免疫小鼠可产生gD2特异性抗体,表明利用BEVS获得的重组gD2蛋白具有很好的免疫原性,可作为HSV-2疫苗的候选。
| [1] | Looker KJ, Magaret AS, Turner KM, et al. Global estimates of prevalent and incident herpes simplex virus type 2 infections in 2012[J]. PLoS One, 2015, 10(1): e114989. DOI:10.1371/journal.pone.0114989 |
| [2] | Gnann JW, Whitley RJ. Clinical practice. Genital herpes[J]. N Engl J Med, 2016, 375(7): 666–674. DOI:10.1056/NEJMcp1603178 |
| [3] | Whitley RJ. Herpes simplex virus infections of the central nervous System[J]. Continuum (Minneap Minn), 2015, 21: 1704–1713. |
| [4] | Bourne N, Bravo FJ, Francotte M, et al. Herpes simplex virus (HSV) type 2 glycoprotein D subunit vaccines and protection against genital HSV-1 or HSV-2 disease in guinea pigs[J]. J Infect Dis, 2003, 187(4): 542–549. DOI:10.1086/jid.2003.187.issue-4 |
| [5] | Uchida H, Chan J, Goins WF, et al. A double mutation in glycoprotein gB compensates for ineffectivegD-dependent initiation of herpes simplex virus type 1 infection[J]. J Virol, 2010, 84(23): 12200–12209. DOI:10.1128/JVI.01633-10 |
| [6] | Awasthi S, Shaw C, Friedman H. Improving immunogenicity and efficacy of vaccines for genital herpes containing herpes simplex virus glycoprotein D[J]. Expert Rev Vaccines, 2014, 13(12): 1475–1488. DOI:10.1586/14760584.2014.951336 |
| [7] | Kelly BJ, King LA, Possee RD. Introduction to baculovirus molecular biology[J]. Methods Mol Biol, 2016, 1350: 25–50. DOI:10.1007/978-1-4939-3043-2 |
| [8] | Kost TA, Kemp CW. Fundamentals of Baculovirus Expression and Applications[J]. Adv Exp Med Biol, 2016, 896: 187–197. DOI:10.1007/978-3-319-27216-0 |
| [9] | Rechenchoski DZ, Faccin-Galhardi LC, Linhares RE, et al. Herpesvirus:an underestimated virus[J]. Folia Microbiol (Praha), 2017, 62(2): 151–156. DOI:10.1007/s12223-016-0482-7 |
| [10] | Gottlieb SL, Johnston C. Future prospects for new vaccines against sexually transmitted infections[J]. Curr Opin Infect Dis, 2017, 30(1): 77–86. |
| [11] | Di Giovine P, Settembre EC, Bhargava AK, et al. Structure of herpes simplex virus glycoprotein D bound to the human receptor nectin-1[J]. PLoS Pathog, 2011, 7(9): e1002277. DOI:10.1371/journal.ppat.1002277 |
| [12] | Connolly SA, Landsburg DJ, Carfi A, et al. Potential nectin-1 binding site on herpes simplex virus glycoprotein D[J]. J Virol, 2005, 79(2): 1282–1295. DOI:10.1128/JVI.79.2.1282-1295.2005 |
| [13] | Lu G, Zhang N, Qi J, et al. Crystal structure of herpes simplex virus 2 gD bound to nectin-1 reveals a conserved mode of receptor recognition[J]. J Virol, 2014, 88(23): 13678–13688. DOI:10.1128/JVI.01906-14 |
| [14] | Zago A, Spear PG. Differences in the N termini of herpes simplex virus type 1 and 2 gDs that influence functional interactions with the human entry receptor Nectin-2 and an entry receptor expressed in Chinese hamster ovary cells[J]. J Virol, 2003, 77(17): 9695–9699. DOI:10.1128/JVI.77.17.9695-9699.2003 |
| [15] | Alves Dummer L, Pereira Leivas Leite F, van Drunen Littel-van den Hurk S. Bovine herpesvirus glycoprotein D:a review of its structural characteristics and applications in vaccinology[J]. Vet Res, 2014, 45: 111. DOI:10.1186/s13567-014-0111-x |
 2017, Vol. 43
2017, Vol. 43


