扩展功能
文章信息
- 孙静, 魏虎来
- SUN Jing, WEI Hulai
- 人源肝癌HepG2细胞胰岛素抵抗和逆转模型中FoxO1mRNA和蛋白表达水平及其意义
- Insulin resistance of human hepatoma HepG2 cells and expression levels of FoxO1 mRNA and protein in reversal model and their significances
- 吉林大学学报(医学版), 2017, 43(04): 709-714
- Journal of Jilin University (Medicine Edition), 2017, 43(04): 709-714
- 10.13481/j.1671-587x.20170409
-
文章历史
- 收稿日期: 2016-11-08
2. 兰州大学基础医学院医学实验中心, 甘肃 兰州 730000
2. Center of Medical Laboratory, College of Basic Medical Sciences, Lanzhou University, Lanzhou 730000, China
胰岛素抵抗(insulin resistance,IR)是指机体、器官、组织或细胞对胰岛素的敏感性和反应性降低,糖代谢紊乱的慢性病理过程,是引发2型糖尿病的主要原因之一[1]。叉头状转录因子Os(forkhead transcription factor Os,FoxOs)是激素和营养代谢调节通路中的关键因子,参与肝脏糖异生、糖酵解和脂肪生成[2]。叉头状转录因子O1(forkhead transcription factor O1,FoxO1) 是FoxOs家族中的一员,是胰岛素通路的重要转录因子。文献[3]报道:FoxO1基因与细胞的糖脂代谢和糖异生过程关系密切,但FoxO1是否参与IR目前报道较少。本研究通过体外诱导建立人源肝癌HepG2细胞IR模型和盐酸吡格列酮(pioglitazone hydrochloride,PH)干预后的逆转模型,采用Real-time PCR法及Western blotting法检测HepG2细胞IR模型及逆转模型中FoxO1mRNA和蛋白表达水平,探讨该基因参与IR的机制。
1 材料与方法 1.1 细胞和主要试剂人源肝癌HepG2细胞购自北京北纳创联生物技术研究院,源自美国模式菌种收集中心(ADCC),由兰州大学基础医学院实验中心保存。无酚红DMEM培养基和胎牛血清(美国Gibco公司),0.25%胰酶和青链霉素双抗(美国Hyclone公司),葡萄糖检测试剂盒(南京威特曼生物科技有限公司),Trizol Plus、逆转录试剂盒及荧光定量试剂盒(大连TaKaRa公司),兔抗人FoxO1多克隆抗体(美国Immunoway公司),兔抗人GAPDH多克隆抗体和HRP标记羊抗兔多克隆抗体(北京中杉金桥有限公司),细胞蛋白裂解液和BCA蛋白定量试剂盒(北京索莱宝科技有限公司),ECL发光液(美国Millipore公司)。
1.2 HepG2细胞培养HepG2细胞复苏,用含有10%胎牛血清的DMEM培养基转入25cm2细胞培养瓶中,37℃、5%CO2的饱和湿度条件下培养,当细胞贴壁生长到90%铺满度之后,弃掉培养基,灭菌PBS洗涤,0.25%胰酶消化,每隔1d按1:3比例传代,取对数生长期细胞用于后续实验。
1.3 HepG2细胞IR模型的诱导和模型建立根据陈秋[6]建立模型的方法并改进,将处于对数生长期的人源肝癌HepG2细胞置于完全培养基中,按每孔5×103个细胞接种于96孔板,待细胞完全贴壁后更换无血清DMEM培养基洗涤并同步化24 h,更换含5%小牛血清的培养基。实验组分别加入终浓度为1×10-10、1×10-9、1×10-8、1×10-7、1×10-6和1×10-5 mol·L-1胰岛素,对照组不加胰岛素。分别诱导24、36和48 h,弃上清并用PBS洗涤去除胰岛素,用不含血清的无酚红DMEM孵育24 h,吸取上清,用葡萄糖氧化酶法测定其中的葡萄糖水平,根据培养基原始葡萄糖水平减去各组上清中的葡萄糖水平,计算各组细胞的糖消耗量,选取葡萄糖消耗量下降明显且细胞状态良好的诱导条件。胰岛素诱导建立的IR细胞命名为HepG2/IR细胞,终浓度分别为1×10-10、1×10-9、1×10-8、1×10-7、1×10-6和1×10-5 mol·L-1胰岛素诱导36 h的细胞组依次命名为HepG2/IR-5、HepG2/IR-6、HepG2/IR-7、HepG2/IR-8和HepG2/IR-9细胞组,对照组不加胰岛素。
1.4 HepG2细胞IR逆转模型的建立PH是胰岛素的增敏剂,可逆转IR。收集HepG2/IR细胞并按1×105mL-1浓度接种于96孔板,以HepG2/IR为对照组,分别用终浓度为0.156、0.312、0.625、1.250、2.500、5.000、10.000和20.000 mmol·L-1的PH完全培养基作用24 h后,采用MTT法检测对应每孔570nm处吸光度(A)值,代表细胞增殖活性。根据细胞增殖活性判断最佳PH作用浓度,IR逆转模型细胞命名为HepG2/IR-PH。
1.5 RT-PCR法检测FoxO1 mRNA表达水平收集HepG2/IR-5、HepG2/IR-6、HepG2/IR-7、HepG2/IR-8、HepG2/IR-9、HepG2/IR-PH组和对照组细胞,提取总RNA,测定RNA水平,反转录为cDNA,建立PCR扩增体系。FoxO1引物序列:forward 5′-ACAGACCAACCTGGCATTAC-3′,reverse 5′-TACGTCCTGATGGGACTTACA-3′;内参β-actin引物序列:forward 5′-TTGCTGATCCACATCTGCT-3′,reverse 5′-GACAGGATGCAGAAGGAG AT-3′。Real-time PCR反应条件:95℃、10 s,60℃、30 s,72℃、30s,共40个循环。熔解曲线温度为60℃~95℃,设置3个复孔。采用ABI7500型荧光定量PCR仪及分析软件进行PCR扩增及相对定量分析,扩增结束后采用熔解曲线分析产物的特异性。目的基因的相对表达水平F=2-ΔΔCt,ΔΔCt=对照组(Ct管家基因-Ct目的基因)-实验组(Ct管家基因-Ct目的基因)。
1.6 Western-blotting法检测FoxO1蛋白表达水平收集HepG2/IR-5、HepG2/IR-6、HepG2/IR-7、HepG2/IR-8、HepG2/IR-9、HepG2/IR-PH组和对照组细胞,裂解,提取全细胞蛋白裂解液,BCA定量测定蛋白浓度,每孔10μg蛋白上样,SDS-PAGE电泳,湿转法将蛋白转印至PVDF膜,5%脱脂奶粉封闭2 h,4℃过夜孵育一抗(兔抗人FoxO1多克隆抗体,兔抗人GAPDH多克隆抗体),TBST洗涤10 min×3次,加入二抗(HRP标记羊抗兔多克隆抗体)室温孵育1 h,TBST洗涤10 min×3次,加入ECL发光液并置于暗盒内压片,再将X光片置于定影液和显影液中显色,自来水清洗后晾干。扫描仪扫描成像,Image J软件对蛋白进行灰度分析,以GAPDH作为对照,计算各组细胞中FoxO1蛋白的表达水平,蛋白表达水平=待测蛋白灰度值/GAPDH蛋白灰度值。
1.7 统计学分析采用SPSS19统计学软件进行统计学分析。葡萄糖消耗量、细胞增殖活性、FoxO1 mRNA和蛋白表达水平均以x± s表示,多组间比较采用单因素方差分析。细胞增殖活性为非正态分布资料,经对数转换正态化后组间比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组HepG2细胞葡萄糖消耗量与对照组比较,胰岛素作用24 h,各浓度胰岛素组细胞葡萄糖消耗量均增加;培养36 h后,1×10-8、1×10-7和1×10-6 mol·L-1胰岛素组细胞的葡萄糖消耗量均较对照组减少(P < 0.05),产生了IR,其中1×10-7 mol·L-1胰岛素组比对照组减少45.84%;胰岛素作用48 h后,各浓度胰岛素组葡萄糖消耗量与对照组比较差异均无统计学意义(P>0.05)。见表 1。
| [n=4, x± s, cB/(mmol·L-1)] | ||||
| Group | Glucose consumption | |||
| (t/h) | 24 | 48 | 72 | |
| Control | 0.884±0.193 | 0.925±0.075 | 2.037±0.161 | |
| Insulin model (mol·L-1) | ||||
| 1×10-10 | 1.072±0.239 | 1.117±0.077△ | 2.229±0.187 | |
| 1×10-9 | 1.292±0.197* | 1.127±0.105△ | 2.296±0.192 | |
| 1×10-8 | 1.396±0.154* | 0.803±0.015*△ | 2.293±0.168 | |
| 1×10-7 | 1.480±0.197* | 0.501±0.055* | 1.794±0.115 | |
| 1×10-6 | 1.516±0.122* | 0.719±0.071*△ | 1.899±0.107 | |
| 1×10-5 | 1.705±0.168* | 1.224±0.089*△ | 2.271±0.221 | |
| *P < 0.05 compared with control group at same time; △P < 0.05 compared with 1×10-7 mol·L-1 insulin model group. | ||||
以1×10-7 mol·L-1胰岛素培养36 h作为逆转IR的对照组细胞,当PH浓度低于1.25 mmol·L-1时,对细胞增殖均无明显影响,故后续实验选择1.25 mmol·L-1 PH逆转HepG2/IR细胞的IR。见表 2。
| (n=4, x± s) | |
| Group | A value |
| Control | 1.328±0.029 |
| PH model (mmol·L-1) | |
| 0.156 | 1.334±0.056 |
| 0.312 | 1.327±0.072 |
| 0.625 | 1.330±0.138 |
| 1.250 | 1.341±0.067 |
| 2.500 | 1.154±0.093* |
| 5.000 | 0.874±0.077* |
| 10.000 | 0.709±0.053* |
| 20.000 | 0.345±0.098* |
| *P < 0.05 compared with control group. | |
与对照组比较,HepG2/IR-6、HepG2/IR-7和HepG2/IR-8组HepG2/IR细胞中FoxO1 mRNA表达水平明显升高(P < 0.01), 其中HepG2/IR-7组表达水平最高;PH逆转HepG2/IR细胞IR时(HepG2/IR-7-PH组),较HepG2/IR-7组FoxO1 mRNA表达水平明显降低(P < 0.01),与对照组比较差异无统计学意义(P>0.05)。见表 3。
| (n=4, x± s) | |
| Group | Expression level of FoxO1 mRNA |
| Control | 1.01±0.77 |
| HepG2/IR-5 | 1.08±0.96△ |
| HepG2/IR-6 | 29.35±2.76*△ |
| HepG2/IR-7 | 34.16±1.89* |
| HepG2/IR-8 | 19.34±2.42*△ |
| HepG2/IR-9 | 2.37±0.85△ |
| HepG2/IR-7-PH | 2.01±0.06△ |
| *P < 0.05 compared with control group; △P < 0.01 compared with HepG2/IR-7 group | |
与对照组比较,HepG2/IR-5、HepG2/IR-6、HepG2/IR-7和HepG2/IR-8组FoxO1蛋白表达水平明显增加(P < 0.01),其中HepG2/IR-7组表达水平最高,与FoxO1 mRNA表达变化相吻合。PH逆转HepG2/IR细胞IR后(HepG2/IR-7-PH组) FoxO1蛋白表达水平与HepG2/IR-7组比较明显降低(P < 0.01),与对照组比较差异无统计学意义(P>0.05)。见图 1和表 4。
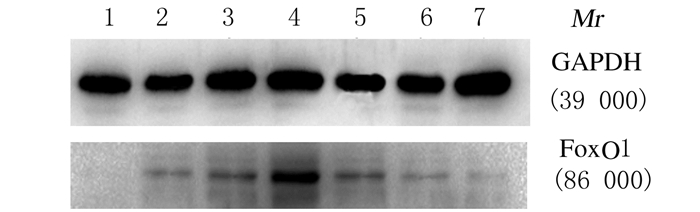
|
| Lane 1: Control group; Lane 2: HepG2/IR-5 group; Lane 3: HepG2/IR-6 group; Lane 4: HepG2/IR-7 group; Lane 5: HepG2/IR-8 group; Lane 6: HepG2/IR-9 group; Lane 7: HepG2/IR-7-PH group. 图 1 Western blotting法检测各组细胞中FoxO1蛋白表达电泳图 Figure 1 Electrophoregram of expressions of FoxO1 protein in cells in various groups detected by Western blotting method |
|
|
| (n=4, x± s) | |
| Group | Expression level of FoxO1 protein |
| Control | 0.033±0.004 |
| HepG2/IR-5 | 0.231±0.074*△ |
| HepG2/IR-6 | 0.460±0.031*△ |
| HepG2/IR-7 | 0.660±0.071* |
| HepG2/IR-8 | 0.481±0.026*△ |
| HepG2/IR-9 | 0.207±0.009*△ |
| HepG2/IR-7-PH | 0.114±0.078△ |
| *P < 0.01 compared with control group; △P < 0.01 compared with HepG2/IR-7 group. | |
1995年Stern[4]提出了著名的“共同土壤”学说,认为糖尿病、高血压和冠心病是在IR这个共同土壤中“生长”出来的,即IR是这些疾病的共同危险因素。
由于IR的研究常需要取肝脏和骨骼肌等胰岛素靶组织,使其在人体的研究不易开展,因此国外关于IR的研究多以细胞或动物模型为对象,尤其是IR细胞模型,因具有复制周期短、易多次重复、影响因素容易控制及价格低廉等优势已被较广泛应用[5]。
HepG2细胞源于人的肝胚胎瘤细胞, 是一种表型与肝细胞极为相似的肝胚胎瘤细胞株,常被选为研究对象,国内多采用高胰岛素诱导HepG2细胞建立IR细胞模型[6]。本实验采用终浓度为1×10-10、1×10-9、1×10-8、1×10-7、1×10-6和1×10-5 mol·L-1胰岛素,诱导HepG2细胞24、36和48h,用葡萄糖氧化酶法测定检测上清液中葡萄糖浓度,计算各组细胞的葡萄糖消耗量,确定IR模型建立的最佳诱导条件为1×10-7 mol·L-1胰岛素诱导36 h,表现出明显的IR。
FoxOs蛋白家族是新近发现并命名的新转录因子家族,FoxO1蛋白作为FoxOs亚家族中的一员,是细胞内能量代谢的重要调节因子,同时也是胰岛素/胰岛素样生长因子1信号通路中的关键分子[7]。FoxO1广泛表达于肝脏、脂肪和骨骼肌等糖、脂代谢器官和组织中,不同组织中FoxO1的功能有所差异。在肝脏中,FoxO1主要参与糖异生及极低密度脂蛋白的合成,在维持机体血糖水平稳定及甘油三酯代谢过程中发挥重要作用[8-9]。在高脂饮食的小鼠中,FoxO1蛋白水平增加,降低胰岛素的敏感性[10]。在肥胖小鼠中,沉默FoxO1的表达可以逆转肝脏糖异生和肝糖原的输出[11]。研究[12-14]显示:FoxO1表达升高可上调糖异生途径关键酶的表达,影响肝脏葡萄糖输出,抑制糖尿病小鼠FoxO1基因表达后其血糖水平明显下降,且肝脏组织糖异生途径关键酶的表达水平降低,表明FoxO1表达异常可能与IR有重要关系。但目前关于FoxO1与IR关系的研究尚少,抑制表达能否改善IR及其详细机制尚不明确。
PH作为噻唑烷二酮家族成员之一和过氧化物酶体增殖物激活受体γ激活剂的代表性药物,属于胰岛素增敏剂,因可以改善胰岛素敏感性及血管内皮功能,增强胰岛素与其受体结合以促进组织对葡萄糖的摄取而降低血糖,在目前的临床工作中作为2型糖尿病的治疗药物已经得到了认可[1, 15-16]。但PH能否降低FoxO1而增加胰岛素敏感性,目前研究甚少。
本研究检测人源肝癌HepG2细胞IR模型中FoxO1 mRNA及蛋白表达水平结果显示:在HepG2/IR模型细胞中FoxO1 mRNA和蛋白表达水平明显升高,采用PH进行HepG2/IR模型逆转抵抗后,与HepG2/IR细胞组比较,逆转模型细胞中FoxO1 mRNA和蛋白表达水平降低,提示FoxO1基因在细胞发生IR的过程中发挥重要作用,说明FoxO1的表达水平与细胞对胰岛素的敏感性存在着关联性。因此,FoxO1基因有可能作为IR的建模分子指标、胰岛素增敏剂的药物筛选靶标及药效评估的分子指标,同时为IR的治疗提供一定理论依据。
综上所述,本研究结果表明FoxO1表达与IR存在关联性,FoxO1 mRNA表达水平检测有可能作为胰岛素增敏剂的药效评估指标,降低FoxO1 mRNA表达水平可作为2型糖尿病治疗的新靶点,但是FoxO1基因与胰岛素敏感性具体的分子效应机制还需要进一步验证。
| [1] | 王吉耀. 内科学[M]. 北京: 人民卫生出版社,2005. |
| [2] | Zhang W, Bu SY, Mashek MT, et al. Integrated regulation of hepatic lipid and glucose metabolism by adipose triacylglycerol lipase and FoxO proteins[J]. Cell Rep, 2016, 15(2): 349–359. DOI:10.1016/j.celrep.2016.03.021 |
| [3] | Yadav H, Devalaraja S, Chung ST, et al. TGF-β1/Smad3 pathway targets PP2A-AMPK-FoxO1 signaling to regulate hepatic gluconeogenesis[J]. J Biol Chem, 2017, 292(8): 3420–3432. DOI:10.1074/jbc.M116.764910 |
| [4] | Stern MP. Diabetes and cardiovascular disease. The "common soil"hypothesis[J]. Diabetes, 1995, 44(4): 369–374. DOI:10.2337/diab.44.4.369 |
| [5] | 杨桂枝. 胰岛素抵抗细胞模型的研究以及在筛选胰岛素增敏剂药物中的应用[D]. 成都: 四川大学, 2005. http://cdmd.cnki.com.cn/Article/CDMD-10610-2004030833.htm |
| [6] | 陈秋. 蜕皮甾酮的胰岛素增敏作用及其机制的实验研究[D]. 重庆: 重庆医科大学, 2005. http://d.wanfangdata.com.cn/Thesis/Y732384 |
| [7] | Kim SP, Ellmerer M, Van Citters GW, et al. Primacy of hepatic insulin resistance in the development of the metabolic syndrome induced by an isocaloric moderate-fat diet in the dog[J]. Diabetes, 2003, 52(10): 2453–2460. DOI:10.2337/diabetes.52.10.2453 |
| [8] | Cheng Z. FoxO1:mute for a tuned metabolism[J]. Trends Endocrinol Metab, 2015, 26(8): 402–403. DOI:10.1016/j.tem.2015.06.006 |
| [9] | Cook JR, Matsumoto M, Banks AS, et al. A mutant allele encoding DNA binding-deficient foxO1 differentially regulates hepatic glucose and lipid metabolism[J]. Diabetes, 2015, 64(6): 1951–1965. DOI:10.2337/db14-1506 |
| [10] | Nwadozi E, Roudier E, Rullman E, et al. Endothelial FoxO proteins impair insulin sensitivity and restrain muscle angiogenesis in response to a high-fat diet[J]. FASEB J, 2016, 30(9): 3039–3052. DOI:10.1096/fj.201600245R |
| [11] | Yan C, Chen J, Li M, et al. A decrease in hepatic microRNA-9 expression impairs gluconeogenesis by targeting FOXO1 in obese mice[J]. Diabetologia, 2016, 59(7): 1524–1532. DOI:10.1007/s00125-016-3932-5 |
| [12] | Tichenell PM, Chu Q, Monks BR, et al. Hepatic insulin signaling is dispensable for suppression of glucose output by insulin in vivo[J]. Nat Commun, 2015, 6: 7078. DOI:10.1038/ncomms8078 |
| [13] | O-Sullivan I, Zhang W, Wasserman DH, et al. FoxO1 integrates direct and indirect effects of insulin on hepatic glucose production and glucose utilization[J]. Nat Commun, 2015, 6: 7079. DOI:10.1038/ncomms8079 |
| [14] | 张正良, 车向明, 白郑海, 等. FOXA1和YAP在胃癌中的表达及临床意义[J]. 西安交通大学学报:医学版, 2015, 30(5): 667–671. |
| [15] | Spigoni V, Picconi A, Cito M, et al. Pioglitazone improves in vitro viability and function of endothelial progenitor cells from individuals with impaired glucose tolerance[J]. PLoS One, 2012, 7(11): e48283. DOI:10.1371/journal.pone.0048283 |
| [16] | 金晶. 吡格列酮对胰岛素抵抗血管内皮细胞保护机制的研究[D]. 长春: 吉林大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10183-1015588015.htm |
 2017, Vol. 43
2017, Vol. 43


