扩展功能
文章信息
- 历春, 付天悦, 杨宝学, 盖晓东
- LI Chun, FU Tianyue, YANG Baoxue, GAI Xiaodong
- 尿素通道蛋白B在人膀胱癌组织中的表达及其临床意义
- Expression of urea transporter B in human bladder cancer tissue and its clinical significance
- 吉林大学学报(医学版), 2017, 43(04): 705-708
- Journal of Jilin University (Medicine Edition), 2017, 43(04): 705-708
- 10.13481/j.1671-587x.20170408
-
文章历史
- 收稿日期: 2016-07-10
2. 北京大学基础医学院药理学系, 北京 100871
2. Department of Pharmacology, School of Basic Medical Sciences, Peking University, Beijing 100871, China
膀胱癌是泌尿系统中最常见的恶性肿瘤,全球每年40万新发膀胱癌患者中约有15万人死于膀胱癌[1-2]。膀胱癌在早期一般无异常症状,一旦出现血尿、尿痛或排尿困难等临床症状,表示病程已进入晚期。传统的临床病理参数如肿瘤的病理分级和临床分期对膀胱癌患者的诊断和预后的评估作用有限,因此找到早期诊断、准确评估复发和预后的有效肿瘤分子标记物是目前研究的热点。
尿素通道蛋白(urea transporter, UT)是特异性通透尿素的膜通道蛋白分子,包括UT-A家族和UT-B家族。UT-B蛋白分布广泛,主要分布在红细胞膜和肾直小血管降支;在脑、脾脏、输尿管和膀胱等多个器官组织中也有表达[3-5],其中在膀胱组织中的表达水平远高于其他组织[6]。UT-B不仅可以特异性通透尿素,还可以转运多种尿素类似物,如甲酰胺、乙酰胺、甲基脲、氨基甲酸铵和丙烯酰胺等[7]。近期研究[8]显示:UT-B基因敲除可能引起小鼠膀胱移行上皮细胞DNA损伤和凋亡,但是否与膀胱癌有关联目前尚未见报道。本研究通过检测UT-B在膀胱癌组织中的表达及其与临床病理参数的关联,探讨UT-B蛋白在膀胱癌发生发展中的作用及其临床意义,为膀胱癌的早期发现、诊断和预后判断提供参考指标。
1 资料与方法 1.1 标本来源收集2011—2012年吉林省吉林市吉化总院和吉林市人民医院病理科膀胱癌术后石蜡标本52例,年龄46~84岁,平均年龄(62.20±7.30) 岁,其中男性41例,女性11例。所有患者术前均未行放、化疗,术后均有明确病理学诊断,有详细临床资料。根据1973年世界卫生组织(WHO)膀胱癌组织学分级,全部病例分为G1、G2和G3级;根据1997年国际抗癌联盟(UICC)提出的膀胱癌TNM分期标准全部病例分为非肌层浸润期(Ta+T1) 和肌层浸润期(T2+T3)。另收集15例正常膀胱黏膜组织标本作为对照组。
1.2 实验试剂鼠抗人UT-B多克隆抗体由北京大学杨宝学教授馈赠,通用型免疫组织化学超敏SP试剂盒和DAB均购自福州迈新生物技术公司。
1.3 免疫组织化学染色和结果判定将存档的膀胱癌术后石蜡标本重新制备5 μm切片,行免疫组织化学SP染色,参照试剂盒说明书操作,以PBS替代一抗作为阴性对照,用已知膀胱癌阳性切片作为阳性对照。采用双盲法观测,以细胞浆或细胞膜显示棕黄色颗粒为UT-B阳性染色。每张切片选取5个高倍视野(×400),每个视野下计数100个肿瘤细胞,以染色强度和阳性面积百分率相结合判读免疫组织化学染色结果。染色强度:无着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;阳性面积百分比:0%为0分,1%~10%为1分,11%~50%为2分,51%~80%为3分,>80%为4分。染色强度与阳性面积百分数的乘积为最后得分:0~2分为阴性(-),3~4分为弱阳性(+),6~8分为中阳性(++),9~12分为强阳性(+++)[9]。
1.4 统计学分析采用SPSS 13.0统计软件进行统计学分析。肿瘤组织和正常膀胱黏膜组织中UT-B蛋白阳性表达率比较及不同临床病理参数患者膀胱癌组织中UT-B蛋白阳性表达率比较采用χ2检验,不同分级膀胱癌患者间UT-B蛋白阳性表达率比较采用Bonferroni分析。以P<0.05为差异有统计学意义。
2 结果 2.1 膀胱癌组织和正常膀胱黏膜组织中UT-B蛋白表达采用免疫组织化学方法检测52例膀胱癌患者术后肿瘤标本和15例正常膀胱黏膜组织中UT-B蛋白的阳性表达率。UT-B蛋白在15例正常膀胱黏膜组织中高表达(图 1A,见插页三),阳性表达14例,阳性表达率为93.3%。UT-B蛋白在膀胱癌组织中多数为阴性表达,少数阳性表达,阳性表达中多数为弥散性分布,细胞定位有细胞质和细胞膜2种形式,染色强弱不等(图 1B~F,见插页三);52例膀胱癌组织中UT-B蛋白阳性表达23例,阳性表达率为44.2%,与正常膀胱黏膜组织比较差异有统计学意义(P=0.001)。见表 1。
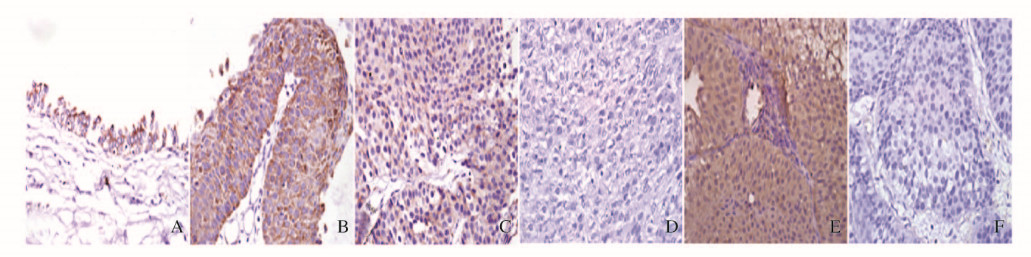
|
| A: Normal bladder urothelium tissue; B-D: Bladder cancer tissues at G1, G2 and G3 phases; E: Bladder cancer tissue at non-muscle-invasive stage; F:Bladder cancer tissue at muscle-invasive stage. 图 1 UT-B蛋白在正常膀胱黏膜组织和膀胱癌组织中的表达(免疫组织化学,×400) Figure 1 Expresions of UT-B in normal urothelium tissue and bladder cancer tissue (Immunohistochemistry, ×400) |
|
|
| Group | n | UT-B expression | P | ||
| - | +-+++ | Positive rate(η/%) | |||
| Normal urothelium Bladder cancer | 15 52 | 1 29 | 14 23 | 93.3 44.2 | 0.001 |
膀胱癌组织中UT-B蛋白的阳性表达率随肿瘤组织分级的增高而逐渐降低,不同分级间比较差异有统计学意义(P=0.010);UT-B蛋白的染色强度也随肿瘤组织分级的增高而逐渐减弱(图 1B~D,见插页三)。进一步采用Bonferroni分析,G3组UT-B蛋白阳性表达率明显低于G1组,差异有统计学意义(P=0.006),而G1和G2组间UT-B蛋白阳性表达率比较差异无统计学意义(P=0.178)。肿瘤组织分化越差,UT-B蛋白表达率越低,其恶性程度越高。此外,膀胱癌组织中UT-B蛋白在非肌层浸润期(Ta+T1) 的阳性表达率明显高于肌层浸润期(T2+T3),组间比较差异有统计学意义(P=0.014);UT-B蛋白的染色强度随肿瘤组织浸润程度的加深逐渐降低(图 1E~F,见插页三)。不同年龄、性别和肿瘤大小患者之间UT-B蛋白阳性表达率比较差异无统计学意义(P>0.05)。见表 2。
| [n(η/%)] | |||
| Clinicopathological parameter | n | Positive expression rate of UT-B | P |
| Age (year) | |||
| ≥62 < 62 | 25 27 | 48.0(12/25) 40.7(11/27) | 0.598 |
| Gender | |||
| Male Female | 41 11 | 46.3(19/41) 36.4(4/11) | 0.803 |
| Tumor size (d/cm) | |||
| ≥2.5 < 2.5 | 26 26 | 42.3(11/26) 46.2(12/26) | 0.780 |
| Grade | |||
| G1 | 25 | 64.0(16/25) | |
| G2 | 13 | 38.5(5/13) | 0.010 |
| G3 | 14 | 14.3(2/14) | |
| Stage classification | |||
| Ta+T1 T2+T3 | 36 16 | 55.6(20/36) 18.8(3/16) | 0.014 |
75%以上膀胱癌为非浸润性膀胱癌,尽管患者接受了手术治疗,仍有50%的复发率,其中5%~25%的病例会发展为肌层浸润性膀胱癌[10]。因此,如何预防膀胱癌和对其早期诊治是目前急需解决的难题。
研究[11]显示:膀胱癌具有遗传倾向,有膀胱癌家族史的个体患膀胱癌的风险是正常人群的2倍。一些与膀胱癌发生相关的遗传位点已经陆续被发现。2011年由美国和英国等国家的24个研究组在人类分子遗传学杂志联合发表的2篇论文[12-13]报道:膀胱癌的发生与UT-B基因(SLC14A1) 变异明显相关,其主要突变点是UT-B蛋白第280位的天冬氨酸变为天冬酰胺。近期研究[8]显示:UT-B基因敲除小鼠还可引起膀胱移行上皮细胞ZNF、MCM、NPR等基因表达的上调和Uchl1、Bnip3和Smad3等基因表达的下调,提示UT-B缺失可引起膀胱移行上皮细胞的DNA损伤和凋亡。根据尿路移行上皮细胞膜高水平表达UT-B的特性,推测UT-B功能缺失可能诱发移行上皮细胞恶变进而发生膀胱癌。
本课题组收集52例膀胱癌患者术后肿瘤组织和15例正常膀胱黏膜组织,采用免疫组织化学方法检测UT-B蛋白的表达,结果显示:UT-B蛋白在正常膀胱黏膜组织中高表达,阳性表达率为93.3%,与其他研究[14]报道相同。UT-B蛋白在膀胱癌细胞定位有细胞质和细胞膜2种形式,52例膀胱癌组织中UT-B蛋白阳性表达率为44.2%,与正常黏膜组比较差异有统计学意义,提示UT-B蛋白在膀胱癌组织中的表达下调或缺失可能与膀胱癌的发生发展有密切关联。此外,本文作者[5]在膀胱癌间质血管中的红细胞膜上也检测到UT-B蛋白的强阳性表达,与有关研究[15-17]报道UT-B蛋白在红细胞膜高表达的结果相符。
为进一步确定UT-B蛋白在膀胱癌组织中低表达的可能作用,将UT-B蛋白的表达与肿瘤组织分级和肿瘤浸润程度等临床病理参数进行统计学分析显示:膀胱癌组织中UT-B蛋白的阳性表达率和染色强度随肿瘤组织分级的增高而逐渐降低,膀胱癌组织级别越高肿瘤细胞分化越差,其恶性程度越高。本研究结果提示:肿瘤组织分化越差,UT-B蛋白表达越低。膀胱癌组织中UT-B蛋白的表达与肿瘤浸润程度有密切关联,UT-B蛋白的阳性表达率随肿瘤组织浸润程度的加深也逐渐降低。肿瘤的病理分级和临床分期是临床评估膀胱癌患者预后的重要指标,因此膀胱癌组织中UT-B蛋白的表达情况可反映肿瘤的恶性进展程度,高表达UT-B蛋白的膀胱癌患者其肿瘤的恶性程度较低,而低表达或不表达UT-B蛋白的膀胱癌患者其肿瘤浸润和恶性发展的概率可能更高,预后更差。
研究[6]显示:UT-B介导的细胞膜尿素通透性是脂质双层膜尿素通透性的50倍,可迅速平衡细胞内外的尿素浓度差和渗透压差,该功能可使表达UT-B的红细胞在通过肾直小血管从肾皮质至肾髓质的过程中,迅速平衡细胞内外渗透压差,保护红细胞不会频繁激烈皱缩和膨胀,以免引起红细胞破裂。根据尿路移行上皮细胞膜高水平表达UT-B的特性推测:由于尿素通道功能的缺失,细胞内外尿素不能在浓度差的作用下快速转运出入细胞,从而引起移行上皮细胞体积反复地迅速增大或皱缩,引起细胞损伤。频繁细胞损伤可引起细胞不断地修复和增殖,发生DNA错误修复,进而产生移行上皮细胞恶变,发生膀胱癌。
综上所述,UT-B蛋白在膀胱癌组织中表达降低或缺失可能促进了膀胱癌的发生发展,膀胱癌组织中低表达或不表达UT-B蛋白的膀胱癌患者其肿瘤浸润和恶性发展的概率可能更高。因此,检测UT-B蛋白表达对膀胱癌患者的诊断和预后评估有较高的临床参考价值。本研究结果为膀胱癌发病机制的研究提供了新的见解,为膀胱癌靶向性治疗提供了新的靶点。
| [1] | Ploeg M, Aben KK, Kiemeney LA. The present and future burden of urinary bladder cancer in the world[J]. World J Urol, 2009, 27(3): 289–293. DOI:10.1007/s00345-009-0383-3 |
| [2] | Ferlay J, Shin HR, Bray F, et al. Estimates of worldwide burden of cancer in 2008:GLOBOCAN 2008[J]. Int J Cancer, 2010, 127(12): 2893–2917. DOI:10.1002/ijc.v127:12 |
| [3] | Klein JD, Sands JM. Urea transport and clinical potential of urearetics[J]. Curr Opin Nephrol Hypertens, 2016, 25(5): 444–451. DOI:10.1097/MNH.0000000000000252 |
| [4] | Fenton RA, Knepper MA. Urea and renal function in the 21st century:insights from knockout mice[J]. J Am Soc Nephrol, 2007, 18(3): 679–688. DOI:10.1681/ASN.2006101108 |
| [5] | 姜涛, 杨宝学. 尿素通道蛋白的组织分布和生理功能[J]. 神经药理学报, 2015, 5(5): 40–48. |
| [6] | Yang B, Bankir L, Gillespie A, et al. Urea-selective concentrating defect in transgenic mice lacking urea transporter UT-B[J]. J Biol Chem, 2002, 277(12): 10633–10637. DOI:10.1074/jbc.M200207200 |
| [7] | Dong Z, Ran J, Zhou H, et al. Urea transporter UT-B deletion induces DNA damage and apoptosis in mouse bladder urothelium[J]. PLoS One, 2013, 8(10): e76952. DOI:10.1371/journal.pone.0076952 |
| [8] | Yang B. Transport characteristics of urea transporter-B[J]. Subcell Biochem, 2014, 73: 127–135. DOI:10.1007/978-94-017-9343-8 |
| [9] | Kawahara T, Inoue S, Fujita K, et al. NFATc1 Expression as a prognosticator in urothelial carcinoma of the upper urinary tract[J]. Transl Oncol, 2017, 10(3): 318–323. DOI:10.1016/j.tranon.2017.01.012 |
| [10] | Kamat AM, Bagcioglu M, Huri E. What is new in non-muscle-invasive bladder cancer in 2016[J]. Turk J Urol, 2017, 43(1): 9–13. DOI:10.5152/tud. |
| [11] | Aben KK, Witjes JA, Schoenberg MP, et al. Familial aggregation of urothelial cell carcinoma[J]. Int J Cancer, 2002, 98(2): 274–278. DOI:10.1002/(ISSN)1097-0215 |
| [12] | Rafnar T, Vermeulen SH, Sulem P, et al. European genome-wide association study identifies SLC14A1 as a new urinary bladder cancer susceptibility gene[J]. Hum Mol Genet, 2011, 20(21): 4268–4281. DOI:10.1093/hmg/ddr303 |
| [13] | Garcia-Closas M, Ye Y, Rothman N, et al. A genome-wide association study of bladder cancer identifies a new susceptibility locus within SLC14A1, a urea transporter gene on chromosome 18q12.3[J]. Hum Mol Genet, 2011, 20(21): 4282–4289. DOI:10.1093/hmg/ddr342 |
| [14] | Spector DA, Yang Q, Wade JB. High urea and creatinine concentrations and urea transporter B in mammalian urinary tract tissues[J]. Am J Physiol Renal Physiol, 2007, 292(1): F467–F474. |
| [15] | Timmer RT, Klein JD, Bagnasco SM, et al. Localization of the urea transporter UT-B protein in human and rat erythrocytes and tissues[J]. Am J Physiol Cell Physiol, 2001, 281(4): C1318–C1325. |
| [16] | Spector DA, Yang Q, Liu J, et al. Expression, localization, and regulation of urea transporter B in rat urothelia[J]. Am J Physiol Renal Physiol, 2004, 287(1): F102–F108. DOI:10.1152/ajprenal.00442.2003 |
| [17] | Spector DA, Yang Q, Wade JB. High urea and creatinine concentrations and urea transporter B in mammalian urinary tract tissues[J]. Am J Physiol Renal Physiol, 2007, 292(1): F467–F474. |
 2017, Vol. 43
2017, Vol. 43


