扩展功能
文章信息
- 王婷婷, 郜玉钢, 臧埔, 赵岩, 何忠梅, 祝洪艳, 张连学
- WANG Tingting, GAO Yugang, ZANG Pu, ZHAO Yan, HE Zhongmei, ZHU Hongyan, ZHANG Lianxue
- 复方麦鹿芪人参制剂主要成分变化及其在肝癌H22荷瘤小鼠体内的抗肿瘤作用
- Changes of main components of compound Mailuqishen and its anti-tumor effect in H22 tumor-bearing mice
- 吉林大学学报(医学版), 2017, 43(04): 698-704
- Journal of Jilin University (Medicine Edition), 2017, 43(04): 698-704
- 10.13481/j.1671-587x.20170407
-
文章历史
- 收稿日期: 2016-12-15
2. 解放军第208医院康复科, 吉林 长春 130062;
3. 吉林省人参工程技术研究中心, 吉林 长春 130118
2. Department of Rehabilitation, No. 208 Hospital of PLA, Changchun 130062, China;
3. Center of Ginseng Engineering Technology Research, Jilin Province, Changchun 130118, China
恶性肿瘤的防治仍是目前世界性难题。肝癌是发病率较高的恶性肿瘤之一,其特点为发病隐匿、发现晚、预后差,使其病死率居高不下,并呈逐年上升趋势。气阴两虚是恶性肿瘤较普遍的病理变化过程,益气养阴滋养气阴,扶助正气,是中医治疗恶性肿瘤的基本法则[1]。本研究在中医益气养阴理论的指导下,对人参、黄芪、鹿角脱盘和麦冬进行组方,方中以人参和鹿角脱盘补气行气、补虚生精,麦冬滋阴养血,黄芪补气升阳、益气固表,四药合用补气养阴,理气、行气,正虚损,抗邪实。人参、黄芪、鹿角脱盘和麦冬4味中药均具有抗肿瘤作用,其皂苷、多糖和氨基酸是主要活性成分。文献[2-4]报道:皂苷、多糖具有抗肿瘤作用,且合理的氨基酸组成在发挥抑制肿瘤生长作用的同时,还能够改善肿瘤患者的自身营养水平,提高肿瘤患者生存质量。本研究首先采用化学分析方法,比较了人参、黄芪、鹿角脱盘和麦冬4味中药配伍后,复方制剂与单味药之间主要活性成分皂苷、多糖和氨基酸含量的变化。在此基础上,采用动物体内实验探讨复方制剂与单味药抗肿瘤作用的差异,为抗肿瘤中药复方进一步开发和利用提供参考数据。
1 材料与方法 1.1 实验动物、细胞、主要试剂和仪器雌性昆明种小鼠,体质量(20.0±2.0) g,购于吉林大学实验动物中心,动物合格证号:SCKX(吉)2011-0006。肝癌H22细胞由吉林省肿瘤医院提供。人参、黄芪、鹿角脱盘和麦冬购自长春净月经济开发区立新参茸土特产品经销部,经吉林农业大学郜玉钢教授鉴定均为正品。人参皂苷对照品:Rg1、Re、Rf、Rb1、Rg2、Rc、20(R)-Rh1、Rb2、Rb3、F1、Rd、Rk3、F2、Rh4、Rg3、原人参三醇、Compound K、Rg5、Rh2和原人参二醇(购自吉林大学天然药物化学实验室,批号分别为201511、201523、201537、201501、201545、201536、201515、201551、201518、201549、201579、201562、201521、201571、201506、201513、201520、201524、201543和201519),21种氨基酸标准品(上海源叶生物科技有限公司),5-氟尿嘧啶(天津金耀药业有限公司,批号:1506231),异硫氰酸苯酯(美国Sigma公司),4%多聚甲醛(北京索来宝科技有限公司),食品级卡拉胶和果糖(河南千志商贸有限公司)。LC-2010A高效液相色谱仪和AUY220电子分析天平(日本岛津有限公司),IMARK连续波长多功能酶标仪(美国伯乐有限公司),Guava easy Cyte微毛细管式流式细胞仪(美国默克密理博有限公司)。
1.2 复方麦鹿芪人参制剂的制备以人参、黄芪、鹿角脱盘和麦冬原药材按1:3:2:2配伍加工,将黄芪与麦冬以1:31料液比加入蒸馏水,浸泡过夜,100℃加热煎煮160 min,四层纱布滤过,收集水提液,向水提液中加入人参与鹿角脱盘混合超微粉、适量卡拉胶和果糖,煎煮,烘干,制成复方麦鹿芪人参样品,待测。人参羹制备方法同上。
1.3 复方麦鹿芪人参制剂中人参皂苷含量的测定精密称取人参原粉1 g,1.2中待测样品4 g(含人参原粉0.2 g,鹿角脱盘原粉0.4 g),参照文献[5]采用HPLC法测定复方鹿芪人参制剂中人参皂苷含量。
1.4 复方麦鹿芪人参制剂中多糖含量的测定精密称取人参原粉0.2 g、鹿角脱盘原粉0.4 g,1.2中待测样品4 g(含人参原粉0.2 g,鹿角脱盘原粉0.4 g),参照文献[6]采用苯酚硫酸法测定复方麦鹿芪人参制剂中多糖含量。
1.5 复方麦鹿芪人参制剂中氨基酸含量的测定精密称取人参原粉0.1 g,鹿角脱盘原粉0.1 g,1.2中待测样品0.2 g,参照文献[7]采用HPLC法测定复方麦鹿芪人参制剂中氨基酸的含量。
1.6 实验动物分组、给药和动物模型制备建立肝癌H22荷瘤小鼠模型:将H22肝癌细胞消化、离心,用生理盐水重悬,0.2%台盼兰染色,计算活细胞率,当活细胞率达到95%以上时,调整细胞密度至1×107mL-1,接种于小鼠腹腔内,共接种6只小鼠,每只0.2 mL,接种7~10 d,将小鼠脱颈处死,无菌条件下吸取腹腔细胞液,合并混匀,生理盐水调整细胞密度至1×107mL-1 [8]。将144只小鼠随机分为9组:正常对照组,模型组,阳性药组,低、中、高剂量复方麦鹿芪人参组,人参羹组,人参原粉组,鹿角脱盘原粉组,每组16只。按上述细胞密度,于小鼠左后肢皮下注射0.1 mL。除正常对照组外,其余各组小鼠均接种,次日开始用药。
1.7 给药处理根据人的临床用量确定小鼠的给药量,正常对照组小鼠正常进食饮水,模型组小鼠每日灌胃生理盐水(0.4 mL/20 g),低、中、高剂量复方麦鹿芪人参组(按照人参给药量进行计算,分别为195、390和780 mg·kg-1),人参羹组(390 mg·kg-1),人参原粉组(390 mg·kg-1),鹿角脱盘原粉组(780 mg·kg-1),均采用灌胃给药,阳性药组小鼠每隔1 d腹腔注射5-氟尿嘧啶(0.02 g·kg-1)。连续给药10d。
1.8 H22荷瘤小鼠肿瘤抑制率和脏器指数测定末次给药的次日,小鼠脱颈处死,剥离肿瘤、脾脏和胸腺组织,精确称质量并记录,按以下公式计算肿瘤抑制率、脾脏指数和胸腺指数[9]:肿瘤抑制率=(1-给药组平均瘤重/模型组平均瘤重)×100%,脾脏(胸腺)指数(mg·g-1)=脾脏(胸腺)质量/体质量。
1.9 H22荷瘤小鼠肿瘤和脾脏组织形态表现小鼠脱颈处死后,剥离肿瘤,取出脾脏,4%多聚甲醛固定,石蜡包埋,制片,HE染色,观察肿瘤和脾脏组织形态表现[10]。
1.10 H22荷瘤小鼠肿瘤细胞凋亡率检测剥离肿瘤组织,置于预冷的PBS溶液中,剪碎,胰酶消化,室温孵育,待细胞消化完全后,终止消化。细胞滤器过滤,收集肝癌细胞悬液,转移至离心管中,离心,弃上清,PBS洗涤2次,1×Annexin Ⅴ Binding Buffer重悬细胞,调整细胞浓度为1×106 mL-1,按试剂盒说明书检测并计算肿瘤细胞凋亡率。
1.11 统计学分析采用SPSS 19.0统计软件进行统计学分析。皂苷、多糖、氨基酸含量和各组小鼠肿瘤抑制率、脾脏指数、胸腺指数、肿瘤细胞凋亡率均以x± s表示,多组间样本均数比较采用单因素方差分析。以P<0.05表示差异有统计学意义。
2 结果 2.1 复方麦鹿芪人参制剂中人参皂苷含量复方麦鹿芪人参制剂中检测到了15种人参皂苷,按人参原粉生药量计,与人参原粉比较,除6种人参皂苷Rg1、Re、Rb1、Rb2、Rc和Rd的含量有所减少外,其他9种单体皂苷尤其是4种稀有皂苷Rh4、Rg3、Rg5和CK含量及15种人参皂苷含量加和值均明显增加(P<0.05)。在复方麦鹿芪人参制剂中还检测到了4种单体皂苷:Rh1、Rg3、Rg5及原人参二醇。见表 1和图 1。
| (n=3, x± s, η/%) | ||
| Ginsengside | MLQS | Ginseng |
| Rg1 | 0.23±0.00* | 0.25±0.01 |
| Re | 0.19±0.00* | 0.22±0.02 |
| Rf | 0.14±0.01* | 0.07±0.00 |
| Rb1 | 0.37±0.01* | 0.40±0.00 |
| Rg2 | 0.21±0.01* | 0.06±0.00 |
| Rc | 0.14±0.01* | 0.15±0.00 |
| 20R-Rh1 | 0.09±0.00* | 0.00±0.00 |
| Rb2 | 0.12±0.01* | 0.13±0.00 |
| Rb3 | 0.04±0.00* | 0.02±0.00 |
| F1 | 0.00±0.00 | 0.00±0.00 |
| Rd | 0.06±0.00* | 0.07±0.00 |
| Rk3 | 0.00±0.00 | 0.00±0.00 |
| F2 | 0.00±0.00 | 0.00±0.00 |
| Rh4 | 0.14±0.00* | 0.01±0.00 |
| Rg3 | 0.08±0.00* | 0.00±0.00 |
| Protopanaxatriol | 0.00±0.00 | 0.00±0.00 |
| CK | 0.10±0.00* | 0.02±0.00 |
| Rg5 | 0.09±0.00* | 0.00±0.00 |
| Rh2 | 0.00±0.00 | 0.00±0.00 |
| Protopanoxadiol | 0.07±0.00* | 0.00±0.00 |
| Ginsengsides values | 2.07±0.07* | 1.41±0.03 |
| *P < 0.05 compared with ginseng group. | ||
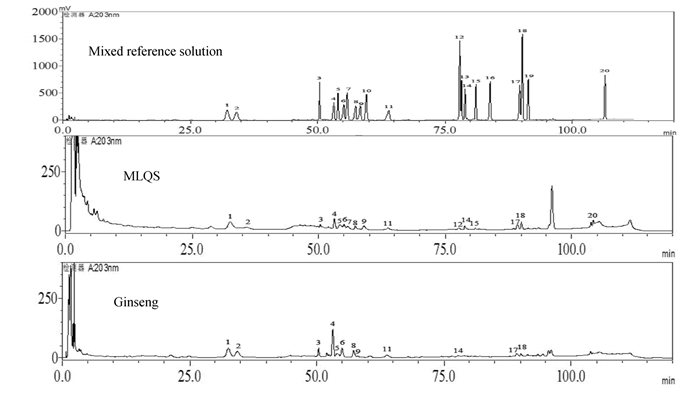
|
| 图 1 混标、复方麦鹿芪人参制剂和人参原粉皂苷液相色谱图 Figure 1 Chromatograms of mixed reference solution, compound MLQS and ginseng |
|
|
采用苯酚-硫酸法建立葡萄糖标准曲线,其线性回归方程为y=0.003 5x+0.099 0(R2 = 0.998 6)。复方麦鹿芪人参制剂、人参原粉和鹿角脱盘原粉中多糖含量分别为6.62%、2.07%和1.69%,与其他各组比较,复方麦鹿芪人参制剂中多糖含量差异有统计学意义(P<0.05)。
2.3 复方麦鹿芪人参制剂中氨基酸含量复方麦鹿芪人参制剂、人参原粉与鹿角脱盘原粉中均检测出16种氨基酸。分别按人参生药量和鹿角脱盘生药量计,复方麦鹿芪人参制剂中必需氨基酸、药用氨基酸及总氨基酸的含量均高于单味药(P<0.05)。见表 2和图 2。
| (n=3, x± s, η/%) | ||||
| Amino Acid | MLQS(Ginseng) | Ginseng | MLQS(Antler plate) | Antler plate |
| Asp | 5.94±0.14* | 0.86±0.07 | 2.97±0.07△ | 0.80±0.03 |
| Glu | 5.96±0.65* | 1.10±0.10 | 2.98±0.33△ | 2.44±0.26 |
| Asn | 0.00±0.00 | 0.00±0.00 | 0.00±0.00 | 0.00±0.00 |
| Ser | 3.16±0.20* | 0.37±0.04 | 1.58±0.10△ | 1.06±0.03 |
| Gln | 0.00±0.00 | 0.00±0.00 | 0.00±0.00 | 0.00±0.00 |
| Gly | 13.38±1.82* | 0.47±0.05 | 6.69±0.91 | 7.61±0.83 |
| His | 0.21±0.00* | 0.34±0.03 | 0.10±0.00△ | 0.27±0.01 |
| Arg | 6.07±0.32* | 3.58±0.27 | 3.04±0.16 | 3.05±0.36 |
| Thr | 2.75±0.14* | 0.77±0.05 | 1.37±0.07△ | 0.89±0.05 |
| Ala | 6.51±0.23* | 0.63±0.03 | 3.25±0.12 | 3.02±0.21 |
| Pro | 9.20±0.33* | 1.30±0.13 | 4.60±0.17 | 4.94±0.31 |
| Tyr | 1.71±0.08* | 0.59±0.06 | 0.85±0.04△ | 0.54±0.04 |
| Val | 2.36±0.18* | 0.43±0.02 | 1.18±0.09△ | 1.00±0.03 |
| Met | 1.10±0.05* | 0.20±0.02 | 0.55±0.02△ | 0.46±0.04 |
| Cys | 0.00±0.00 | 0.00±0.00 | 0.00±0.00 | 0.00±0.00 |
| Ile | 2.01±0.12* | 0.39±0.02 | 1.01±0.06△ | 0.61±0.02 |
| Leu | 3.61±0.38* | 0.64±0.06 | 1.81±0.19△ | 1.35±0.05 |
| Phe | 2.88±0.26* | 0.48±0.03 | 1.44±0.13△ | 1.04±0.04 |
| Trp | 0.00±0.00 | 0.00±0.00 | 0.00±0.00 | 0.00±0.00 |
| Lys | 4.96±0.11* | 0.70±0.01 | 2.48±0.06△ | 1.51±0.09 |
| Essential Amino Acid(E) | 19.66±1.23* | 3.61±0.21 | 9.83±0.61△ | 6.86±0.34 |
| Medicinal Amino Acid(M) | 44.01±3.54* | 8.36±0.64 | 22.01±1.77△ | 18.08±1.65 |
| Total Amino Acid(T) | 73.85±5.06* | 12.87±0.97 | 36.93±2.53△ | 30.61±2.33 |
| E/T | 26.63±0.50* | 28.08±0.54 | 26.63±0.17△ | 22.43±0.63 |
| M/T | 59.56±0.74* | 64.97±0.12 | 59.56±0.74 | 59.03±0.94 |
| *P < 0.05 compared with ginseng; △P < 0.05 compared with antler plate. | ||||
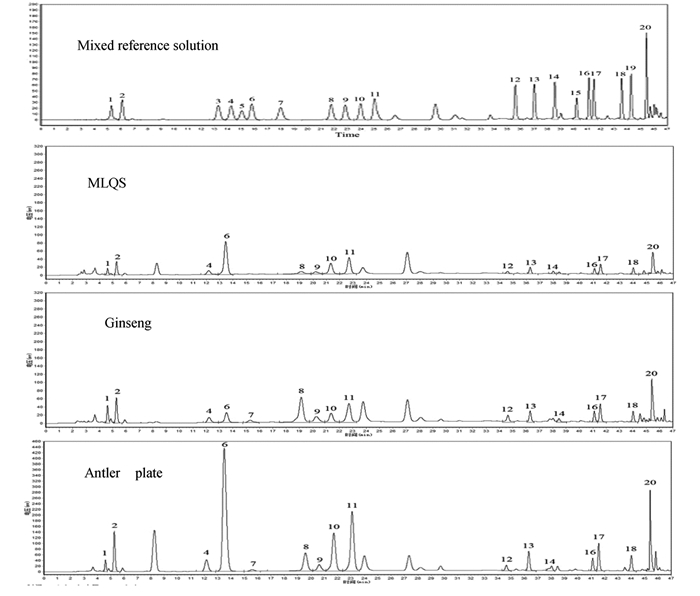
|
| 图 2 混标、复方麦鹿芪人参制剂、人参原粉和鹿角脱盘原粉氨基酸色谱图 Figure 2 Chromatograms of amino acids in mixed reference solution, MLQS, ginseng and antler plate |
|
|
高剂量复方麦鹿芪人参组小鼠肿瘤抑制率最高,为58.64%。与正常对照组比较,模型组小鼠脾脏指数明显升高(P < 0.01),但胸腺指数差异无统计意义(P>0.05);与模型组比较,各剂量复方麦鹿芪人参组小鼠瘤质量明显降低(P < 0.01),高剂量复方麦鹿芪人参组小鼠脾脏和胸腺指数明显升高(P < 0.01),阳性药组小鼠脾脏和胸腺指数明显降低(P < 0.01)。见表 3。
| (n=5) | ||||
| Group | Tumor weight (m/g) | Inhibitory rateof tmor (η/%) | Spleen index [wB/(mg·g-1)] | Thymus index [wB/(mg·g-1)] |
| Normal control | — | — | 3.13±0.21 | 2.06±0.16 |
| Model | 1.58±0.09 | — | 3.89±0.25* | 1.88±0.10 |
| Positive control | 0.63±0.09△△ | 60.33 | 2.53±0.20△△ | 1.60±0.29△△ |
| MLQS | ||||
| Low dose | 1.19±0.06△△ | 24.71 | 4.62±0.21△△ | 1.97±0.12 |
| Medium dose | 1.00±0.05△△ | 36.97 | 5.26±0.21△△ | 2.08±0.11△ |
| High dose | 0.66±0.07△△ | 58.64 | 6.12±0.18△△ | 2.65±0.08△△ |
| Ginseng geng | 0.99±0.07△△ | 37.59 | 4.19±0.23 | 2.05±0.12 |
| Ginseng | 1.02±0.07△△ | 34.07 | 3.99±0.24 | 2.07±0.11△ |
| Antler plate | 0.97±0.06△△ | 38.97 | 4.68±0.18△△ | 2.34±0.11△△ |
| *P < 0.01 compared with normal control group; △P < 0.05, △△P < 0.01 compared with model group. | ||||
与模型组比较,各剂量复方麦鹿芪人参组小鼠肿瘤细胞密度稀疏,细胞形状不规则,体积变小,瘤组织中可见肿瘤坏死灶,肿瘤周围纤维结缔组织增生比较明显,其中高剂量组变化最明显,与阳性药组和鹿角脱盘原粉组相近。见图 3(插页二)。

|
| A: Model group; B: Positive control group; C:Low dose of MLQS group; D:Medium dose of MLQS group; E:High dose of MLQS group; F: Ginseng geng group; G: Ginseng group; H: Antler plate group. 图 3 各组小鼠肿瘤组织形态表现(HE,×40) Figure 3 Morphology of tumor tissue of mice in various groups (HE, ×40) |
|
|
与模型组比较,各剂量复方麦鹿芪人参组小鼠脾脏组织白髓结构趋于正常,边缘区可辨,淋巴细胞排列密集,其中高剂量组变化最明显;与正常对照组比较,阳性药组小鼠脾脏组织破坏最为严重,红髓与白髓边缘区不明显,白髓结构不规则,边缘区模糊,淋巴细胞排列疏松。见图 4(插页三)。
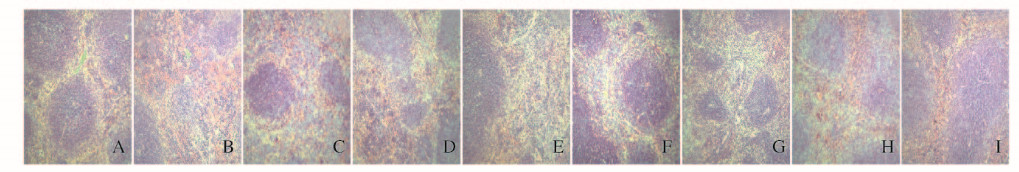
|
| A: Normal control group; B: Model group; C: Positive control group; D: Low dose of MLQS group; E:Medium dose of MLQS group; F:High dose of MLQS group; G: Ginseng geng group; H: Ginseng group; I: Antler plate group. 图 4 各组小鼠脾脏组织形态表现(HE,×40) Figure 4 Morphology of spleen tissue of mice in various groups(HE, ×40) |
|
|
与模型组比较,各用药组小鼠肿瘤细胞凋亡率明显升高,高剂量复方麦鹿芪人参组小鼠肿瘤细胞凋亡率最高,为79.22%(P < 0.05)。见图 5和表 4。
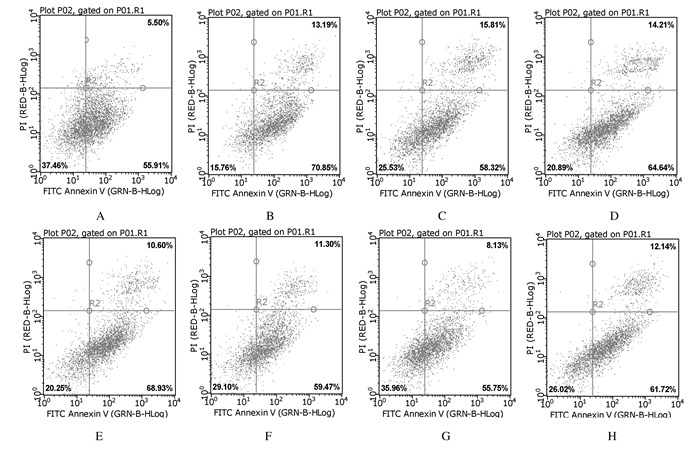
|
| A: Model group; B: Positive control group; C:Low dose of MLQS group; D: Medium dose of MLQS group; E:High dose of MLQS group; F: Ginseng geng group; G: Ginseng group; H: Antler plate group. 图 5 流式细胞术检测各组小鼠肿瘤细胞凋亡率 Figure 5 Apoptotic rates of tumor cells in various groups measured by flow cytometry |
|
|
| (n=5, x± s, η/%) | |||
| Group | Early apoptotic rate | Late apoptotic rate | Total apoptotic rate |
| Model | 55.48±1.17 | 5.47±1.80 | 60.96±2.85 |
| Positive control | 71.48±1.69* | 13.23±0.92* | 84.77±2.01* |
| MLQS | |||
| Low dose | 58.12±1.02* | 15.21±1.42* | 73.34±2.42* |
| Medium dose | 64.55±1.46* | 14.55±1.24* | 79.09±2.67* |
| High dose | 68.49±1.51* | 10.73±0.55* | 79.22±2.02* |
| Ginseng geng | 59.78±1.31* | 11.15±1.34* | 70.93±2.50* |
| Ginseng | 56.21±1.07 | 8.62±1.20* | 64.83±2.09 |
| Antler plate | 60.87±1.42* | 12.78±1.22* | 73.65±2.32* |
| *P < 0.05 compared with model group. | |||
本研究在中医益气养阴理论的基础上,从药性角度出发对人参、黄芪、鹿角脱盘和麦冬4味中药组方[11]。本研究结果表明:通过配伍加工后,复方麦鹿芪人参制剂中检测到了15种人参皂苷,新检测到了4种单体皂苷Rh1、Rg3、Rg5及原人参二醇,与人参原粉比较,除6种人参皂苷Rg1、Re、Rb1、Rb2、Rc和Rd含量有所减少外,其他9种单体皂苷特别是4种稀有皂苷Rh4、Rg3、Rg5和CK含量及15种人参皂苷含量加和值均明显增加。配伍加工后皂苷含量的变化,可能是由于在加工过程中较大相对分子质量的人参皂苷因其糖基不稳定会发生水解,或因加工使得羟基不稳定形成双键,从而增加Rg2、Rg3和原人参二醇的含量或形成皂苷Rk1、Rg5与Rh2[12]。本研究结果表明:配伍后多糖含量的升高不是药物的简单相加,而是配伍促进了多糖的溶出[13];同时,对比配伍加工前后氨基酸含量及组成结果显示:加工后氨基酸含量和组成发生了较大变化,由于加入鹿角脱盘,复方麦鹿芪人参补充了人参氨基酸含量上的不足,同样由于加入人参,麦鹿芪人参氨基酸组成相较鹿角脱盘组成更为合理。
研究[14-18]表明:皂苷、多糖和氨基酸均具有良好的药理作用。皂苷可以通过诱导肿瘤细胞凋亡、抑制肿瘤血管生成和上调抑癌基因p53等多种途径发挥抗肿瘤作用[14-15];多糖作为一种天然大分子,对肿瘤细胞虽无直接杀伤作用,但可以增强吞噬细胞的吞噬活性,激活T、B淋巴细胞,增加外周血T淋巴细胞CD4+/CD8+值,诱导白细胞介素1、白细胞介素2、白细胞介素6、白细胞介素12、肿瘤坏死因子α和干扰素γ水平升高[16-17];鹿角脱盘中氨基酸与其药理作用具有很高的相关性,合理的氨基酸组成可以抑制肿瘤生长,延长患者的生存期[18]。这3种活性成分均具有抗肿瘤活性,且配伍后成分含量升高,推测复方麦鹿芪人参制剂应具有抗肿瘤作用,进而建立H22荷瘤小鼠模型进行体内抗肿瘤实验。
肿瘤的产生是由细胞的异常增殖或细胞凋亡相对减少造成的。一般治疗肿瘤是以增强机体免疫、促进细胞凋亡和阻断细胞周期等多种途径来实现[19-21]。本研究结果表明:复方麦鹿芪人参制剂具有抗肿瘤作用;HE染色结果显示:复方麦鹿芪人参制剂可以抑制肿瘤细胞的生长,促进细胞的坏死,但其对脾脏却有一定的保护作用,说明其可能通过提高机体免疫发挥作用;同时,肿瘤细胞凋亡实验显示:复方麦鹿芪人参制剂可促进肿瘤细胞凋亡,明显提高早期凋亡率,并以一定剂量依赖的方式抑制H22细胞的增殖,与单味药比较,其抗肿瘤作用更强,说明其抗肿瘤用可能与诱导肿瘤细胞凋亡有关。
综上所述,复方麦鹿芪人参制剂中皂苷、多糖和氨基酸的含量与单味药比较均明显增加,且其抗肿瘤作用较单味药更强。但由于中药的抗肿瘤机制的复杂性,复方麦鹿芪人参制剂抗肿瘤的作用机制仍需进一步研究。
| [1] | 陈孟峰, 段小华, 蒋合蓓. 中药益气养阴汤联合TKI方案对晚期非小细胞肺癌患者PFS及OS的影响[J]. 中国中医药科技, 2017, 24(1): 74–75. |
| [2] | Yang J, Yuan D, Xing T, et al. Ginsenoside Rh2 inhibiting HCT116 colon cancer cell proliferation through blocking PDZ-binding kinase/T-LAK cell-originated protein kinase[J]. J Ginseng Res, 2016, 40(4): 400–408. DOI:10.1016/j.jgr.2016.03.007 |
| [3] | Yang B, Xiao B, Sun TY. Antitumor and immunomodulatory activity of Astragalus membranaceus polysaccharides in H22 tumor-bearing mice[J]. Int J Biol Macromol, 2013, 62: 287–290. DOI:10.1016/j.ijbiomac.2013.09.016 |
| [4] | 赵卉, 刘继永, 王峰, 等. 鹿茸等五种鹿产品中氨基酸含量及组成对比分析[J]. 时珍国医国药, 2015, 26(5): 1056–1058. |
| [5] | 杨艳文, 孟凡双, 郜玉钢, 等. 高效液相色谱法同时测定人参制剂中20种人参皂苷方法的建立[J]. 食品科学, 2016, 37(22): 131–135. DOI:10.7506/spkx1002-6630-201622019 |
| [6] | 肖志伟, 乐智勇, 朱国雪, 等. 人参多糖检测方法及提取工艺优选[J]. 中国现代中药, 2016, 18(1): 106–109. |
| [7] | 赵岩, 侯莹莹, 唐国胜, 等. 柱前衍生RP-HPLC测定淫羊藿中氨基酸含量[J]. 药物分析杂志, 2014, 34(8): 1412–1416. |
| [8] | Wang B, Lei CJ, Wu R, et al. Anti-tumor effect of LTA combined with 5-FU on H22 tumor bearing mice[J]. Asian Pac J Trop Med, 2015, 8(7): 560–564. DOI:10.1016/j.apjtm.2015.07.002 |
| [9] | Wang YX, Gu XX, Geng D, et al. Differentiation of bel-7402 human hepatocarcinoma cells induced by aqueous extracts of fresh gecko (AG) and its anti-tumor activity in vivo[J]. J Ethnopharmacol, 2014, 155(3): 1583–1588. DOI:10.1016/j.jep.2014.07.050 |
| [10] | 王秀文. 石蜡切片法中染色技术的改良[J]. 植物研究, 2015, 35(1): 158–160. DOI:10.7525/j.issn.1673-5102.2015.01.025 |
| [11] | 国家药典委员会. 中国药典(2015版):一部[M]. 北京: 中国医药科技出版社,2015. |
| [12] | 张颖, 郝颖, 杨立曼, 等. 不同蒸制工艺对红参中人参皂苷类成分的影响[J]. 中国实验方剂学杂志, 2013, 19(21): 16–20. |
| [13] | 彭江宇, 佟茵, 吴红娟. 茯苓在四君子汤及苓桂术甘汤中对多糖溶出的影响[J]. 中药与临床, 2011, 2(5): 6–7, 15. |
| [14] | Xie QP, Wen HK, Zhang Q, et al. Inhibiting PI3K-AKt signaling pathway is involved in antitumor effects of ginsenoside Rg3 in lung cancer cell[J]. Biomed Pharmacother, 2017, 85: 16–21. DOI:10.1016/j.biopha.2016.11.096 |
| [15] | 梅志宏, 丁雅明, 李凡, 等. 人参皂苷Rg5对人食管癌细胞作用的研究[J]. 中国实验诊断学, 2016, 20(12): 1982–1985. |
| [16] | 周奕阳, 李树芳. 人参多糖联合化疗对中晚期消化道肿瘤患者疗效和免疫功能指标的影响[J]. 实用临床医药杂志, 2016, 20(23): 36–39. |
| [17] | Zhou X, Shi H, Jiang G, et al. Antitumor activities of ginseng polysaccharide in C57BL/6 mice with Lewis lung carcinoma[J]. Tumour Biol, 2014, 35(12): 12561–12566. DOI:10.1007/s13277-014-2576-7 |
| [18] | 金玉坤, 陆伟, 罗雁, 等. 不平衡氨基酸对荷肝癌H22小鼠肿瘤影响的研究[J]. 山东医药, 2011, 51(8): 48–50. |
| [19] | 胡泽成. 青龙衣多糖对结肠癌HCT-116细胞增殖、凋亡及PI3K/Akt信号通路的影响[J]. 中国实验方剂学杂志, 2016, 22(18): 136–139. |
| [20] | 王晓娜, 任庆源, 李雨桐, 等. 自噬对肿瘤发生发展保护作用的研究进展[J]. 中国实验诊断学, 2015, 19(6): 1035–1037. |
| [21] | 宋慧娴, 乔飞, 邵铭. 中医药治疗原发性肝癌的研究进展[J]. 临床肝胆病杂志, 2016, 32(1): 174–177. |
 2017, Vol. 43
2017, Vol. 43


