扩展功能
文章信息
- 律东, 梁春梅, 李明颖, 殷静雯, 罗旭东, 林举达, 马国达
- LYU Dong, LIANG Chunmei, LI Mingying, YIN Jingwen, LUO Xudong, LIN Juda, MA Guoda
- miR-137过表达慢病毒的包装和鉴定
- Packaging and identification of miR-137 overexpression lentivirus
- 吉林大学学报(医学版), 2017, 43(04): 694-697
- Journal of Jilin University (Medicine Edition), 2017, 43(04): 694-697
- 10.13481/j.1671-587x.20170406
-
文章历史
- 收稿日期: 2017-03-01
2. 广东医科大学神经病学研究所, 广东 湛江 524001
2. Institute of Neurology, Guangdong Medical College, Zhanjiang 524001, China
miR-137基因在进化上高度保守且在大脑中呈高丰度表达,在神经发育和突触可塑性等方面发挥重要作用[1-2]。miR-137定位在染色体1p21.3,该区域的微缺失会造成智力缺陷、严重的语言障碍、精神分裂以及孤独症样行为[3]。最近,全基因组关联研究(GWAS)[4]表明:miR-137基因的rs1625579位点与精神分裂症的发病风险有高度关联。此外,miR-137还能够调控BDNF、ZNF804A、TCF4、CACNA1C、CSMD1和C10orf26等精神分裂症易感基因[4-7],表明miR-137及其靶基因之间的相互作用可能参与精神分裂症的发病。但miR-137在神经发育和精神分裂症发生发展中的具体作用尚未明确。深入研究和验证miR-137的潜在靶基因的功能,可为精神分裂症的新药开发提供新的目标靶点。本研究通过构建miR-137过表达慢病毒载体,包装慢病毒,并检测miR-137对HEK293T细胞的感染能力,为进一步研究miR-137及其靶基因在精神分裂症中的作用奠定基础。
1 材料与方法 1.1 质粒、菌株和细胞慢病毒表达载体GV209、慢病毒包装辅助载体pHelper 1.0和pHelper 2.0 (上海Genechem公司),大肠杆菌菌株DH5α, HEK293T细胞株(ATCC细胞库)。
1.2 工具酶和试剂限制性内切酶和T4连接酶(美国NEB公司),Plasmid提取试剂盒和DNaseⅠ (美国Promega公司),DMEM(美国G ibco公司), 胎牛血清(FBS)(上海微科生化试剂有限公司),胰酶(上海化学试剂公司),Lipofectamine 2000(美国Invitrogen公司), Trizol(上海Sangon公司), RevertAid First Strand cDNA Synthesis Kit(美国Thermo Science公司),SYBR Green Realtime PCR Master Mix(美国TOYOBO公司)。
1.3 引物序列和合成miR-137引物(F:TTA-TT GCTTAAGAATACGCGTAG,R:GTGCA-GGGTCCGAGGT)和内参U6引物(F:CTCG-CTTCGGCAGCACA,R:AACGCTTCACGAA-TTTGCGT)由广州Ribobio公司合成。
1.4 miR-137过表达慢病毒载体的构建和鉴定利用T4连接酶将化学合成的miR-137序列连接到慢病毒表达载体GV209上,然后将连接产物转化在大肠杆菌感受态DH5α中,转移到有氨苄抗性(100 g·L-1)的LB琼脂培养基上,挑出单克隆接种,37 ℃培养12~16 h后保存甘油菌,分装200 μL送测序。
1.5 miR-137过表达慢病毒的包装病毒包装前进行HEK293T细胞培养,转染前24 h取对数生长期HEK293T细胞,调整密度为6×105mL-1,接种于直径为15 cm的细胞培养皿,待细胞密度达70%~80%时用Lipofectamine 2000转染。转染后于培养箱中培养4~6 h,然后将培养基换成含10%FBS的高糖DMEM,培养48 h,采用荧光显微镜观察绿色荧光表达后收集上清液。
1.6 miR-137过表达慢病毒的浓缩将转染后48 h收集的HEK293T细胞上清液,4℃、4 000 g离心10 min,以0.45 μm滤器过滤上清液,并加入插在过滤液收集管的过滤杯中。4 000 g离心15 min后将过滤杯倒扣在样品收集杯上,1000 g离心2 min,样品收集杯中即为病毒浓缩液。
1.7 荧光定量PCR法检测HEK293T细胞中miR-137表达将HEK293T细胞铺在6孔板中,待细胞密度达70 %~80 %时加入病毒进行感染,同时设对照组。48 h后采用Trizol法收集细胞总RNA,DNase Ⅰ去除RNA中的DNA,测定RNA的浓度及纯度。按照RevertAid First Strand cDNA Synthesis Kit合成cDNA,以U6为内参,利用SYBR Green Realtime PCR Master Mix进行定量PCR反应。
PCR扩增体系(20 μL):2×SYBY mix10 μL,cDNA 1 μL,上下游引物(10 μmol·L-1)各0.5 μL,ddH2O 8 μL;扩增条件:95 ℃预变性3 min,95℃、10 min,60℃退火20s,72℃延伸15s (40个循环)。定量结果的分析采用2-ΔΔCt方法,实验重复3次。
1.8 统计学分析采用GraphPad Prism 5统计软件进行统计学分析。miR-137的相对表达水平以x± s表示,采用Kolmogorov-Smirnov法检验,如果P>0.1,则呈正态分布,组间比较采用配对t检验。以P<0.01为差异有统计学意义。
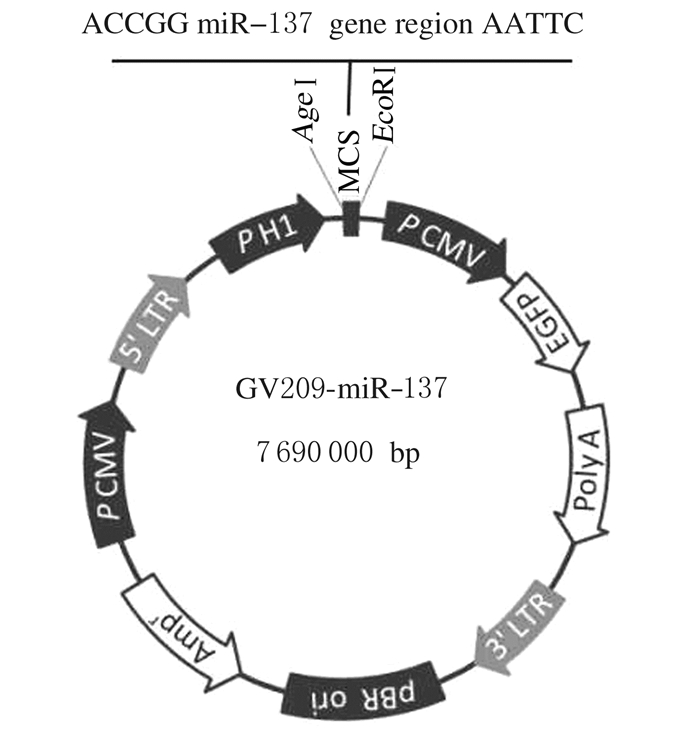
2 结果 2.1 miR-137过表达慢病毒载体的图谱化学合成的miR-137基因序列连接到慢病毒表达载体GV209中(图 1)。表达载体抽提后为了确保载体连接的准确性,对质粒进行了测序,结果完全符合预期。
|
| 图 1 miR-137过表达慢病毒载体构建 Figure 1 Construction of miR-137 overexpression vector |
|
|
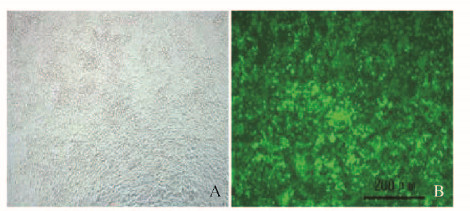
在HEK293T细胞对数生长期进行慢病毒感染,miR-137过表达慢病毒的感染复数(MOI)值为40时,采用荧光显微镜观察,视野中90%以上的细胞均可见绿色荧光蛋白(GFP)(图 2,见插页二),因此将MOI值40作为感染实验选用MOI。
|
| A: Bright field; B: Green fluorescence field. 图 2 荧光显微镜下miR-137过表达慢病毒感染293T细胞的形态表现(bar=200 μm) Figure 2 Morphology of 293T cells after infection of miR-137 overexpressing lentivirus under fluorescence microscope(bar=200 μm) |
|
|
在HEK293T细胞对数生长期进行miR-137过表达慢病毒的感染(MOI=40),感染48 h后收集RNA,进行RT-PCR合成cDNA。采用荧光定量PCR法检测miR-137的表达情况,与对照组(1.0980±0.1089) 比较,感染miR-137过表达慢病毒的HEK293T细胞中miR-137表达水平(13.8400±0.6074) 明显升高(P=0.008),为对照组的12.74倍。
3 讨论精神分裂症是一种严重的慢性精神疾病,其发病率约占全球人口的1%[8]。患者具有高复发率、高死亡率、高致残率和高度的社会危害性,给家庭和社会造成沉重的负担。目前,精神分裂症的发病机制尚不明确,但普遍认为遗传和环境是导致精神分裂症的两大重要因素。寻找精神分裂症的易感基因,对于该病的预防、诊断、治疗及预后都具有重要的意义。
2011年GWAS[4]研究发现:miR-137基因的rs1625579位点与精神分裂症的发病风险高度相关,提示miR-137在精神分裂症中起重要作用。研究[2]显示:miR-137的rs1625579位点虽然在中国汉族人群和西方白种人中的最小等位基因频数存在较大差别,但是rs1625579与精神分裂症易感性并无种族差异,并且首次发现TT基因型患者的工作记忆能力明显低于G等位基因携带者。此外,荟萃分析[9]进一步证明miR-137基因的rs1625579位点与精神分裂症的相关性。Wright等[6]根据生物信息学预测,共发现miR-137调控1144个潜在靶基因。在目前发现的精神分裂相关基因中,约有1/4存在miR-137的靶序列。信号通路分析[6, 10-11]结果表明:miR-137可通过调控ephrin受体、蛋白激酶A(PKA)、神经元轴突导向、突触传递的长时程增强及糖皮质激素受体依赖等信号通路影响神经系统功能和精神分裂症的病理过程。研究[12-15]已表明:miR-137通过调控树突的长度、分支和树突棘的密度等过程,影响小鼠胚胎神经干细胞的增殖、分化和神经元的成熟。以上研究表明:miR-137作为重要节点分子,通过表观调控下游分子及信号通路影响神经发育。miR-137的表达失调,会通过下游靶基因和信号通路的级联放大效应,引起一系列功能基因的失调,进而造成整个神经系统的结构和功能异常,诱发精神分裂症的发生。因此,miR-137及其相关调控通路可能成为开发治疗精神分裂症的药物作用靶点。全面阐明miR-137在精神分裂症中的作用机制,依赖于其调控靶基因的鉴定及功能研究,但迄今为止仅有部分miR-137调控的精神分裂症相关靶基因被鉴定出来。为了进一步研究miR-137在神经发育和精神分裂症中的作用,急需建立有效的miR-137干预手段。本研究通过构建miR-137过表达慢病毒表达载体,感染HEK293T细胞后,通过绿色荧光观察和荧光定量PCR证明成功包装了miR-137过表达慢病毒。本研究结果为今后研究miR-137及其靶基因在神经发育及精神分裂症中的作用奠定了基础。
| [1] | Yin J, Lin J, Luo X, et al. miR-137:a new player in schizophrenia[J]. Int J Mol Sci, 2014, 15(2): 3262–3271. DOI:10.3390/ijms15023262 |
| [2] | Mahmoudi E, Cairns MJ. MiR-137:an important player in neural development and neoplastic transformation[J]. Mol Psychiatry, 2017, 22(1): 44–55. DOI:10.1038/mp.2016.150 |
| [3] | Brecevic L, Rincic M, Krsnikz, et al. Association of new deletion/duplication region at chromosome 1p21 with intellectual disability, severe speech deficit and autism spectrum disorder-like behavior:an all-in approach to solving the DPYD enigma[J]. Transl Neurosci, 2015, 6(1): 59–86. |
| [4] | The Schizophrenia Psychiatric Genome-Wide Association Study (GWAS) Consortium. Genome-wide association study identifies five new schizophrenia loci[J]. Nat Genet, 2011, 43(10): 969–976. DOI:10.1038/ng.940 |
| [5] | Kwon E, Wang W, Tsai LH. Validation of schizophrenia-associated genes CSMD1, C10orf26, CACNA1C and TCF4 as miR-137 targets[J]. Mol Psychiatry, 2013, 18(1): 11–12. DOI:10.1038/mp.2011.170 |
| [6] | Wright C, Turner JA, Calhoun VD, et al. Potential impact of miR-137 and its targets in schizophrenia[J]. Front Genet, 2013, 4: 58. |
| [7] | Kim AH, Parker EK, Williamson V, et al. Experimental validation of candidate schizophrenia gene ZNF804A as target for hsa-miR-137[J]. Schizophr Res, 2012, 141(1): 60–64. DOI:10.1016/j.schres.2012.06.038 |
| [8] | Fu J, Zuo X, Yin J, et al. Association of polymorphisms of the receptor for advanced glycation endproducts gene with schizophrenia in a Han Chinese population[J]. Biomed Res Int, 2017, 2017: 6379639. |
| [9] | Ma G, Yin J, Fu J, et al. Association of a miRNA-137 polymorphism with schizophrenia in a Southern Chinese Han population[J]. Biomed Res Int, 2014, 2014: 751267. |
| [10] | Wright C, Calhoun VD, Ehrlich S, et al. Meta gene set enrichment analyses link miR-137-regulated pathways with schizophrenia risk[J]. Front Genet, 2015, 6: 147. |
| [11] | Vallès A, Martens GJ, De Weerd P, et al. MicroRNA-137 regulates a glucocorticoid receptor-dependent signalling network:implications for the etiology of schizophrenia[J]. J Psychiatry Neurosci, 2014, 39(5): 312–320. DOI:10.1503/jpn |
| [12] | Smrt RD, Szulwach KE, Pfeiffer RL, et al. MicroRNA miR-137 regulates neuronal maturation by targeting ubiquitin ligase mind bomb-1[J]. Stem Cells, 2010, 28(6): 1060–1070. DOI:10.1002/stem.431 |
| [13] | Sun G, Ye P, Murai K, et al. miR-137 forms a regulatory loop with nuclear receptor TLX and LSD1 in neural stem cells[J]. Nat Commun, 2011, 2: 529. DOI:10.1038/ncomms1532 |
| [14] | Hill MJ, Donocik JG, Nuamah RA, et al. Transcriptional consequences of schizophrenia candidate miR-137 manipulation in human neural progenitor cells[J]. Schizophr Res, 2014, 153(1-3): 225–230. DOI:10.1016/j.schres.2014.01.034 |
| [15] | 黄辰, 刘利英, 倪磊, 等. 肿瘤miRNAs调控机制的研究进展与展望[J]. 西安交通大学学报:医学版, 2015, 36(4): 429–434. |
 2017, Vol. 43
2017, Vol. 43


