扩展功能
文章信息
- 邹飞, 王爽, 吴思, 孙峥嵘
- ZOU Fei, WANG Shuang, WU Si, SUN Zhengrong
- 与人巨细胞病毒UL132编码蛋白相互作用蛋白的初步筛选和鉴定
- Screening and identificationof proteinsinteracting with HCMV UL132 protein
- 吉林大学学报(医学版), 2017, 43(04): 690-693
- Journal of Jilin University (Medicine Edition), 2017, 43(04): 690-693
- 10.13481/j.1671-587x.20170405
-
文章历史
- 收稿日期: 2016-10-11
2. 吉林大学第一医院儿科, 吉林 长春 130021
2. Department of Pediatrics, First Hospital, Jilin University, Changchun 130021, China
人巨细胞病毒(human cytomegalovirus,HCMV)感染在全世界范围普遍存在,成人感染率可以达到40%~100%[1]。HCMV可以通过胎盘感染胎儿,宫内感染在新生儿期可能无临床症状,也可能表现为生长发育迟滞、黄疸、小头畸形、血小板减少、肝脾肿大、脑瘫、癫痫、视觉异常、听力和认知异常等多器官系统损伤[2]。与其他器官系统的损伤比较,中枢神经系统损伤尤其严重,因为其造成的损伤不可逆且持续终生[3]。目前对HCMV感染中枢神经系统的致病机制了解甚少。临床分离株中HCMV UL132基因分型有3种,呈现高度基因多态性,推测UL132基因型及其功能在HCMV先天感染致病过程中有着重要的意义[4]。应用酵母双杂交技术从人胎脑cDNA文库中筛选出可能与HCMV基因编码产物发生相互作用的文库蛋白是研究HCMV感染致病机制的主要手段之一。目前国内外尚无关于与HCMV UL132编码蛋白发生相互作用文库蛋白的报道,故本研究首次筛选出可能的人胎脑文库蛋白,为进一步阐述HCMV先天性感染人神经系统的致病机制提供基础数据。
1 材料与方法 1.1 材料和主要仪器标本为传代次数小于5次的HCMV临床分离株H,取材自就诊于中国医科大学附属盛京医院的HCMV感染患儿。患儿年龄5个月,临床表现包括:宫内发育迟缓、直接胆红素及转氨酶升高、间质性肺炎和中枢神经系统影像学异常等。从已感染HCMV患儿的尿液中分离出临床分离株Han株(序列号为GQ981646)。UL132基因扩增模板采用人胚肺细胞培养的HCMV DNA。
本研究采用美国Clontech公司生产的酵母双杂交系统Matchmaker GAL Two-Hybrid System,人胎脑cDNA文库(MatchermakerTM cDNA Libraries)由中科院武汉病毒所肖庚富所长惠赠,引物合成及测序由美国英骏生命技术有限公司完成。主要仪器:BECKMAN Allegra系列台式超高速低温离心机(美国Beckman公司),聚合酶链式反应(PCR)循环仪(美国Perkin Elmer Cetus公司),MicroPulser电穿孔仪(美国Bio-rad公司)。
1.2 构建诱饵表达载体pGBKT7-UL132利用HCMV临床分离株H感染人胚肺细胞,从中提取DNA,用其作为UL132基因扩增的模板。设计用于扩增HCMV UL132片段的上下游引物(设计软件采用Oligo 6.0),序列如下:UL132U,CCGGAATTCTTGTCGACCCCGGCCCCGCGGGGT-CCCCTT; UL132D,CGGCGATCCGGTACCCT-AGTCGTACTCGGGATCTCTG,将限制性内切酶EcoRⅠ和BamHⅠ的酶切位点(下划线)加入到上下游引物中。选取HCMV DNA为模板,应用PCR扩增UL132基因片段,将获取到的UL132片段及载体pGBK-T7进行纯化,选用EcoR Ⅰ和BamH Ⅰ对其进行双酶切并切胶纯化,在T4 DNA连接酶的作用下,连接UL132片段与载体pGBK-T7。转化连接后的pGBKT7-UL132到大肠杆菌TG1感受态细胞中,菌液扩增涂含有卡那霉素抗性的LB固体培养基进行抗性筛选。采用PCR鉴定重组克隆,将阳性克隆进行测序分析。
1.3 应用酵母双杂交技术筛选与HCMVUL132编码蛋白发生相互作用的胎脑蛋白对人胎脑cDNA文库进行扩增,采用碱裂解法提取文库质粒,文库酵母表达载体为pACT2(含转录激活域)。应用小剂量醋酸锂酵母转化法转化pGBKT7-UL132诱饵表达载体到酵母细胞AH109中,菌液涂色氨酸缺陷培养基计算转化效率后进行阳性克隆筛选,采用大量醋酸锂酵母转化法将提取的文库质粒也转化到酵母细胞AH109中。已转化诱饵质粒及文库质粒的菌液涂二缺(亮氨酸/色氨酸缺陷)营养缺陷培养基用来计算转化效率,菌液涂四缺培养基(腺嘌呤/组氨酸/亮氨酸/色氨酸)和X-Gal做显色反应,筛选出来显蓝色的阳性单克隆。将阳性单克隆菌液涂四缺培养基进行扩增,采用玻璃珠法提取酵母质粒,再将质粒转化到大肠杆菌TG1中,菌液涂含氨苄青霉素的平板筛选出人胎脑cDNA文库克隆。应用质粒提取试剂盒提取文库克隆质粒并将其回转到含有诱饵载体pGBKT7-UL132的酵母AH109中进行验证,同样涂二缺平板后计算转化效率,涂四缺平板做显色反应。挑选与HCMVUL132相互作用的cDNA文库进行测序,利用GenBank数据库资源进行比较,对结果进行BLAST分析。
2 结果 2.1 构建和鉴定诱饵表达载体pGBKT7-UL132利用设计的UL132上下游引物成功扩增出HCMV UL132基因片段,片段长度为813bp,琼脂糖凝胶电泳显示条带大小与预期一致且无非特异性条带,将已成功连接HCMV UL132目的片段与pGBKT7的诱饵载体命名为pGBKT7-UL132。应用PCR鉴定(引物选取pGBKT7两端和UL132片段的上下游引物)含pGBKT7-UL132质粒的阳性克隆显示结果正确。采用EcoR Ⅰ和BamH Ⅰ限制性内切酶对提取的pGBKT7-UL132质粒进行双酶切鉴定,电泳结果显示:可见大小约800和7500bp2条目的条带,测序分析显示与电泳结果一致。见图 1。
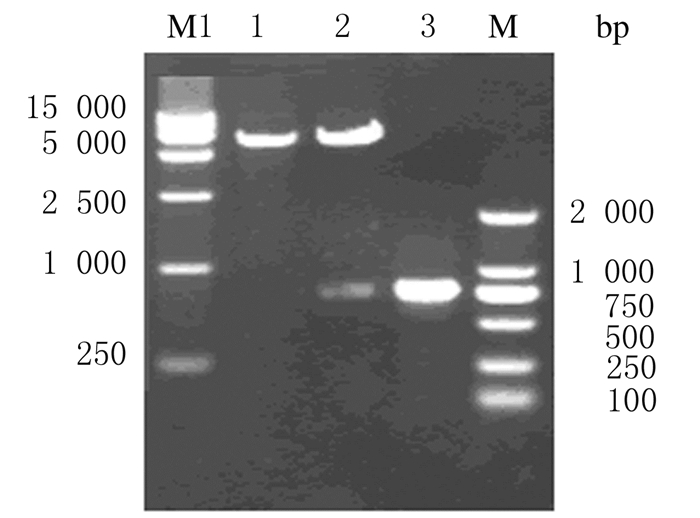
|
| M1:MarkerDL15000; Lane 1:Digested pGBKT7; Lane 2:Digested pGBKT7-UL132; Lane 3:UL132 PCR products; M:Marker DL2000. 图 1 表达载体pGBKT7-UL132的构建和鉴定 Figure 1 Construction and identification of expression vector pGBKT7-UL132 |
|
|
转化胎脑cDNA文库质粒到含有诱饵载体pGBKT7-UL132的酵母细胞AH109中,菌液涂二缺平板后共生长出126个克隆,转化效率为6.6×103cfu·μg-1,符合后续实验要求。在四缺培养基做显色反应有95个菌落呈蓝色(图 2,见插页二),挑取显蓝色的酵母菌落进行扩增,成功提取酵母质粒。
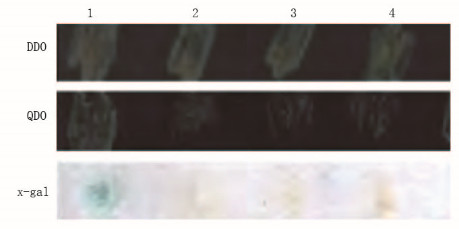
|
| 1:pGBKT7-UL132+pACT2-CAML; 2:pGBKT7-UL132+pGADT7;3:pGBKT7+pACT2-CAML; 4:pGBKT7-Lam+pGADT7-T. 图 2 筛选阳性克隆的显色反应 Figure 2 Chromogenic reaction of screening positive clones |
|
|
采用电转化法将成功提取的酵母质粒转化到大肠杆菌中,菌液涂含氨苄青霉素的固体培养基,鉴定转化后的菌落是否为文库信息(图 3),将选出的55个阳性克隆质粒回转到含pGBKT7-UL132诱饵表达载体的酵母细胞AH109中,菌液涂布于二缺及四缺固体培养基中,生长状况良好,符合实验要求。测序结果显示:有10个克隆与UL132编码蛋白相互作用;BLAST分析显示:7个克隆均与钙离子信号调节亲环素配体(calcium modulating cyclophilin ligand,CAML)高度同源。
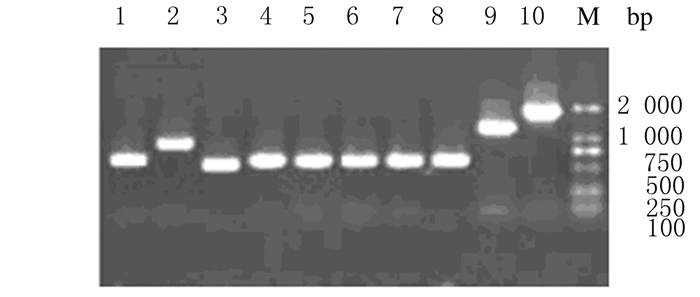
|
| Lane 1,3-8:Transformed colonies; Lane 2,9-10:Negative colonies; M:Marker DL 2000. 图 3 转化菌落的PCR鉴定 Figure 3 Identification of transformed colonies by PCR |
|
|
HCMV是有包膜的DNA双螺旋病毒,属疱疹病毒科β亚科,基因组大小约235 000bp[5]。其全基因组包含192个开放阅读框架编码有功能的蛋白,HCMV由于其包膜表面糖蛋白的多样性而成为最复杂的疱疹病毒,与其他疱疹病毒感染相似,HCMV在感染宿主后,常建立潜伏感染,激活后可以无症状排毒,周而复始形成有效的传播链。HCMV可以感染多种细胞,并在细胞内完成复制,包括腺体和黏膜上皮细胞、平滑肌细胞、成纤维细胞、巨噬细胞、树突状细胞、肝细胞和血管内皮细胞[6]。这种广泛的细胞趋向性有利于病毒在宿主体内和宿主间的传播。近期有研究[7]显示:应用分子病理等检测手段分析显示小鼠脑内高水平β1整合素表达细胞为CMV的首要感染目标,包括内皮细胞、周细胞、脑膜、脉络丛和神经干祖细胞,为其造成中枢神经系统多部位损伤提供了理论依据。
研究[8]表明:HCMV实验室株AD169株含有57个阅读框编码不同的包膜糖蛋白,而低传代分离株含有在AD169株中不存在的13个可能用来编码包膜糖蛋白的阅读框,提示包膜糖蛋白可能在病毒的复制、潜伏和对宿主的致病性方面起重要作用。目前采用质谱分析技术已经识别出19个HCMV的包膜糖蛋白。研究[9]表明:病毒包膜糖蛋白与宿主细胞膜表面蛋白相互作用使感染病毒颗粒内化,宿主细胞膜表面蛋白在HCMV病毒入侵和复制、宿主免疫监视和信号传递中也起关键作用。HCMV UL132编码蛋白正是病毒包膜糖蛋白,理论相对分子质量为29800,HCMV UL132突变在恒河猴视网膜色素上皮细胞中可引起病毒复制缺陷[10],同样也会导致病毒在成纤维细胞中的复制能力下降,提示其在病毒复制过程中起重要作用[11]。
本研究结果表明:CAML为与HCMV-UL132相互作用的蛋白。CAML是定位于内质网上的内在膜蛋白,参与多个信号通路转导及个体发育过程,最初通过酵母双杂交发现可与亲环素B发生相互作用。CAML是小鼠胚胎成纤维细胞有丝分裂期染色体分离的重要调节因子[12]。研究[13]表明:基因敲除小鼠模型显示CAML缺失可以引起胚胎死亡。CAML对于胸腺细胞和滤泡B细胞的生存也起重要作用[14]。免疫组织化学分析结果[15]显示:乳腺癌组织CAML表达水平较正常组织更高。CAML与胞浆钙黏蛋白相互作用提示其在内耳功能上起重要作用。内耳CAML表达缺失可以导致耳蜗毛细胞的严重损伤和彻底耳聋[16]。研究[17]表明:登革病毒衣壳蛋白可以与CAML相互作用,并通过上调CAML抑制感染病毒细胞的凋亡,进而影响病毒的产量。本研究中HCMV UL132编码蛋白为病毒包膜糖蛋白,当病毒包膜糖蛋白与宿主细胞膜表面蛋白相互作用使感染病毒颗粒内化,为HCMV UL132与定位在内质网膜上的CAML发生相互作用提供可能,而CAML参与多条信号通路转导,其表达上调也可抑制细胞的凋亡,推测CAML与HCMV UL132发生相互作用可能在病毒的复制和入侵中起重要作用。本研究结果为揭示CAML在先天性HCMV感染所致的器官系统损害中所起的作用奠定了基础。
| [1] | Cannon MJ, Schmid DS, Hyde TB. Review of cytomegalovirus seroprevalence and demographic characteristics associated with infection[J]. Rev Med Virol, 2010, 20(4): 202–213. DOI:10.1002/rmv.v20:4 |
| [2] | Dreher AM, Arora N, Fowler KB, et al. Spectrum of disease and outcome in children with symptomaticcongenital cytomegalovirus infection[J]. J Pediatr, 2014, 164(4): 855–859. DOI:10.1016/j.jpeds.2013.12.007 |
| [3] | Bristow BN, O'Keefe KA, Shafir SC, et al. Congenitalcytomegalovirus mortality in the United States, 1990-2006[J]. PLoS Negl Trop Dis, 2011, 5(4): e1140. DOI:10.1371/journal.pntd.0001140 |
| [4] | Sun ZR, Ji YH, Ruan Q, et al. Genetic variability of human cytomegalovirus UL132 gene in strains from infected infants[J]. Microbiol Immunol, 2006, 50(10): 773–779. DOI:10.1111/mim.2006.50.issue-10 |
| [5] | Mocarski ES, Shenk T, Pass RF. Chapter69-cytomegaloviruses.FieldsVirology [M]. 5th ed. Philadelphia: Lippincott Williams and Williams, 2007: 2701-2772. |
| [6] | Sinzger C, Digel M, Jahn G. Cytomegalovirus cell tropism[J]. Curr Top Microbiol Immunol, 2008, 325: 63–83. |
| [7] | Kawasaki H, Kosugi I, Sakao-Suzuki M, et al. Cytomegalovirus initiates infection selectively from high-level β1 integrin-expressing cells in the brain[J]. Am J Pathol, 2015, 185(5): 1304–1323. DOI:10.1016/j.ajpath.2015.01.032 |
| [8] | Varnum SM, Streblow DN, Monroe ME, et al. Identification of proteins in human cytomegalovirus (HCMV) particles:the HCMV proteome[J]. J Virol, 2004, 78(20): 10960–10966. DOI:10.1128/JVI.78.20.10960-10966.2004 |
| [9] | Freed DC, Tang Q, Tang A, et al. Pentameric complex of viral glycoprotein H is the primary target for potent neutralization by a human cytomegalovirus vaccine[J]. Proc Natl Acad Sci U S A, 2013, 110(51): E4997–5005. DOI:10.1073/pnas.1316517110 |
| [10] | Lilja AE, William-Chang WL, Barry PA, et al. Functional genetic analysis of rhesus cytomegalovirus:Rh01 is an epithelial cell tropism factor[J]. J Virol, 2008, 82(5): 2170–2181. DOI:10.1128/JVI.02316-07 |
| [11] | Spaderna S, Kropff B, K del Y, et al. Deletion of gpUL132, a structural component of human cytomegalovirus, results in impaired virus replication in fibroblasts[J]. J Virol, 2005, 79(18): 11837–11847. DOI:10.1128/JVI.79.18.11837-11847.2005 |
| [12] | Liu Y, Malureanu L, Jeganathan KB, et al. CAML loss causes anaphase failure and chromosome missegregation[J]. Cell Cycle, 2009, 8(6): 940–949. DOI:10.4161/cc.8.6.7948 |
| [13] | Tran DD, Russell HR, Sutor SL, et al. CAML is required for efficient EGF receptor recycling[J]. Dev Cell, 2003, 5(2): 245–256. DOI:10.1016/S1534-5807(03)00207-7 |
| [14] | Zane NA, Gundelach JH, Lindquist LD, et al. Essential role for CAML in follicular B cell survival and homeostasis[J]. J Immunol, 2012, 188(7): 3009–3018. DOI:10.4049/jimmunol.1101641 |
| [15] | Lim JH, Kim TY, Kim WH, et al. CAML promotes prolactin-dependent proliferation of breast cancer cells by facilitating prolactin receptor signaling pathways[J]. Breast Cancer Res Treat, 2011, 130(1): 19–27. DOI:10.1007/s10549-010-1274-4 |
| [16] | Bryda EC, Johnson NT, Ohlemiller KK, et al. Conditional deletion of calcium-modulating cyclophilin ligand causes deafness in mice[J]. Mamm Genome, 2012, 23(3/4): 270–276. |
| [17] | Li J, Huang R, Liao W, et al. Dengue virus utilizes calcium modulating cyclophilin-binding ligand to subvert apoptosis[J]. Biochem Biophys Res Commun, 2012, 418(4): 622–627. DOI:10.1016/j.bbrc.2012.01.050 |
 2017, Vol. 43
2017, Vol. 43


