扩展功能
文章信息
- 于洋, 刘师兵, 李松岩, 徐路, 徐冶
- YU Yang, LIU Shibing, LI Songyan, XU Lu, XU Ye
- 杨梅素对人卵巢癌SKOV3细胞自噬的诱导作用及线粒体分裂的促进作用
- Induction effect of myricetin on autophagy in SKOV3 cells and promoting effect on mitochondrial fission
- 吉林大学学报(医学版), 2017, 43(04): 685-689
- Journal of Jilin University (Medicine Edition), 2017, 43(04): 685-689
- 10.13481/j.1671-587x.20170404
-
文章历史
- 收稿日期: 2016-09-23
2. 吉林医药学院基础医学院组织与胚胎学教研室, 吉林 吉林 132010
2. Department of Histology and Embryology, School of Basic Medical Sciences, Jilin Medical University, Jilin 132010, China
近年来研究[1]显示:细胞线粒体不仅是细胞内能量合成的重要场所,同时还与多种细胞信号转导有关,发挥着调节细胞状态的重要功能。线粒体功能受损可启动线粒体途径细胞凋亡,因此线粒体是决定“细胞存亡”的重要细胞器,而线粒体膜电位与线粒体动力学变化对线粒体功能具有明确的重要意义。线粒体双层膜间隙由于质子泵产生的正电荷和线粒体基质产生的负电荷形成跨膜电位,简称线粒体膜电位[2],是维持线粒体功能的基础,线粒体膜电势位差的崩溃意味着线粒体功能的严重损伤。线粒体动力学则一般指线粒体的形态、数量及线粒体间的交互连接等[3],线粒体形态即线粒体分裂与融合,多种外界因素均可诱导线粒体分裂或融合[4]。对于肿瘤细胞来说,能量供应变化和化疗药物干预等均可以使线粒体发生短期或长期分裂[5],该过程中动力相关蛋白1(dynamin related protein1, Drp1) 和分裂蛋白Fis1(fission 1,Fis1) 参与线粒体分裂过程,对线粒体数量造成影响。而分裂变小的线粒体又可以影响后续细胞状态,为细胞自噬、凋亡等生物学过程的发生发展提供了条件[6]。本课题组前期研究[7]显示:杨梅素对于SKOV3细胞存在凋亡诱导作用。本研究侧重观察杨梅素对SKOV3细胞线粒体自噬的诱导作用。同时观察了其对于线粒体分裂的影响。
1 材料与方法 1.1 细胞、主要试剂和仪器SKOV3细胞株由吉林大学病理生理学系惠赠。线粒体膜电位试剂盒购于德国Muse试剂公司,所有一抗均购于美国Santa Cruz公司,新生牛血清和1640培养基购于美国Gibco公司,二抗及其他试剂购于北京鼎国生物试剂公司。Muse细胞状态分析仪购于德国Merck & Millipore公司。
1.2 细胞培养和分组SKOV3细胞用含体积分数为10%新生牛血清的1640培养液,置于37 ℃、5% CO2条件下培养,隔2~3 d传代1次,取生长状态良好的对数生长期细胞,杨梅素给药剂量按0、20、40和60 g·L-1分为对照组和低、中、高剂量杨梅素组,均作用12 h。
1.3 线粒体膜电位检测严格按照Muse试剂盒说明书进行操作,并利用Muse细胞状态分析仪进行检测。
1.4 MitoTracker Red荧光探针观察线粒体形态按照1.2中的方法进行分组及给药处理,制备细胞爬片后,以MitoTracker Red 250 μmol·L-1,37℃孵育30 min,并以Hoechst 33342染核2 min后,激光共聚焦显微镜观察线粒体形态。
1.5 Western blotting法检测Drp1、Fis1、LC3-Ⅰ和LC3-Ⅱ蛋白表达水平按照1.2中的方法分组和给药处理SKOV3细胞,以胰蛋白酶消化离心收集全部细胞,收集后的每管细胞加入120 μL RIPA细胞裂解液,混匀后,冰浴下用细胞超声粉碎仪进行超声粉碎2次,每次5~10 s,然后放入4 ℃冰箱45 min,充分裂解细胞。离心,收集上清液,以96孔板蛋白定量后,所余部分上清液与5×SDS Loading缓冲液按4:1体积比混匀后进行蛋白变性。变性后的蛋白提取液进行SDS-PAGE电泳,电泳条件:浓缩胶100V、30 min,分离胶200V、60 min,电泳结束后,利用湿转法将胶内蛋白转移到PVDF膜上,将膜用5%脱脂奶粉封闭1.5 h后,PBST洗涤3次,加入以一抗稀释液200倍稀释后的检测目标一抗(分别为β-actin、Drp1、Fis1、LC3-Ⅰ和LC3-Ⅱ),4℃孵育过夜。第2天,PBST洗涤3次,加入过氧化物酶标记的相应二抗(1:1 000稀释),室温下摇床摇1 h,PBST洗涤3次,ECL发光并拍照,以β-actin作为内参照对各组蛋白表达的灰度值进行对比分析。蛋白表达水平=每个样本条带灰度值/β-actin灰度值。
1.6 间接免疫荧光法检测自噬相关蛋白LC表达强度按照1.2中的方法进行分组和给药处理,制备细胞爬片,4%多聚甲醛固定30 min,0.01 mol·L-1 PBS洗涤3次,每次2 min。加入蛋白酶K 1 mg·L-1消化1 min,0.01 mol·L-1 PBS洗涤3次,每次2 min;0.1 % Triton孵育细胞10 min,0.01 mol·L-1 PBS洗涤3次,每次2 min;5%山羊血清封闭30 min后弃去多余血清,将稀释好的LC3一抗覆在细胞面上,4℃湿盒过夜。弃去多余一抗,0.01%Triton-0.01 mol·L-1 PBS洗涤3次,每次5 min,以相应的荧光二抗室温避光孵育40 min,0.01% Triton-0.01 mol·L-1 PBS洗3次,每次5 min,Hoechst33342复染细胞核2 min,甘油封片。激光共聚焦显微镜观察LC3阳性表达(红色光)情况,并于200倍镜下随机选取6个视野取图,以图像分析软件对阳性表达强度进行分析。
1.7 统计学分析应用SPSS 13.0统计软件进行统计学分析。各组细胞Drp1、Fis1、LC3-Ⅰ和LC3-Ⅱ蛋白表达水平以x± s表示,多组间样本均数比较采用单因素方差分析,两两比较采用t检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组SKOV3细胞线粒体膜电位对照组及低、中、高剂量杨梅素组SKOV3细胞线粒体膜电位下降比例(%)分别为5.60±0.23、16.32 ± 1.22、22.89 ± 1.46和29.41 ± 2.11。与对照组比较,各剂量杨梅素组细胞线粒体膜电位下降比例明显升高(t=3.27,t=6.85,t=5.49,P < 0.05)。见图 1。
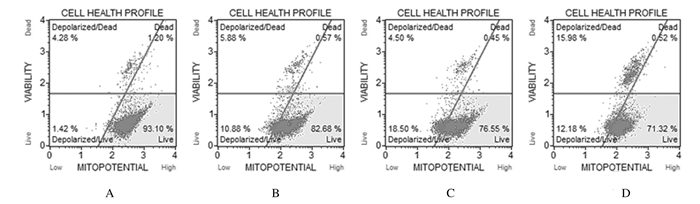
|
| A:Control group; B-D:Low, middle and high doses of myricetin groups. 图 1 各组SKOV3细胞线粒体膜电位 Figure 1 Mitochondrial membrane potentials of SKOV3 cells in various groups |
|
|
MitoTracker Red荧光探针特异性标记线粒, 体观察其形态。随着给药剂量增加,共聚焦显微镜下可见MitoTracker Red特异性标记出的红色线粒体亮度逐渐增强,沙砾感增加,提示各剂量杨梅素组SKOV3细胞线粒体分裂趋势逐渐明显。见图 2(插页二)。
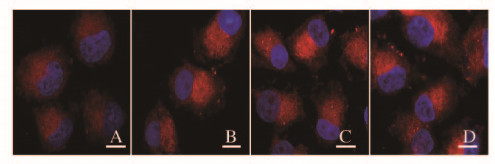
|
| A:Control group; B-D:Low, middle and high doses of myricetin groups. 图 2 各组SKOV3细胞线粒体形态表现(bar=5 μm) Figure 2 Morphology of mitochondria of SKOV3 cells in various groups(bar=5 μm) |
|
|
随着杨梅素给药剂量增加,细胞中Drp1和Fis1蛋白表达水平均逐渐升高(F=6.374,F=9.286,P < 0.05)。与对照组比较,中和高剂量杨梅素组细胞中Drp1(t=3.28,t=6.17,P < 0.05) 和各剂量杨梅素组细胞中Fis1(t=8.32,t=6.74,t=9.27,P < 0.05) 蛋白表达水平明显升高。见图 3和表 1。
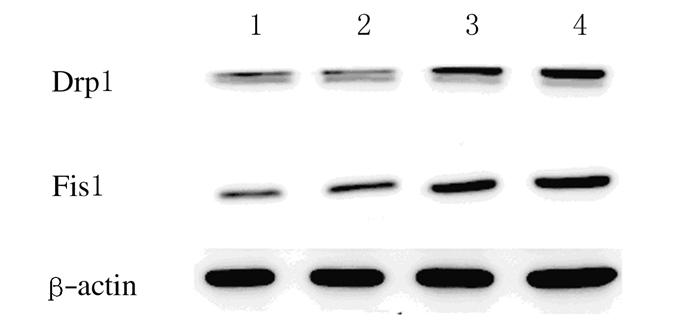
|
| Lane 1:Control group; Lane 2-4:Low, middle and high doses of myricetin groups. 图 3 Western blotting法检测各组SKOV3细胞中Drp1和Fis1蛋白表达电泳图 Figure 3 Electrophoregram of expressions of Drp1 and Fis1 proteins in SKOV3 cells in various groups detected by Western blotting method |
|
|
| (n=3, x± s) | ||
| Group | Drp1/β-actin | Fis1/β-actin |
| Control | 0.35±0.06 | 0.47±0.06 |
| Myricetin | ||
| Low dose | 0.40±0.04 | 0.86±0.12* |
| Middle dose | 0.65±0.09* | 0.93±0.11* |
| High dose | 0.92±0.11* | 1.25±0.14* |
| F | 6.374 | 9.286 |
| *P < 0.05 vs control group. | ||
随着杨梅素给药剂量增加,LC3-Ⅱ表达水平均逐渐增强,对照组和低、中、高剂量杨梅素组LC3-Ⅱ/LC3-Ⅰ比值分别为0.12±0.01、0.15±0.01、0.37±0.05和0.58±0.04,中和高剂量杨梅素组SKOV3细胞中LC3-Ⅱ/LC3-Ⅰ比值明显高于对照组(t=3.28,t=4.21,P < 0.05)。见图 4。

|
| Lane 1:Control group; Lane 2-4:Low, middle and high doses of myricetin groups. 图 4 Western blotting法检测各组SKOV3细胞中LC3-Ⅰ和LC3-Ⅱ蛋白表达电泳图 Figure 4 Electrophoregram of expressions of LC3-Ⅰ and LC3-Ⅱ proteins in SKOV3 cells in various groups detected by Western blotting method |
|
|
随着杨梅素给药剂量的增加,各组SKOV3细胞中LC3表达强度(红色光显示阳性表达)逐渐增强。见图 5 (插页二)。
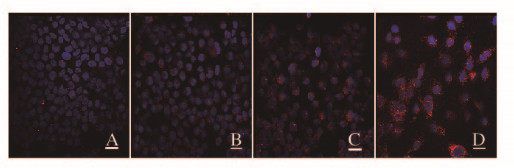
|
| 图 5 间接免疫荧光法检测各组SKOV3细胞中LC3蛋白表达(bar=20 μm) Figure 5 Expressions of LC3 in SKOV3 cells in various groups detected by indirect immunofluorescence method(bar=20 μm) |
|
|
线粒体膜电位的维持是保证线粒体发挥正常生理功能的基础,线粒体膜电位的下降,往往是细胞线粒体功能受损的早期表现[8]。外源性应激如能量供给变化、钙离子浓度改变及外源化合物作用等均可以影响线粒体膜电位[9],通常细胞能够通过代偿机制对其进行调节,当应激程度加深超过代偿能力时,出现“线粒体膜电位崩溃”,启动自噬、凋亡甚至坏死信号通路,出现细胞死亡[10]。本研究结果显示:与对照组比较,各剂量杨梅素组线粒体膜电位下降比例明显升高,表明杨梅素可引发SKOV3细胞线粒体膜电势位差的崩溃而导致细胞凋亡,并随着给药剂量增加,这种趋势逐渐变得明显,说明杨梅素对线粒体作用明显,其生物学功能的发挥与对线粒体的作用关系密切。
传统观点认为线粒体是位于胞浆内的扁豆样细胞器,但是越来越多的研究[11-13]显示:线粒体的数量、形态及结构都处于高度活跃的变化之中,在细胞能量需求改变、外源药物作用或有丝分裂过程等病理生理过程中,线粒体动力学都会随之发生改变,而线粒体的这种改变可以看做是对细胞环境变化所作出的适应性调整。本研究结果显示:杨梅素作用后,SKOV3细胞的线粒体出现明显砂砾样改变,说明杨梅素给药组细胞线粒体分裂趋势逐渐明显,且促进线粒体分裂的相关蛋白Drp1和Fis1的表达水平随着给药剂量的增加逐渐增强,表观及内在均提示杨梅素对线粒体分裂具有促进作用。自噬一般被认为是细胞内对立于凋亡的一种保护性机制,但新近很多研究[6, 14-16]显示:肿瘤细胞内的过度自噬却能够导致细胞死亡,所以自噬在细胞生存或死亡过程中所扮演的具体角色还有待于更深入的研究。研究[17]显示:线粒体分裂能够促进自噬的发生,线粒体动力学影响自噬过程的诸多环节。LC3-Ⅰ和LC3-Ⅱ通常被认为是“自噬标志物”[18],通常情况下LC3-Ⅱ/ LC3-Ⅰ比值被用于判断细胞内自噬的发生程度。本研究通过间接免疫荧光法观察到:随着杨梅素给药剂量的增加,各组SKOV3细胞中LC3表达较对照组逐渐增强;Western blotting结果显示:随着杨梅素给药剂量增加,杨梅素组LC3-Ⅱ/LC3-Ⅰ比值较对照组也有所升高,表明LC3-Ⅱ表达水平逐渐升高,提示杨梅素干预SKOV3细胞后有自噬的发生,且存在量效关系。
综上所述,杨梅素作用于SKOV3细胞后,将线粒体作为一个主要的靶细胞器,不仅能够通过影响线粒体膜电势位差而影响SKOV3细胞生存状态,还使线粒体分裂相关蛋白Drp1和Fis1的表达水平升高,促进了线粒体分裂,同时对SKOV3细胞具有自噬诱导作用。结合本课题组之前研究证明的杨梅素对SKOV3细胞凋亡诱导作用,具体探讨线粒体分裂、自噬和凋亡三者之间关系的研究显得越来越有价值;另外,自噬在该过程中发挥“保活”还是“促死”作用的问题也值得更加深入的思考。本研究结果为杨梅素的后续研究提供了新的思路和方向。
| [1] | Kim A. A panoramic overview of mitochondria and mitochondrial redox biology[J]. Toxicol Res, 2014, 30(4): 221–234. DOI:10.5487/TR.2014.30.4.221 |
| [2] | Fitzwalter BE, Thorburn A. Recent insights into cell death and autophagy[J]. FEBS J, 2015, 282(22): 4279–4288. DOI:10.1111/febs.13515 |
| [3] | Yu T, Robotham JL, Yoon Y. Increased production of reactive oxygen species in hyperglycemic conditions requires dynamic change of mitochondrial morphology[J]. Proc Natl Acad Sci U S A, 2006, 103(8): 2653–2658. DOI:10.1073/pnas.0511154103 |
| [4] | Parone PA, Da Cruz S, Tondera D, et al. Preventing mitochondrial fission impairs mitochondrial function and leads to loss of mitochondrial DNA[J]. PLoS One, 2008, 3(9): e3257. DOI:10.1371/journal.pone.0003257 |
| [5] | Shenouda SM, Widlansky ME, Chen K, et al. Altered mitochondrial dynamics contributes to endothelial dysfunction in diabetes mellitus[J]. Circulation, 2011, 124(4): 444–453. DOI:10.1161/CIRCULATIONAHA.110.014506 |
| [6] | Webster BR, Scott I, Traba J, et al. Regulation of autophagy and mitophagy by nutrient availability and acetylation[J]. Biochim Biophys Acta, 2014, 1841(4): 525–534. DOI:10.1016/j.bbalip.2014.02.001 |
| [7] | 于洋, 刘亚萌, 吴少花, 等. 杨梅素对人卵巢癌SKOV3细胞的凋亡诱导作用[J]. 吉林大学学报:医学版, 2015, 41(5): 902–906. |
| [8] | Gillies LA, Kuwana T. Apoptosis regulation at the mitochondrial outer membrane[J]. JCell Biochem, 2014, 115(4): 632–640. DOI:10.1002/jcb.24709 |
| [9] | Macintosh RL, Ryan KM. Autophagy in tumour cell death[J]. Semin Cancer Biol, 2013, 23(5): 344–351. DOI:10.1016/j.semcancer.2013.05.006 |
| [10] | Kushnareva Y, Newmeyer DD. Bioenergetics and cell death[J]. Ann N Y Acad Sci, 2010, 1201: 50–57. DOI:10.1111/j.1749-6632.2010.05633.x |
| [11] | Camus MF, Wolf JB, Morrow EH, et al. Single nucleotides in the mtDNA sequence modify mitochondrial molecular function and are associated with sex-specific effects on fertility and aging[J]. Curr Biol, 2015, 25(20): 2717–2722. DOI:10.1016/j.cub.2015.09.012 |
| [12] | Madrigal-Matute J, Cuervo AM. Regulation of liver metabolism by autophagy[J]. Gastroenterology, 2016, 150(2): 328–339. DOI:10.1053/j.gastro.2015.09.042 |
| [13] | Suomalainen A. Mitochondrial roles in disease:a box full of surprises[J]. EMBO Mol Med, 2015, 7(10): 1245–1247. DOI:10.15252/emmm.201505350 |
| [14] | Mayorga-Torres BJ, Cardona-Maya W. Postfertilization autophagy of the sperm organelles prevents paternal mitochondrial DNA transmission[J]. Eur Urol, 2012, 61(3): 625–626. DOI:10.1016/j.eururo.2011.12.041 |
| [15] | Kubli DA, Gustafsson ÅB. Mitochondria and mitophagy the yin and yang of cell death control[J]. Circ Res, 2012, 111(9): 1208–1221. DOI:10.1161/CIRCRESAHA.112.265819 |
| [16] | 张嘉玲, 郑长军, 杨瑞琦, 等. 重楼皂苷Ⅶ联合顺铂通过内质网应激诱导卵巢癌细胞凋亡[J]. 中国实验诊断学, 2015, 19(1): 6–9. |
| [17] | Reinhardt F, Schultz J, Waterstradt R, et al. Drp1 guarding of the mitochondrial network is important for glucose-stimulated insulin secretion in pancreatic beta cells[J]. Biochem Biophys Res Commun, 2016, 474(4): 646–651. DOI:10.1016/j.bbrc.2016.04.142 |
| [18] | Karim MR, Kawanago H, Kadowaki M. A quick signal of starvation induced autophagy:transcription versus post-translational modification of LC3[J]. Anal Biochem, 2014, 22(465C): 28–34. |
 2017, Vol. 43
2017, Vol. 43


