扩展功能
文章信息
- 李亚巍, 韩丽琴, 金瑛, 朱文赫
- LI Yawei, HAN Liqin, JIN Ying, ZHU Wenhe
- 灵芝多糖硫酸酯对大鼠脑缺血再灌注损伤的保护作用及其机制
- Protective effect of Ganodermalucidumpolysaccharide sulfate on cerebral ischemia reperfusion injury in ratsand its mechanism
- 吉林大学学报(医学版), 2017, 43(04): 679-684
- Journal of Jilin University (Medicine Edition), 2017, 43(04): 679-684
- 10.13481/j.1671-587x.20170403
-
文章历史
- 收稿日期: 2016-12-07
2. 吉林医药学院基础医学院生物化学教研室, 吉林 吉林 132013
2. Department of Biochemistry, School of Basic Medical Sciences, Jilin Medical College, Jilin 132013, China
近年来,缺血性脑血管病已成为影响人类健康的主要疾病之一。灵芝(Ganodermalucidum)为多孔菌科真菌赤芝或紫芝的干燥子实体,具有补中益气、滋补强壮、扶正固本、延年益寿之功效,在我国已有上千年的药用和食用历史[1-2]。灵芝多糖(Ganodermalucidum polysaccharide, GLP),是灵芝的主要活性成分之一,具有增强机体免疫力、抗肿瘤、抗病毒和抗衰老等作用[3-4]。多糖的分子修饰可能极大程度提高多糖的生物学功能,因此多糖的分子修饰已成为多糖构效关系研究的重要手段,也是发现和研制多糖类生物制剂的重要途径。
在天然多糖分子中引入某种离子基团,不仅能够明显改善多糖在水溶液中的溶解度,而且可以使多糖在水溶液中的链构象发生改变,从而使其具有某种特定的结构而提高生物活性。目前改变多糖结构应用最为广泛且效果较好的方法是硫酸酯化法,其修饰结果是将硫酸基团加到多糖的糖基上,使其生物活性发生改变。常用的硫酸酯化修饰方法有氯磺酸-吡啶法、三氧化硫-吡啶法和浓硫酸法等[5]。目前,已有对灵芝多糖进行硫酸酯化修饰的报道,但对灵芝多糖硫酸酯(Ganodermalucidum polysaccharide sulfate, GLPS)生理功能的相关研究[6-7]大多集中在抗肿瘤等方面,而关于GLPS对脑缺血再灌注损伤影响的研究较少。
本研究对GLP进行硫酸酯化修饰,采用线栓法建立大鼠脑缺血再灌注损伤模型,观察GLPS对脑缺血再灌注损伤的保护作用及对脑组织中相关因子表达的影响,初步探讨其作用机制,为GLP相关药品及保健品的进一步开发利用提供理论依据。
1 材料与方法 1.1 实验动物选取健康成年SD大鼠100只,雄性,体质量200~250 g,购于吉林大学基础医学院医学实验动物中心,动物合格证号:SCXK-吉2013-0001。动物适应性喂养1周后开始实验,室温18℃~28℃,相对湿度为62%~80%。
1.2 药物和试剂灵芝干燥子实体购于吉林省吉林市中药材市场,按参考文献[8]方法,获得灵芝多糖。尼莫地平(Nimodipine) (天津制药厂),超氧化物歧化酶(SOD)、丙二醛(MDA)、肿瘤坏死因子α(TNF-α)、白细胞介素1(IL-1)、白细胞介素6(IL-6) 和核因子kappa B(NF-κB)ELISA试剂盒(南京建成生物工程研究所),热休克蛋白70(HSP70) 和磷酸化的丝氨酸/苏氨酸蛋白激酶(p-Akt)抗体(美国Santa Cruza公司)。其他试剂均为国产分析纯。
1.3 主要仪器550型酶标仪(美国Bio-Rad公司),UV-4802型紫外可见分光光度计(上海UNICO仪器有限公司),TGL-16G台式高速离心机(上海安亭科学仪器厂),MTN-658自动生化分析仪(长春市曼特诺医疗器械有限公司)。
1.4 GLPS的制备按照参考文献[7]中的方法,精确称取100 mg一步醇沉的GLP,80 ℃干燥过夜后,置于500 mL平底烧瓶中,加入10 mL吡啶,搅拌溶解,水浴锅中加热升至反应温度后加入酯化剂氨基磺酸,与酯化试剂充分混合,80℃下磁力搅拌反应。反应完毕后冰浴中冷却至室温,反应液加入预冷的50 mL冰水中,用预冷的(饱和) 2.5 mol·L-1NaOH中和至pH值7.5,45 ℃减压浓缩后,自来水透析2 d,蒸馏水透析1 d,透析液加入3倍体积无水乙醇(或95%乙醇)醇沉,静置过夜,3000 r·min-1离心15 min,沉淀物用蒸馏水溶解,放在80℃水浴锅上将乙醇彻底挥尽,最后冷冻干燥,得到GLPS。采用红外光谱检测判定硫酸酯化是否成功。
1.5 分组和给药100只雄性SD大鼠随机分为假手术组(腹腔注射生理盐水)、模型组(腹腔注射生理盐水)、GLP组(40 mg·kg-1·d-1)、GLPS组(40 mg·kg-1·d-1)和尼莫地平组(1 mg·kg-1·d-1),每组20只(其中测定脑含水量每组10只,ELISA法检测和Western blotting法检测每组10只)。各组动物每天腹腔注射给药1次,连续7d。
1.6 脑缺血再灌注模型的制备[9]末次给药2h后,腹腔注射10%水合氯醛麻醉大鼠。将麻醉好的大鼠固定于鼠台上,剪毛切开颈部皮肤,分离右侧颈总动脉、颈外动脉和颈内动脉。在颈总动脉和颈外动脉备好手术线,并用动脉夹夹住颈总动脉近心端,远心端处穿手术线并打活结,用眼科剪将颈总动脉剪口,将顶端钝圆的MACO栓线插入颈内动脉18mm,遇到阻力停止,用手术线固定栓线,缝合皮肤。假手术组大鼠不插入栓线,只分离出颈外动脉以及颈内动脉。术后2h选择出现竖毛、左侧肢体出现偏瘫的大鼠进行再灌注。术后22h后进行神经功能缺损评分,24h立即断头取脑,进行脑组织含水量、ELISA法和Western blotting法检测。
1.7 大鼠神经功能缺损评分按照参考文献[8]中的方法对大鼠神经功能缺损评分。大鼠脑缺血再灌注22h后进行神经功能缺损评分。评分标准如下:神经功能正常者为0分,提尾时左前肢屈曲者为1分,向瘫痪侧转圈者为2分,向左侧倾斜者为3分,肢体无自由活动、意识丧失者为4分,死亡者为5分。得分越高,说明大鼠行为障碍越严重。
1.8 大鼠脑组织含水量的测定采用干湿法进行测定,大鼠断头取脑后称量其湿质量,然后将脑组织于100℃温度下烘干24h后,称量其干质量。大鼠脑组织含水量计算公式:含水量=(湿质量-干质量)/湿质量×100%。
1.9 大鼠脑组织中SOD活性和MDA水平检测实验结束后,快速取脑,取大鼠右侧脑组织(即梗死侧)称质量,剪碎,于0.9%冰冷生理盐水中进行匀浆,制成10%脑组织匀浆液,并用冷冻离心机在-4℃条件下3 000 r·min-1低温离心15 min,吸取上清液,-80℃保存备用,根据试剂盒说明书进行操作,测定各组大鼠SOD活性和MDA水平。
1.10 ELISA法检测大鼠脑组织中NF-κB、TNF-α、IL-1和IL-6水平实验结束后快速取脑,取大鼠右侧脑组织(即梗死侧)称质量,剪碎,加入遇冷的PBS匀浆,并用冷冻离心机在-4℃条件下10 000 r·min-1低温离心15 min,吸取上清液,-80℃保存备用,按照ELISA试剂盒说明书检测NF-κB、TNF-α、IL-1和IL-6水平。
1.11 Western blotting法检测大鼠脑组织中HSP-70和p-Akt表达水平实验结束后,快速取脑,取大鼠右侧脑组织(即梗死侧)称质量,剪碎,制成匀浆(同ELISA步骤),0.25%胰酶消化,1000 r·min-1离心10 min收集细胞,以PBS洗2次,用PIPA细胞裂解液置冰浴裂解,4℃条件下12000 r·min-1离心5 min,收集上清。经BCA法进行蛋白定量后,取等量样品以12 % SDS-PAGE进行电泳。电泳后将蛋白转印至硝酸纤维素膜上,5%脱脂奶粉封闭1 h后,HSP-70和p-Akt抗体(浓度1:1000) 孵育过夜,再以过氧化酶标记的二抗封闭液孵育1 h,采用ECL显影,化学发光成像系统检测。Quantity One软件分析目的条带灰度值,以蛋白灰度值与β-actin灰度值的比值表示蛋白表达水平
1.12 统计学分析采用SPSS13.0统计软件进行统计学分析。大鼠神经功能缺损评分,脑含水量,脑组织中SOD活性,脑组织中MDA、NF-κB、TNF-α、IL-1和IL-6水平,脑组织中HSP-70和p-Akt蛋白表达水平均以x± s表示,经F检验显示方差齐性,组间比较采用单因素分差分析。以α= 0.05为检验水准。
2 结果 2.1 GLPS红外光谱测定结果GLPS红外光谱见图 1。根据红外光谱图可以看出:GLPS光谱中保留了GLP的特征吸收峰,而且新出现1207 cm-1左右的S = O伸缩振动和813 cm-1左右的C-O-S伸缩振动的特征吸收峰,说明硫酸基团以酯键的形式已经连接在GLP分子上。
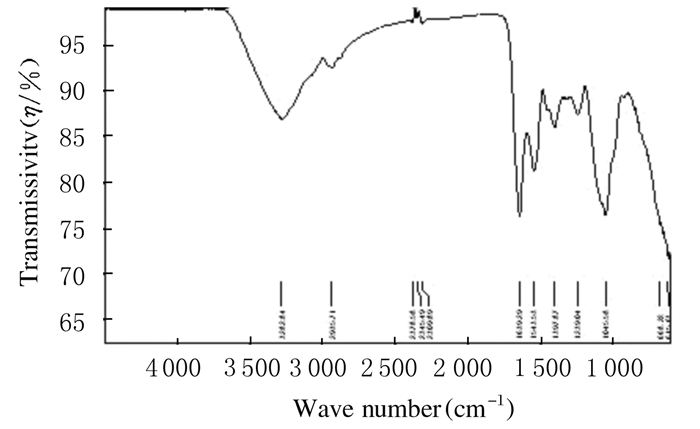
|
| 图 1 GLPS红外光谱图 Figure 1 Infrared spectrum of GLPS |
|
|
与假手术组比较,模型组大鼠出现明显神经功能障碍表现,神经功能缺损评分增高(P < 0.01),表明缺血再灌注损伤模型造模成功;与模型组比较,GLP和GLPS组大鼠神经功能缺损评分降低(P < 0.01)。与假手术组比较,模型组大鼠脑组织含水量升高(P < 0.01);与模型组比较,GLP和GLPS组大鼠脑组织含水量减少(P < 0.05或P < 0.01),且GLPS组变化较GLP组明显(P < 0.05)。见表 1。
| (n=10, x± s) | ||
| Group | Score | Water content (η/%) |
| Sham operation | 0 | 77.56±0.94 |
| Model | 3.56±0.21* | 83.67±1.33* |
| GLP | 2.88±0.37△△ | 81.46±1.25△ |
| GLPS | 2.44±0.53△△ | 79.82±0.88△△# |
| Nimodipine | 2.17±0.69△△ | 78.36±0.79△△ |
| *P< 0.01compared with sham operation group;△P < 0.05, △△P < 0.01 compared with model group;#P < 0.05 compared with GLP group. | ||
与假手术组比较,模型组大鼠脑组织SOD活性降低(P < 0.01),MDA水平升高(P < 0.01);与模型组比较,GLP组和GLPS组大鼠脑组织SOD活性升高、MDA水平降低(P < 0.05或P < 0.01),且GLPS组变化较GLP组明显(P < 0.05)。见表 2。
| (n=10, x± s) | ||
| Group | SOD [λB/(U·mg-1)] | MDA [ mB/(μmol·g-1)] |
| Sham operation | 76.35±3.14 | 6.21±1.73 |
| Model | 32.27±4.56* | 10.35±2.06* |
| GLP | 38.21±3.77△ | 9.17±1.56△ |
| GLPS | 47.82±6.34△△# | 8.44±0.37△△# |
| Nimodipine | 56.29±5.15△△ | 7.38±1.19△△ |
| * P < 0.01 compared with sham operation group;△P < 0.05, △△P < 0.01 compared with model group;# P < 0.05 compared with GLP group. | ||
与假手术组比较,模型组大鼠脑组织中NF-κB、TNF-α、IL-1和IL-6水平升高(P < 0.01);与模型组比较,GLP组和GLPS组大鼠脑组织中NF-κB、TNF-α、IL-1和IL-6水平降低(P < 0.05或P < 0.01),且GLPS组变化较GLP组明显(P < 0.05)。见表 3。
| (n=10, x± s) | ||||
| Group | NF-κB[ρB/(ng·L-1)] | TNF-α[ρB/(μg·L-1)] | IL-1[ρB/(ng·L-1)] | IL-6[ρB/(ng·L-1)] |
| Sham operation | 1.53±0.37 | 1.46±0.57 | 2.94±0.76 | 2.15±0.32 |
| Model | 2.16±0.48* | 3.17±0.22* | 4.83±0.29* | 3.16±0.71* |
| GLP | 1.97±0.77△ | 2.59±0.30△△ | 4.06±0.28△△ | 2.83±0.46△ |
| GLPS | 1.72±0.83△△# | 2.07±0.42△△# | 3.57±0.73△△# | 2.42±0.38△△# |
| Nimodipine | 1.67±0.92△△ | 1.88±0.74△△ | 3.13±0.27△△ | 2.28±0.44△△ |
| *P < 0.01 compared with sham operation group;△P < 0.05, △△P < 0.01 compared with model group;#P < 0.05 compared with GLP group | ||||
与假手术组比较,模型组大鼠脑组织中HSP-70和p-Akt蛋白表达水平降低(P < 0.01);与模型组比较,GLP组和GLPS组大鼠脑组织中p-Akt蛋白表达水平升高(P < 0.05),GLPS组大鼠脑组织中HSP-70蛋白表达水平明显升高(P < 0.01),而GLP组大鼠脑组织中HSP-70蛋白表达水平升高不明显。与GLP组比较,GLPS组大鼠脑组织中p-Akt和HSP-70蛋白表达水平明显升高(P < 0.05)。见图 2和表 4。
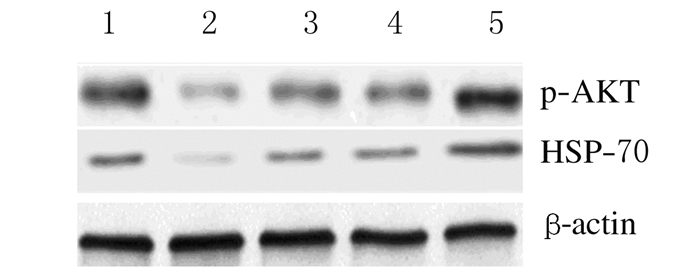
|
| Lane 1: Sham operation group; Lane 2: Model group; Lane 3:GLPS group; Lane 4:GLP group; Lane 5: Nimodipine group. 图 2 各组大鼠脑组织中HSP-70和p-Akt蛋白表达电泳图 Figure 2 Electrophoregram of expressions of HSP-70 and p-Akt protein in brain tissue of rats in various groups |
|
|
| (n=10, x± s) | ||
| Group | p-Akt/β-actin | HSP-70/β-actin |
| Sham operation | 0.96±0.03 | 0.32±0.01 |
| Model | 0.21±0.04* | 0.14±0.03* |
| GLP | 0.72±0.06△ | 0.20±0.06 |
| GLPS | 0.83±0.05△# | 0.27±0.02△△# |
| Nimodipine | 0.9±0.07△△ | 0.30±0.02△△ |
| *P < 0.01 compared with sham operation group;△P < 0.05, △△P < 0.01 compared with model group;#P < 0.05 compared with GLP group. | ||
脑缺血再灌注损伤是指缺血脑组织在恢复血液灌注后,其功能不但未能恢复,脑组织损伤却进一步加重,其发生机制较为复杂[10]。目前关于灵芝对脑缺血再灌注损伤的保护作用已有报道,但GLPS对脑缺血再灌注损伤的影响尚未见报道。
本研究采用线栓法造成大鼠脑缺血再灌注损伤模型,硫酸酯化修饰GLP制备GLPS,观察GLPS的保护作用。大鼠神经功能缺损评分和脑含水量测定结果显示:GLP组和GLPS组大鼠神经功能缺损评分均明显降低,缺血再灌注大鼠的神经功能障碍症状改善,脑含水量降低,且GLPS组效果明显低于GLP组。氧化应激、自由基连锁反应被认为是脑缺血再灌注损伤的核心病理环节,因此抗氧化治疗及使用自由基清除剂已成为防治脑缺血再灌注损伤的重要措施[11]。本实验结果显示:GLP组和GLPS组大鼠脑组织SOD活性明显升高、MDA水平降低,且GLPS组效果明显优于GLP组,提示GLPS对脑缺血再灌注所致脂质过氧化损伤具有保护作用。NF-κB是很多信号通路(如P13K/Akt)中的下游分子并参与脑缺血损伤过程中的炎症反应[12]。脑缺血时活化的NF-κB能结合到参与炎症反应的大量基因的启动子上,如VEGF、IL-1、IL-6和TNF-α等,这些炎症因子被激活后将进一步加重神经细胞的变性和坏死,增加血脑屏障的通透性,加重脑水肿。本研究结果显示:模型组大鼠脑缺血再灌注后,脑组织中NF-κB、TNF-α、IL-1和IL-6水平明显升高,GLP组和GLPS组大鼠脑组织NF-κB、TNF-α、IL-1和IL-6水平明显低于模型组,且GLPS组效果明显优于GLP组,提示GLP和GLPS能够降低炎性细胞因子的水平,有效抑制脑缺血再灌注后继发的炎症反应,对神经细胞具有保护作用,且GLPS效果更好。
以上研究结果证实:GLPS对大鼠脑缺血再灌注损伤具有更好的保护作用,并能有效抑制再灌注后继发的炎症反应。因此,本文作者推测信号通路的改变可能是GLPS更好地发挥神经保护作用的原因。HSP70是细胞生长调控和抗应激损伤的重要调控蛋白[13],在脑缺血应激状态下受损细胞中的蛋白可诱导HSP70的表达。因此,HSP70高表达对脑缺血的神经具有保护作用[14]。而在调节细胞存活和抗损伤的信号转导通路中,PI3K/Akt信号转导通路的活化可阻止神经细胞调亡,保护脑组织免受大脑缺血再灌注损伤[15-16]。Akt是PI3K/Akt最重要的下游底物,p-Akt是PI3K/Akt活化的直接结果,能够作为活化的指标[17-18]。本研究结果显示:GLP组和GLPS组大鼠脑组织中p-Akt蛋白表达水平均明显升高,GLPS组大鼠脑组织HSP-70蛋白表达水平明显升高,而GLP组大鼠脑组织HSP-70蛋白表达水平升高效果不明显,提示GLPS可能通过调控HSP70/PI3K/Akt信号通路发挥更好的神经细胞保护作用。
综上所述,本研究采用大鼠脑缺血再灌注损伤模型,证明GLPS对于神经损伤的保护作用明显优于未经修饰的天然GLP,这可能与硫酸基团的引入有关,硫酸基的引入导致GLP的空间结构、电荷分布和溶解度等发生改变,从而提高了GLPS的生物活性,其保护缺血再灌注损伤作用机制可能是通过调控HSP70/PI3K/Akt信号通路,抑制再灌注后继发的炎症反应,发挥对神经细胞的保护作用。本研究结果为GLP相关药品及保健品的进一步研究开发提供了理论依据。
| [1] | Hart MW. Speciose versus species-rich[J]. Trends EcolEvol(Amst), 2008, 23(12): 660–661. DOI:10.1016/j.tree.2008.09.001 |
| [2] | Kim YS, Eo SK, Oh KW, et al. Antiherpetic activities of acidic protein bound polysacchride isolated from Ganoderma lucidum, alone and in combinations with interferons[J]. JEthnopharmacol, 2000, 72(3): 451–458. DOI:10.1016/S0378-8741(00)00263-4 |
| [3] | Yang G, Yang L, Zhuang Y, et al. Ganoderma lucidum polysaccharide exerts anti-tumor activity via MAPK pathways in HL-60 acute leukemia cells[J]. JReceptSignal Transduct Res, 2016, 36(1): 6–13. |
| [4] | 金鑫, 刘宗敏, 黄羽佳, 等. 我国灵芝栽培现状及发展趋势[J]. 食药用菌, 2016(1): 33–37. |
| [5] | Soares AR, Robaina MCS, Mendes GS, et al. Antiviral activity of extracts from Brazilian seaweeds against herpes simplex virus[J]. RevBras Farmacogn, 2012, 22(4): 714–723. DOI:10.1590/S0102-695X2012005000061 |
| [6] | 张珏. 灵芝多糖的硫酸化修饰及其衍生物抗肿瘤活性的初步研究[D]. 无锡: 江南大学, 2005. http://cdmd.cnki.com.cn/article/cdmd-10295-2005104903.htm |
| [7] | 陈晓庆, 郑少燕, 陈庆奇. 硫酸酯化枸杞多糖及其抗肿瘤活性研究[J]. 轻工科技, 2016(5): 22–24. |
| [8] | 幸享凤, 王恬竹, 秦新月. CRMP2可通过改善神经细胞凋亡减轻缺血/再灌注大鼠神经功能缺损[J]. 中国药理学通报, 2016, 32(4): 548–553. |
| [9] | Sutherland BA, Neuhaus AA, Couch Y, et al. The transient intraluminal filament middle cerebral artery occlusion model as a model of endovascular thrombectomy in stroke[J]. JCerebBlood FlowMetab, 2016, 36(2): 363–369. |
| [10] | 姜恩平, 唐泽立, 于春艳, 等. 五味子乙素对大鼠脑缺血再灌注损伤的保护作用及其机制[J]. 吉林大学学报:医学版, 2016, 42(5): 860–865. |
| [11] | 洪森荣, 尹明华. 银杏叶提取物对缺血再灌注小鼠脑细胞凋亡的保护作用[J]. 中草药, 2007, 38(12): 1864–1867. DOI:10.3321/j.issn:0253-2670.2007.12.035 |
| [12] | 赵秀芹, 邓春颖, 李世英, 等. 丁苯酞注射液对大鼠局灶性脑缺血再灌注损伤的神经保护作用[J]. 山东大学学报:医学版, 2016, 54(4): 25–31. |
| [13] | Eroglu B, Kimbler DE, Pang J, et al. Therapeutic inducers of the HSP70/HSP110 protect mice against traumatic brain injury[J]. JNeurochem, 2014, 130(5): 626–641. DOI:10.1111/jnc.2014.130.issue-5 |
| [14] | Booth L, Shuch B, Albers T, et al. Multi-kinase inhibitors can associate with heat shock proteins through their NH2-termini by which they suppress chaperone function[J]. Oncotarget, 2016, 7(11): 12975–12996. DOI:10.18632/oncotarget.v7i11 |
| [15] | Brunet A, Datta SR, Greenberg ME. Transcription-dependent and-independent control of neuronal survival by the PI3K-Akt signaling pathway[J]. CurrOpinNeurobiol, 2001, 11(3): 297–305. |
| [16] | Elkaim E, Neven B, Bruneau J, et al. Clinical and immunologic phenotype associated with activated phosphoinositide 3-kinase δ syndrome 2:A cohort study[J]. J Allergy Clin Immunol, 2016, 138(1): 210–218, e9. DOI:10.1016/j.jaci.2016.03.022 |
| [17] | Dal-Cim T, Molz S, Egea J, et al. Guanosine protects human neuroblastoma SH-SY5Y cells against mitochondrial oxidative stress by inducing heme oxigenase-1 via PI3K/Akt/GSK-3β pathway[J]. NeurochemInt, 2012, 61(3): 397–404. |
| [18] | Ikeyama S, Kusumoto K, Miyake H, et al. A non-toxic heat shock protein 70 inducer, geranylgeranylacetone, suppresses apoptosis of cultured rat hepatocytes caused by hydrogen peroxide and ethanol[J]. JHepatol, 2001, 35(1): 53–61. DOI:10.1016/S0168-8278(01)00053-8 |
 2017, Vol. 43
2017, Vol. 43


