扩展功能
文章信息
- 徐兵, 李海乐, 刘丹平, 张凤蔚
- XU Bing, LI Haile, LIU Danping, ZHANG Fengwei
- 骨髓源内皮祖细胞分泌的外泌体对大鼠创伤性皮肤缺损修复的促进作用
- Promotion of exosomes derived frombone-marrow endothelial progenitor cellsin repairing traumatic cutaneous deficiency in rats
- 吉林大学学报(医学版), 2017, 43(04): 672-678
- Journal of Jilin University (Medicine Edition), 2017, 43(04): 672-678
- 10.13481/j.1671-587x.20170402
-
文章历史
- 收稿日期: 2016-10-21
2. 辽宁省抚顺市第二医院烧伤整形外科, 辽宁 抚顺 113001
2. Department of Burn and Plastic Surgery, Second Hospital of Fushun City, Liaoning Province, Fushun 113001, China
皮肤作为人体的一个保护性器官,常因受到急性或慢性损伤而导致缺损。创伤性皮缺损的愈合与血管的新生及胶原的合成有密切关系[1-2]。近年来,细胞移植疗法在促进皮肤创伤愈合方面显示出巨大的前景。多项研究[3-5]表明:内皮祖细胞(endothelial progenitor cells,EPCs)可以应用到多种组织的修复中,如心血管病、糖尿病性眼病和肺动脉高压等。文献[6]报道:在小鼠的切割性皮肤缺损区局部注射骨髓源EPCs可以明显加快肉芽组织中新生血管的形成。然而EPCs整合为新生血管的效率较低[7],最新的研究[8]显示:来源于干细胞外泌体(exosomes, Exos)包含多种蛋白质、信使核糖核酸(messenger ribonucleic acid,mRNA)及微小核糖核酸(micro-ribonucleic acid,miRNA)等,在促进血管生成方面有明显效果,且使用干细胞分泌的Exos刺激固有内皮细胞的成血管功能比单纯移植干细胞有更好的效果。骨髓源内皮祖细胞分泌的外泌体(exosomes derived from bone-marrow endothelial progenitor cells,EPCs-Exos)对大鼠创伤性皮缺损修复的促进作用尚未见相关文献报道。本研究通过体外观察EPCs-Exos对于人脐静脉内皮细胞(human umbilical vein endothelial cells,HUEVCs)在迁移、成管和成血管相关基因血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)表达方面的促进作用,以及在体实验中通过观察伤口的愈合速度、胶原的沉积以及微血管的新生,评估EPCs-Exos对大鼠皮损愈合的促进作用。
1 材料与方法 1.1 实验动物、主要试剂和仪器雄性SD大鼠8只,SPF级,4~5周龄,体质量80~100g,用于制备EPCs;雄性SD大鼠42只,SPF级,7~9周龄,体质量200~250g,用于动物实验。所有大鼠均由锦州医科大学SPF级实验动物中心提供,动物合格证号:SCXK(辽)2014-0004,在光照和黑暗每12h交替环境中标准饲养,所有实验大鼠符合卫生部一级动物标准,经动物伦理学委员会批准。α-MEM培养基、EGM-2 MV培养基和胎牛血清(FBS)(美国Gibco公司),F12-DMEM培养基和D-Hanks液(美国GE公司),Ficoll液(天津市灏洋生物制品科技有限责任公司),DiL-ac-LDL和FITC-UEA-I(美国Sigma公司),BCA蛋白定量试剂盒和ECL显影液(上海碧云天生物技术公司),Matrigel基质胶(美国BD公司),小鼠抗大鼠VEGFA抗体、小鼠抗β-actin抗体、兔抗大鼠-CD31抗体和Alexa-Fluor 488-结合羊抗兔抗体(英国Abcam公司),Masson三色染色试剂盒(北京索莱宝生物公司)。H-7650透射电镜和超高速离心机(日本HITACHI公司),倒置荧光显微镜(日本Olympus公司)。
1.2 EPCs的培养和鉴定参照相关文献[9],EPCs提取步骤如下:将8只幼年大鼠处死,消毒后转移入超净台内。分离大鼠股骨和胫骨,无菌D-Hank’s液冲洗骨髓腔,得到10mL混合液。将获得的骨髓液等比例轻轻加于Ficoll液之上,室温下400g离心10 min,吸取单核细胞层。用D-Hank’s液清洗2次,α-MEM完全培养基(含10%FBS、100U·mL-1青霉素、100 U·mL-1链霉素)重悬,调整细胞密度至5×106 mL-1,接种于细胞培养皿中置于细胞培养箱中培养,24h后将悬浮细胞抽出置于离心管中100g离心,弃上清,EGM-2 MV完全培养基将细胞悬起,接种于纤维连接蛋白铺被的细胞培养皿中,37℃、5%CO2恒温培养箱培养。3d后首次换液,去除非贴壁细胞并加入新鲜完全培养基,3d换液1次,继续培养至14d,细胞融合达80%~90%。培养的骨髓源EPCs按照以下步骤鉴定:于培养后14d在倒置显微镜下观察细胞形态;将培养至14 d的细胞分别与DiL-ac-LDL(15 mg·L-1)和FITC-UEA-I(10 mg·L-1)室温避光孵育,倒置荧光显微镜下观察贴壁被DiL-ac-LDL和FITC-UEA-I双染的梭型细胞;免疫荧光检测贴壁EPCs表面蛋白CD31的表达。
1.3 骨髓源EPCs-Exos分离和鉴定待EPCs生长融合至80%,弃掉原培养基,加入无血清培养基继续培养24 h。获取培养液上清,利用超高速离心机在4℃环境下以300 g离心10 min,取上清,再以2 000 g离心10 min以去除死细胞及细胞碎片。取上清,0.22 μm无菌滤器滤过以进一步去除细胞碎片。将滤过液在4℃环境下以100 000 g离心2h,弃上清,并以PBS重悬沉淀物,-80℃冻存备用。采用BCA蛋白定量试剂盒检测EPCs-Exos蛋白含量,透射电镜观察EPCs-Exos形态特征, Western blotting法检测外泌体特异性表面蛋白CD9和CD81的表达。
1.4 荧光显微镜观察HUVECs在体外摄取骨髓源EPCs-ExosHUEVCs购于上海ATCC细胞库,用F12-DMEM完全培养基(含10%FBS+100 U·mL-1青霉素+100 U·mL-1链霉素)培养。参照文献[10],HUVECs在体外摄取骨髓源EPCs-Exos步骤如下:EPCs生长融合至约90%,在恒温孵箱中用DiO染色15 min,弃上清,并以PBS冲洗后加入EGM-2 MV无血清培养基,37℃、5%CO2恒温培养箱培养24h,收集上清并分离提纯DiO标记的EPCs-Exos。将提纯的DiO标记的EPCs-Exos用适量F12-DMEM完全培养基悬起后与HUVEs共孵育2h,以PBS冲洗细胞后4%多聚甲醛固定,DAPI染核,PBS再次冲洗后置于倒置荧光显微镜下观察HUVECs摄取骨髓源EPCs-Exo形态。
1.5 细胞划痕实验和成管实验细胞划痕实验用于评估EPCs-Exos对于HUVECs迁移的影响。将HUVECs以5×104 mL-1接种于6孔板,待细胞融合至95%以上时,取1mL移液枪头进行划痕。用PBS冲洗3次以去除脱壁细胞,去PBS后每孔分别加入PBS和含有50、100和150 mg·L-1EPCs-Exos的无血清F12-DMEM完全培养基,分别为PBS组、50 mg·L-1EPCs-Exos组、100 mg·L-1EPCs-Exos组和150 mg·L-1EPCs-Exos组,于0和12h在倒置荧光显微镜下观察划痕变化。细胞迁移率=(0h划痕的平均边距-12h划痕的平均边距)/0h划痕的平均边距×100%。参照文献[11],毛细血管网的形成可用成管实验进行评估,HUVECs成管情况评估步骤如下:将HUVEs密度调整至1×105 mL-1,抽取1 mL细胞悬液接种于铺被Matrigel基质胶的12孔板中,待细胞贴壁加入含有50、100和150 mg·L-1 EPCs-Exos和等量PBS的F12-DMEM完全培养基,37℃、5%CO2恒温培养,并分别于4和8 h在倒置显微镜下观察成管情况。选取5个随机视野中分支点数作为成管的效果指标。
1.6 Western blotting法检测HUVECs中VEGFA表达水平HUVECs生长融合至90%,分为PBS组(每盘加入200 μL PBS)、50 mg·L-1 EPCs-Exos组(加入200 μLEPCs-Exos,使其终浓度为50mg·L-1)、100 mg·L-1 EPCs-Exos组(加入等量EPCs-Exo,使其终浓度为100mg·L-1)和150 mg·L-1 EPCs-Exos组(加入等量EPCs-Exo,使其终浓度为150mg·L-1),24 h后收集细胞,加入裂解液后提取细胞总蛋白,4℃、12 000r·min-1离心15 min去除细胞碎片,取上清,以BCA法蛋白定量。SDS-PAGE凝胶分离细胞蛋白,并转至PVDF膜,以5%BSA封闭1 h后,与小鼠抗大鼠VEGFA抗体(1:1000)、小鼠抗-β-actin(1:2000)4℃孵育过夜。次日以TBS-T清洗后与HPR偶联的山羊抗小鼠抗体室温孵育2h后,再次以TBS-T清洗,之后将条带置于Bio-Rad发光显影仪中加入超敏ECL发光显影液进行观察。所得结果采用Image-J进行分析,计算HUVECs中VEGFA表达水平。
1.7 大鼠皮缺损模型的建立和皮肤缺损疤痕愈合评估将32只平均质量200~250g雄性SD大鼠以50mg·kg-1苯巴比妥静脉麻醉,在其背部剪切出直径为2cm的圆形缺损,切口深度到达深筋膜。将所有SD大鼠随机分为PBS组(注射PBS)和50、100、150mg·L-1 EPCs-Exos组(分别注射50、100和150 mg·L-1 EPCs-Exos),将各组400 μL等体积液体分别注射至伤口周围呈“十”字的4个不同位点。EPCs-Exos注射后,分别在0、3、7和14d测量各组大鼠皮缺损疤痕直径,其疤痕愈合度(%)=(0d大鼠皮缺损疤痕直径-其他时间大鼠皮缺损疤痕直径)/0d大鼠皮缺损疤痕直径×100。
1.8 皮肤缺损愈合的组织学分析处死各组SD大鼠后,将其皮肤从缺损处切下,置于10%中性甲醛中固定,再以不同浓度酒精进行梯度脱水后石蜡包埋,随后将其切片,厚度为4 μm。采用Masson三色染色试剂盒染色后,在光镜下观察其伤口愈合区胶原成熟程度。
1.9 免疫荧光染色评估皮肤缺损处血管新生EPCs-Exos诱导的血管新生过程中,可通过血管内皮细胞表面抗体CD31的免疫荧光染色进行评估。首先,将切下的缺损处皮肤以4%多聚甲醛固定,并以30%蔗糖溶液脱水后OCT包埋,垂直切片,厚度为4 μm。组织切片在常温下用1%BSA封闭30 min,以兔抗大鼠CD31(1:200) 为一抗4℃孵育过夜,以二抗Alexa-Fluor 488-结合羊抗兔抗体(1:200) 室温避光孵育1h,再以DAPI复染5 min,置于荧光显微镜下观察。CD31染色阳性标记血管形成,以每个切片中5个随机视野中血管密度的平均值表示EPCs-Exos的修复效果。
1.10 统计学分析采用SPSS19.0统计软件进行统计学分析。在体实验大鼠皮肤缺损的愈合度、体外实验划痕愈合度、成管分支数和VEGFA表达水平均以x± s表示,组间比较采用单因素方差分析,两两比较采用t检验。所有体外实验均重复3次。以P < 0.05为差异有统计学意义。
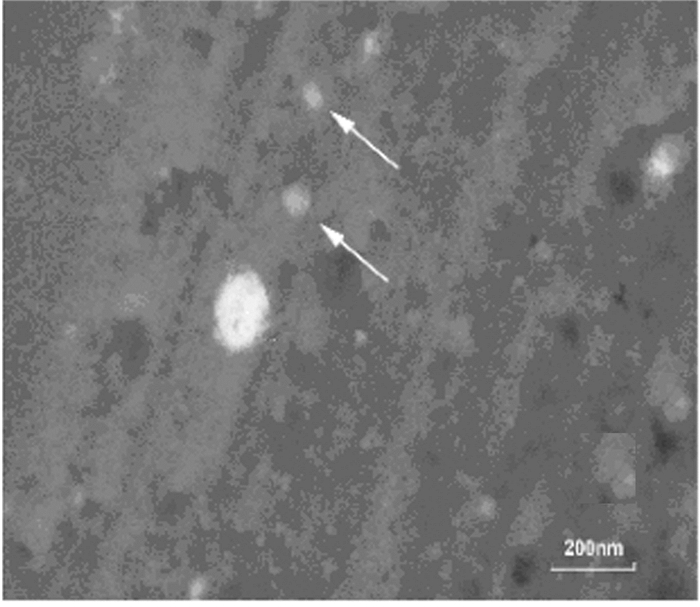
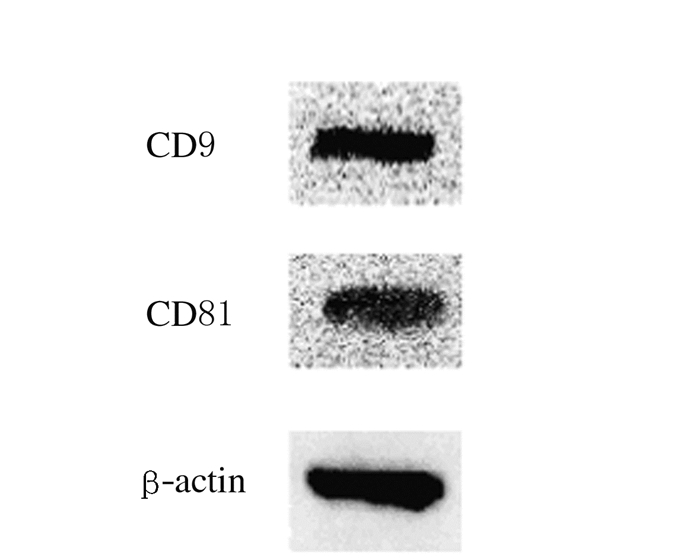
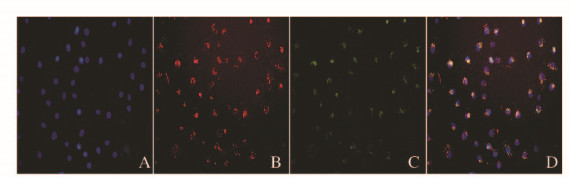
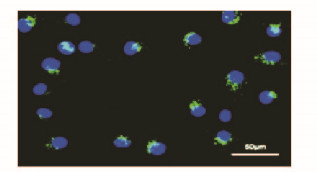
2 结果 2.1 EPCs和EPCs-Exos的鉴定倒置显微镜下观察:EPCs培养至14d,呈现“铺路石”样外观(图 1A,见插页一)。免疫荧光检测:EPCs中内皮细胞系表面蛋白CD31表达为阳性(图 1B,见插页一)。透射电镜下观察:分离和提纯的EPCs-Exos形态大多为杯形或圆形结构(图 2)。Western blotting结果显示:EPCs-Exos表达特异性的外泌体表面蛋白CD9和CD81 (图 3)。荧光显微镜下观察:FITC标记的UEA-1为绿色荧光,DiL标记的ac-LDL为红色荧光,双荧光阳性细胞即为EPCs细胞(图 4,见插页一)。激光共聚焦显微镜下观察:DiO标记的EPCs-Exos被HUVECs摄取,且其主要集中在细胞核附近(图 5,见插页一)。

|
| A:Morphology of EPCs under light microscope (×100); B:CD31 labelled immunofluorescence of EPCs(×200). 图 1 EPCs的鉴定结果 Figure 1 Identification of EPCs |
|
|
|
| 图 2 EPCs-Exos电镜观察结果(bar=200 μm) Figure 2 Morphology of EPCs-Exos under transmission electron microscope (bar=200 μm) |
|
|
|
| 图 3 Western blotting法检测EPCs-Exos中CD9和CD81表达电泳图 Figure 3 Electrophoregram of expressions of CD9 and CD81 in EPCs-Exos detected by Western blotting method |
|
|
|
| A:DAPI; B:DiL-ac-LDL; C:FITC-UEA-I; D:Merge 图 4 EPCs的Dil-ac-LDL和FITC-UEA-I双染(×200) Figure 4 Double-staining of Dil-ac-LDL and FITC-UEA-I of EPCs(×200)) |
|
|
|
| 图 5 EPCs-Exos激光共聚焦显微镜下观察结果(×400) Figure 5 Observation results of EPCs-Exos under laser confocal scanning microscope(×400) |
|
|
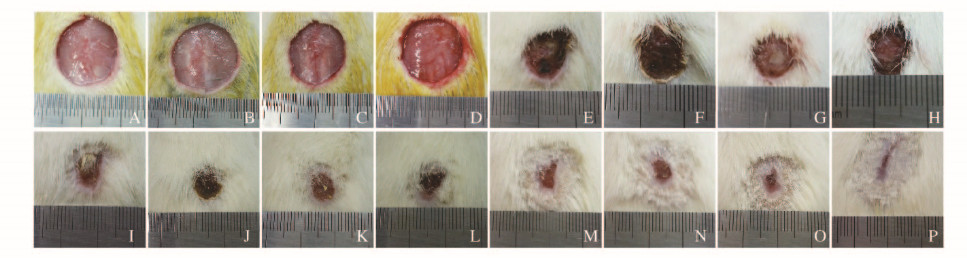
在4组大鼠创伤性皮缺损模型中,随EPCs-Exos注射剂量的增加,皮肤缺损疤痕直径逐渐减小(图 6,见插页一),且在3、7和14d 3个时间点,皮肤疤痕愈合度逐渐增加,组间比较差异有统计学意义(P<0.05)。见表 1。伤口区域组织Masson三色染色:EPCs-Exos可以剂量依赖性促进新生皮肤的胶原成熟(图 7A~D, 见插页一);同时,CD31免疫荧光血管标记实验在镜下随机视野观察:EPCs-Exos可以剂量依赖性促进缺损皮肤的血管新生,150mg·L-1EPCs-Exos组大鼠皮肤缺损区组织中血管密度较其他各组明显增加(图 7E ~H ,见插页一),各组大鼠皮肤疤痕组织中CD31标记的血管密度差异有统计学意义(P<0.05)。见表 2。
|
| 图 6 各组大鼠皮肤缺损愈合的大体表现 Figure 6 Macroscopic appearances of cutaneous deficiency healing of rats in various groups |
|
|

|
| A-D:Masson's trichrome staining; E-H: CD31 labelled immunofluorescence; A, E:PBS group; B, F:50 mg·L-1 EPCs-Exos group; C, G:100 mg·L-1 EPCs-Exos group; D, H: 150 mg·L-1 EPCs-Exos group. 图 7 各组大鼠皮肤缺损区组织Masson三色染色和CD31标记的免疫荧光染色(×40) Figure 7 Masson's trichrome staining and CD31 labelled immunofluorescencestaining of cutaneous deficiency tissue of rats in various groups(×40) |
|
|
| (n=8, x± s, η/%) | |||||
| Group | Healing degree | ||||
| (t/d) | 0 | 3 | 7 | 14 | |
| PBS | 0.00±0.00 | 24.63±0.62 | 42.54±0.63 | 55.34±1.08 | |
| EPCs-Exos(mg·L-1) | |||||
| 50 | 0.00±0.00 | 29.96±0.82* | 46.96±0.27* | 62.43±0.90* | |
| 100 | 0.00±0.00 | 42.74±0.50*△ | 59.83±0.82*△ | 74.59±0.81*△ | |
| 150 | 0.00±0.00 | 52.15±0.46*△# | 69.43±0.60*△# | 90.56±0.48*△# | |
| *P < 0.05 compared with PBS group; △P < 0.05 compared with 50 mg·L-1 EPCs-Exos group; #P < 0.05 compared with 100 mg·L-1 EPCs-Exos group. | |||||
| (n=8, x± s, η/%) | |
| Group | Number of vessel |
| PBS | 6.13±0.61 |
| EPCs-Exos(mg·L-1) | |
| 50 | 15.13±0.67* |
| 100 | 31.38±1.39*△ |
| 150 | 42.13±1.45*△# |
| * P < 0.05 compared with PBS group; △P < 0.05 compared with 50 mg·L-1EPCs-Exos group; #P < 0.05 compared with 100 mg·L-1 EPCs-Exos group. | |
划痕实验结果显示:EPCs-Exos可以剂量依赖性促进HUVECs的迁移,且150mg·L-1 EPCs-Exos组较其他3组效果明显,各组细胞迁移率差异有统计学意义(P<0.05)。见表 3。
| (n=3, x± s) | ||||
| Group | Migration rate(η/%) | Number of total branch(n/field) | Expression level of VEGFA | |
| PBS | 29.87±2.05 | 6.33±0.88 | 0.09±0.01 | |
| EPCs-Exos(mg·L-1) | ||||
| 50 | 60.77±2.13* | 16.33±0.88* | 0.33±0.02* | |
| 100 | 75.23±0.75*△ | 32.33±1.45*△ | 0.62±0.03*△ | |
| 150 | 84.93±1.11*△# | 41.67±1.45*△# | 0.85±0.01*△# | |
| *P < 0.05 compared with PBS group; △P < 0.05 compared with 50 mg·L-1EPCs-Exos group; #P < 0.05 compared with 100 mg·L-1 EPCs-Exos group. | ||||
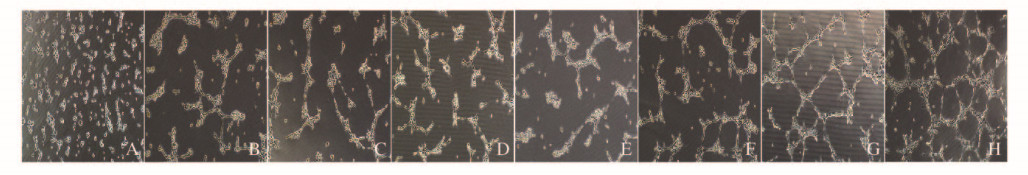
应用3D-Matrigel评估EPCs-Exos对于HUVECs成管的作用。4组HUVECs均能形成毛细血管样结构,但在PBS组中生成的管样结构较少。4h时各组成管的长度和分支数比较差异无统计学意义(P>0.05),8 h时50、100和150mg·L-1EPCs-Exos组成管数量较PBS组明显增多,150mg·L-1 EPCs-Exos组成管的长度和分支数明显高于50和100mg·L-1 EPCs-Exos组(图 8,见插页二),且差异有统计学意义(P<0.05)。见表 3。
|
| 图 8 成管实验评估EPCs-Exos对HUEVCs成管的促进作用 Figure 8 Promotion of EPCs-Exos in tube formationof HUEVCsevaluated by tubule formation assay |
|
|
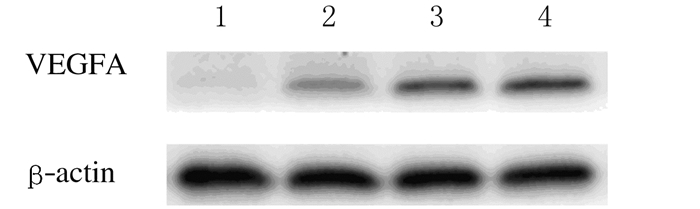
采用Western blotting法检测各组HUVECs中VEGFA表达水平(图 9)。EPCs-Exos刺激后,随着加药浓度的增加,HUVECs中VEGFA的表达呈递增趋势,其中150mg·L-1 EPCs-Exos组较其他组VEGFA表达水平明显增加,组间比较差异有统计学意义(P<0.05)。见表 3。
|
| Lane 1: PBS group; Lane 2: 50 mg·L-1 EPCs-Exos group; Lane 3:100 m g·L-1 EPCs-Exos group; Lane 4: 150 mg·L-1 EPCs-Exos group. 图 9 各组HUEVCs中VEFGA表达电泳图 Figure 9 Electrophoregram of expressions of VEGFA in HUEVCs in various groups |
|
|
皮肤创伤的修复需要多种代谢活动的协同参与,其中最重要的是细胞的增殖和分化[12]。对于创面较大的皮肤损伤,愈合过程首先从细胞的表皮化开始,继而成纤维细胞和内皮细胞开始加速增生(即肉芽组织开始形成),最终增生的肉芽组织将表皮细胞表浅化,表皮细胞完全覆盖肉芽组织后,创面形成瘢痕组织并完成创伤的愈合[13]。在皮肤创伤的修复过程中,内皮细胞和成纤维细胞的增殖和分化至关重要。目前,大面积皮肤缺损的药物治疗仍面临效果不佳的问题,因此寻找新的、能够促进缺损区成血管和胶原沉积的治疗方案尤为关键。
近年来,作为一种具有前景的治疗新药,干细胞分泌的Exos在组织再生方面具有很强的优势。其可由多种类型干细胞分泌,是一种纳米级细胞外囊泡(直径40~200nm),表面标志物包括4次跨膜蛋白超家族(CD81、CD63、CD9)、热休克蛋白(HSP70、HSP90) 和细胞骨架蛋白(肌动蛋白、微管蛋白和膜突蛋白),内部包含多种蛋白质、mRNA及miRNA等,在细胞间信息传递中起关键作用[9]。最近的研究[14]表明:EPCs促进内皮细胞的再生是通过旁分泌机制发挥作用,而不是自身分化为成熟的内皮细胞。细胞分泌的Exos在细胞微环境中作为一种介质调节血管新生,在细胞与细胞间的沟通中发挥重要作用[15]。多种类型的细胞中都可以分泌Exos,其中包括EPCs。Exos从EPCs分泌后,通过内含的蛋白质、mRNA和miRNA调节血管新生的微环境。研究[16]显示:EPCs-Exos表面不表达人白细胞抗原Ⅰ(HLA-Ⅰ)和人白细胞抗原Ⅱ(HLA-Ⅱ),故在本实验中不存在明显的排异反应现象。因此对于皮肤大面积创伤的患者,由于失血过多造成其外周血或者骨髓造血功能相对不足,可以借助捐献者的骨髓提取EPCs-Exos,这也为临床治疗创伤性大面积皮肤缺损带来希望[17]。Exos在组织修复领域的广泛应用也不存在诸如干细胞移植出现的分化不良和致畸性等潜在问题。实际上,近年来以Exos为治疗手段的应用在多种疾病模型的治疗中已取得显著的疗效,如心肌的缺血再灌注损伤的修复,急性肺损伤的保护以及肝纤维化的缓解等方面[18-20]。Zhang等[11]证实:多能干细胞来源的间充质干细胞分泌的外泌体(human induced pluripotent stem cell-derived mesenchymal stem cells,hiPSC-MSCs)可以加快皮肤缺损的修复,缩小伤口的范围,同时还能促进内皮细胞和皮肤成纤维细胞的增殖、迁移。在本研究中,EPCs-Exos明显促进了皮肤缺损的上皮化和胶原的沉积,且初期胶原纤维镜下排列整齐,EPCs-Exos不仅促进了血管的新生,而且加快了伤口皮肤的成熟。
相关研究[21]证实:骨髓间充质干细胞来源的外泌体(bone-marrow mesenchymal stem cells derived exosomes,BMSCs-Exos)可以明显加快HUVECs的增殖、迁移和成管。同样,本研究结果显示:EPCs-Exos作用HUVECs后,其细胞迁移速率和血管形成数目都随着EPCs-Exos浓度递增而明显增加,且HUVECs中VEGFA表达水平也表现出浓度依赖性。目前,干细胞移植治疗皮肤缺损的相关报道较多,且已取得显著疗效[22],但针对EPCs-Exos在创伤修复方面的研究还鲜有报道。EPCs-Exos为治疗创伤性皮肤缺损带来新的希望,也为克服干细胞移植所带来的障碍和风险提供一定的线索。
综上所述,本研究证实了EPCs-Exos可以增强内皮细胞的功能,加快大鼠创伤性皮缺损修复,为临床大面积创伤性皮肤缺损的治疗提供了新的思路。
| [1] | DiPietro LA. Angiogenesis and wound repair:when enough is enough[J]. J LeukocBiol, 2016, 100(5): 979–984. |
| [2] | Campos AC, Groth AK, Branco AB. Assessment and nutritional aspects of wound healing[J]. CurrOpinClinNutrMetab Care, 2008, 11(3): 281–288. |
| [3] | Chao TH, Chen IC, Lee CH, et al. Cilostazol enhances mobilization of circulating endothelial progenitorcells and improves endothelium-dependent function in patients at high risk of cardiovascular disease[J]. Angiology, 2016, 67(7): 638–646. DOI:10.1177/0003319715606249 |
| [4] | Kramerov AA, Ljubimov AV. Stem cell therapies in the treatment of diabetic retinopathy and keratopathy[J]. ExpBiol Med (Maywood), 2016, 241(6): 559–568. DOI:10.1177/1535370215609692 |
| [5] | 吕民, 陈丽波, 赵冬梅. 自体血管内皮祖细胞移植治疗高肺血流量肺动脉高压[J]. 中华实验外科杂志, 2015, 32(2): 370–373. |
| [6] | Suh W, Kim KL, Kim JM, et al. Transplantation of endothelial progenitor cells accelerates dermal wound healing with increased recruitment of monocytes/macrophages and neovascularization[J]. Stem Cells, 2005, 23(10): 1571–1578. DOI:10.1634/stemcells.2004-0340 |
| [7] | Hagensen MK, Raarup MK, Mortensen MB, et al. Circulating endothelial progenitor cells do not contribute to regeneration of endothelium after murine arterial injury[J]. Cardiovasc Res, 2012, 93(2): 223–231. DOI:10.1093/cvr/cvr278 |
| [8] | Mitchell A, Fujisawa T, Newby D, et al. Vascular injury and repair:a potential target for cell therapies[J]. Future Cardiol, 2015, 11(1): 45–60. DOI:10.2217/fca.14.77 |
| [9] | 辛毅, 刘小希, 赵伟, 等. 差速贴壁法分离兔骨髓源性间充质干细胞和内皮祖细胞及其生物学特性的研究[J]. 中国实验血液学杂志, 2013, 21(3): 746–753. |
| [10] | Li X, Jiang C, Zhao J. Human endothelial progenitor cells-derived exosomes accelerate cutaneous wound healing in diabetic rats by promoting endothelial function[J]. J Diabetes Complicat, 2016, 30(6): 986–992. DOI:10.1016/j.jdiacomp.2016.05.009 |
| [11] | Zhang J, Guan J, Niu X, et al. Exosomes released from human induced pluripotent stem cells-derived MSCs facilitate cutaneous wound healing by promoting collagen synthesis and angiogenesis[J]. JTranslMed, 2015, 13(1): 49. |
| [12] | Ti D, Li M, Fu X, et al. Causes and consequences of epigenetic regulation in wound healing[J]. Wound Repair Regen, 2014, 22(3): 305–312. DOI:10.1111/wrr.12160 |
| [13] | Reinke JM, Sorg H. Wound repair and regeneration[J]. EurSurg Res, 2012, 49(1): 35–43. |
| [14] | 张娟, 史晋叔, 李剑. 间充质干细胞源性外泌体——未来生物疗法的理想载体[J]. 中国实验血液学杂志, 2015, 23(4): 1179–1183. |
| [15] | Baker CD, Seedorf GJ, Wisniewski BL, et al. Endothelial colony-forming cell conditioned media promote angiogenesis in vitro and prevent pulmonary hypertension in experimental bronchopulmonary dysplasia[J]. Am J Physiol Lung Cell MolPhysiol, 2013, 305(1): L73–L81. DOI:10.1152/ajplung.00400.2012 |
| [16] | Ingram DA, Mead LE, Tanaka H, et al. Identification of a novel hierarchy of endothelial progenitor cells using human peripheral and umbilical cord blood[J]. Blood, 2004, 104(9): 2752–2760. DOI:10.1182/blood-2004-04-1396 |
| [17] | Cantaluppi V, Gatti S, Medica D, et al. Microvesicles derived from endothelial progenitor cells protect the kidney from ischemia-reperfusion injury by microRNA-dependent reprogramming of resident renal cells[J]. Kidney Int, 2012, 82(4): 412–427. DOI:10.1038/ki.2012.105 |
| [18] | Kang K, Ma RL, CaiWF, et al. Exosomes secreted from CXCR4 overexpressing mesenchymal stem cells promote cardioprotection via Akt signaling pathway following myocardial infarction[J]. Stem Cells Int, 2015, 2015: 1–14. |
| [19] | 陈洁. 间充质干细胞外泌体对急性肺损伤小鼠的影响及相关机制的实验研究[D]. 北京: 中国人民解放军总医院, 2015. http://d.wanfangdata.com.cn/Thesis/Y2856333 |
| [20] | Li T, Yan Y, Wang B, et al. Exosomes derived from human umbilical cord mesenchymal stem cells alleviate liver fibrosis[J]. Stem Cells Dev, 2013, 22(6): 845–854. DOI:10.1089/scd.2012.0395 |
| [21] | Bian S, Zhang L, Duan L, et al. Extracellular vesicles derived from human bone marrow mesenchymal stem cells promote angiogenesis in a rat myocardial infarction model[J]. J Mol Med, 2014, 92(4): 387–397. DOI:10.1007/s00109-013-1110-5 |
| [22] | McFarlin K, Gao X, Liu YB, et al. Bone marrow-derived mesenchymal stromal cells accelerate wound healing in the rat[J]. Wound Repair Regen, 2006, 14(4): 471–478. DOI:10.1111/wrr.2006.14.issue-4 |
 2017, Vol. 43
2017, Vol. 43


