扩展功能
文章信息
- 唐琪, 王丹丹, 布文奂, 李杏, 王璐, 孟琳, 孙宏晨
- TANG Qi, WANG Dandan, BU Wenhuan, LI Xing, WANG Lu, MENG Lin, SUN Hongchen
- 维生素C碳点对口腔鳞状细胞癌KB细胞增殖、自噬和凋亡的影响
- Influence of vitamin C carbon dots in proliferation, autophagy and apoptosis of oral squamous cell carcinoma KB cells
- 吉林大学学报(医学版), 2017, 43(04): 667-671
- Journal of Jilin University (Medicine Edition), 2017, 43(04): 667-671
- 10.13481/j.1671-587x.20170401
-
文章历史
- 收稿日期: 2016-12-06
口腔黏膜鳞状细胞癌(口腔鳞癌)是口腔颌面部最常见的恶性肿瘤之一,严重威胁着人类的生命与健康。化疗是治疗口腔鳞癌的重要手段,而纳米材料作为药物/基因载体改善了化疗的效果,被广泛应用于肿瘤治疗中。近年研究[1-3]显示:除作为载体外,纳米材料也能够诱导肿瘤细胞发生自噬或凋亡,从而有效地杀伤肿瘤细胞。碳点是近年来新兴的碳纳米材料,具有稳定的化学性能、良好的生物相容性和独特的发光性能等,这些特性使碳点在肿瘤成像和肿瘤化疗等诊治领域中的应用越来越广泛[4],但碳点对肿瘤细胞的直接作用尤其是杀伤作用研究甚少。研究[5-6]显示:维生素C能够促进过氧化氢的产生从而抑制肿瘤细胞的生长,而过氧化氢又能够诱导肿瘤细胞发生自噬及凋亡,最终杀伤肿瘤细胞。本研究以维生素C为原料合成维生素C碳点,旨在通过研究维生素C碳点对口腔鳞癌KB细胞增殖、自噬和凋亡的影响,探讨其对KB细胞的杀伤作用,为维生素C碳点在口腔鳞癌治疗中的应用提供依据。
1 材料与方法 1.1 细胞、主要材料和仪器人口腔鳞癌KB细胞株(南京凯基生物科技发展有限公司)。RPMI-1640细胞培养基和胎牛血清(美国Gibco公司),胰蛋白酶、维生素C和聚乙烯亚胺(polyethyleneimine,PEI,相对分子质量25000)(美国Sigma公司),Anti-LC3B和Anti-beta Actin抗体(美国Abcam公司),二抗(美国Proteintech公司)。酶标仪(美国Bio-TEK公司),CO2恒温细胞培养箱(日本SANYO公司),荧光倒置显微镜(日本Olympus公司),流式细胞分析仪(美国BDBiosciences公司)。
1.2 维生素C碳点的合成和表征将维生素C粉末和相对分子质量为25000的PEI以2:1的比例溶于适量磷酸盐缓冲液(phosphate buffer saline,PBS)中,超声震荡混匀后将混合液放入微波炉中,700 W微波加热5 min。待冷却至室温后,加入适量去离子水溶解所得产物。将所得液体离心后弃去沉淀,用孔径为0.22 μm的膜过滤剩余液体。最后将滤过的液体装入相对分子质量为3500的透析袋,去离子水中透析7 d,每日换水1~2次。7 d后将透析后的液体冻干备用。将冻干的维生素C碳点溶于PBS并抽滤备用。利用透射电子显微镜观测碳点的尺寸和形貌,动态光散射(DLS)分析碳点的水合粒径和电势。
1.3 细胞培养将KB细胞培养于含有10%胎牛血清、100 U·mL-1青霉素和100 mg·L-1链霉素的RPMI-1640培养基中,在37 ℃、5% CO2的恒温孵育箱中孵育,每2d换液1次,细胞融合达80%~90%时,用0.25%胰蛋白酶消化传代。
1.4 MTT法检测细胞增殖率将KB细胞以4×103个/孔接于96孔板,细胞贴壁24 h后,加入浓度分别为0(空白对照组)、5、10、20、40和80 mg·L-1维生素C碳点,维生素C碳点与KB细胞共培养24 h后,加入20 μL MTT液(5 g·L-1),孵箱中孵育4 h后小心吸出所有上清液,加入150 μL DMSO孵育10 min,用酶标仪在490 nm波长处测定各孔的吸光度(A)值。按照以下公式计算细胞增殖率:细胞增殖率=实验组A值/空白对照组A值×100%。
1.5 平板克隆实验检测KB细胞克隆形成能力将KB细胞以200个/孔接于6孔板,细胞贴壁24 h后,加入浓度分别为0(空白对照组)、5、10、20、40和80 mg·L-1维生素C碳点,维生素C碳点与KB细胞共培养24 h后,更换新鲜培养基孵育10 d,弃去培养基后用PBS轻柔冲洗2次,加入无水乙醇4 ℃下固定10 min后,用PBS轻柔冲洗2次,每孔加入0.5%结晶紫溶液1 mL,于室温下染色20 min,将结晶紫溶液吸出,用PBS轻柔冲洗各孔,晾干,显微镜下观察各处理组内的全部细胞团,将含有50个以上细胞的细胞团计为一个细胞克隆,计数各处理组内的细胞克隆总数并进行比较。
1.6 Western blotting法检测自噬相关蛋白LC3蛋白表达水平将KB细胞以2×105个/孔接于6孔板,细胞贴壁24 h后,加入浓度分别为0(空白对照组)、5、10、20、40和80 mg·L-1维生素C碳点,维生素C碳点与KB细胞共培养24 h后,收集总蛋白。每孔上样25 μg蛋白,进行12 % SDS-PAGE电泳。转膜后,5%脱脂奶粉室温封闭1 h,加入一抗4 ℃孵育过夜,LC3B稀释浓度为1:500,β-Actin稀释浓度为1:5 000。TBST洗膜后,二抗室温孵育1 h,稀释浓度为1:5 000。TBST洗膜后,加底物发光显影。采用Image J软件进行灰度值分析。蛋白表达水平以灰度值表示,按照下列公式计算蛋白表达水平。蛋白表达水平=每个样本条带灰度值/β-Actin灰度值。
1.7 流式细胞术检测KB细胞凋亡率取生长状态良好的KB细胞接种于6孔板,0 mg·L-1维生素C碳点组为空白对照组,40 mg·L-1维生素C碳点组为实验组。将维生素C碳点与KB细胞共培养24 h后,胰酶消化收集细胞,用冷PBS洗涤细胞2次,用1×Binding Buffer100 μL重悬细胞,加入Annexin V-FITC5 μL和PI(100 mg·L-1)1 μL,于室温下避光共染15 min,用流式细胞仪检测KB细胞的凋亡率。细胞总凋亡率的计算公式:细胞凋亡率=细胞早期凋亡率+晚期凋亡率。
1.8 统计学分析采用SPSS17.0统计软件进行统计学分析。细胞增殖率、细胞克隆数、LC3蛋白表达水平和细胞凋亡率均以x± s表示,多组间样本均数比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
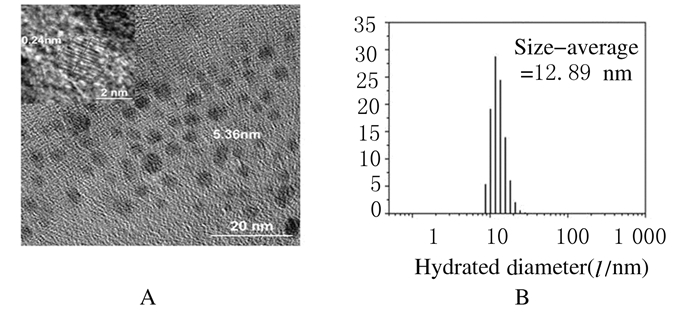
2 结果 2.1 维生素C碳点的表征透射电镜下观察所合成的维生素C碳点,合成的碳点粒子形态较规则,呈球形,粒径平均为5.36 nm,晶格大小平均为0.24 nm。DLS结果显示:维生素C碳点的水合半径为12.89 nm,电势为(8.92±0.42) mV。见图 1。
|
| A:Shape, size and crystal lattic of carbon dots; B: Hydrodynamic size of carbon dots. 图 1 维生素C碳点的表征 Figure 1 Characterization of vitamin C carbon dots |
|
|
与空白对照组比较,5和10 mg·L-1维生素C碳点组细胞增殖率虽有降低趋势,但差异无统计学意义(P>0.05); 20、40和80 mg·L-1维生素C碳点组KB细胞增殖率均明显降低(均P < 0.01)。20 mg·L-1及以上浓度的维生素C碳点均能有效杀伤KB细胞,并抑制其增殖。见表 1。
| (n=5, x± s, η/%) | |
| Group | Proliferation rate |
| Blank control | 100.00±2.18 |
| Carbon dots(mg·L-1) | |
| 5 | 96.65±3.70 |
| 10 | 87.70±5.19 |
| 20 | 64.39±4.47* |
| 40 | 61.57±3.65* |
| 80 | 34.71±0.59* |
| * P < 0.01 compared with blank control group. | |
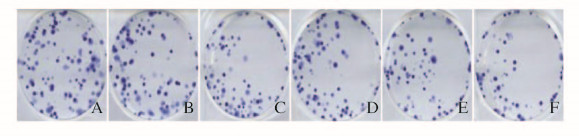
肉眼观察,与空白对照组比较,各浓度维生素C碳点组的细胞克隆数均有所减少。见图 2(插页一)。通过显微镜观察计数,与空白对照组比较,5 mg·L-1维生素C碳点组细胞克隆数明显减少(P < 0.01),当浓度达到10 mg·L-1及以上浓度时,各组细胞克隆数减少更加明显(P < 0.01)。见表 2。
|
| A: Blank control group; B-F: 5, 10, 20, 40 and 80 mg·L-1 carbon dots groups. 图 2 各组KB细胞克隆形成的扫描图片 Figure 2 Scanning pictures of colony formation of KB cells in various groups |
|
|
| (n=3, x± s) | |
| Group | Clone number |
| Blank control | 67.00±3.00 |
| Carbon dots(mg·L-1) | |
| 5 | 57.33±2.52* |
| 10 | 50.00±2.65* |
| 20 | 39.33±5.03* |
| 40 | 36.00±4.58* |
| 80 | 27.33±3.05* |
| *P < 0.01 compared with blank control group. | |
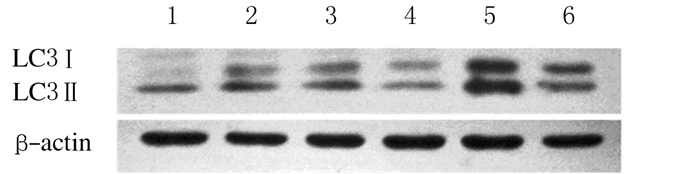
LC3蛋白通常被认为是自噬的标志物。当有自噬发生时,胞浆中的LC3Ⅰ与自噬体膜表面的磷脂酰乙醇胺(PE)结合,转化为LC3Ⅱ,因此LC3Ⅱ的水平与自噬体的数量及自噬水平呈正相关。与空白对照组(0.25±0.23) 比较,40 mg·L-1维生素C碳点组的LC3 Ⅱ蛋白表达水平(0.59±0.18) 明显升高(P < 0.05)。见图 3。
|
| Lane 1: Blank control group; Lane 2-6: 5, 10, 20, 40 and 80 mg·L-1 groups. 图 3 各组KB细胞中LC3蛋白表达电泳图 Figure 3 Electrophoregram of LC3 protein expression in KB cells in various groups |
|
|
与空白对照组(4.34%±2.52%)比较,40 mg·L-1维生素C碳点组的细胞凋亡率(39.55%±2.17%)明显增加(P < 0.01)。
3 讨论近年来,研究人员不断改进肿瘤治疗的方式以更好地对抗肿瘤,纳米技术是其中一个令人非常感兴趣的研究领域。纳米技术的应用改变了肿瘤的诊断及治疗方法,其中纳米材料作为药物运输的载体被广泛应用于肿瘤化疗,与游离药物比较,纳米载体具有防止药物降解、控制药物代谢及药物在组织中的分布等优势[7]。
研究[8-10]显示:纳米材料除作为载体外,还能抑制肿瘤细胞增殖、诱导肿瘤细胞发生凋亡,如金簇能够诱导HeLa细胞凋亡、抑制其增殖,氧化锌纳米颗粒能明显抑制人胶质母细胞瘤T98G细胞及人肝癌HepG2细胞增殖并诱导肿瘤细胞发生凋亡。本研究通过MTT法、克隆形成实验及流式细胞术,证明合成的维生素C碳点能够有效地杀伤KB细胞、抑制其增殖及克隆形成能力并促进细胞发生凋亡。与上述研究比较,本研究合成的维生素C碳点具有自发荧光的性质,有利于对生物体内碳点的分布进行示踪,在生物应用方面具有一定的优势。但本研究并未对维生素C碳点的发光特性做出分析,有待于进一步研究。
自噬是一种应激反应,通常在饥饿、缺氧、放射和化疗药物等刺激作用下被触发。自噬对于细胞内环境稳态的维持具有重要意义,此外还与肿瘤的发生发展有密切关联,并在肿瘤的化疗过程中发挥双刃剑的作用[11]。研究[12-13]显示:多种纳米材料可以使肿瘤细胞产生自噬现象,如氧化铁纳米颗粒和氧化石墨烯等。本研究为检测合成的维生素C碳点对KB细胞自噬的影响,提取总蛋白后Western blotting检测结果表明:40 mg·L-1维生素C碳点能诱导KB细胞发生自噬。已知维生素C能够促进肿瘤细胞生成过氧化氢[5],而过氧化氢又是细胞自噬的诱因之一[6],因此推测本实验合成的维生素C碳点可能是通过促进KB细胞产生过氧化氢等活性氧,从而诱导自噬的发生。下一步需要通过检测碳点处理后活性氧水平的变化,以验证上述假设。由于自噬的双刃剑作用,不同的纳米材料引起的细胞自噬对细胞的影响也不同,可能出现3种结果:① 细胞发生自噬,但自噬对细胞死亡无影响;② 自噬促进细胞死亡,纳米材料引起的自噬大多数为这种情况,如碲化镉(CdTe-COOH)量子点[14]、单壁碳纳米管(COOH-CNT) [15]和二氧化硅(SiO2)纳米颗粒[16]均能诱导肿瘤细胞发生自噬,加入自噬抑制剂3-MA后能够减弱纳米材料对肿瘤细胞增殖的抑制作用;③ 自噬促进细胞生存,这种情况占少数,称之为“保护性细胞自噬”,如与单纯次铁钒矿-二氧化钒(P-VO2)处理比较,3-MA与P-VO2共处理能明显降低HeLa细胞的存活率,表明保护性自噬的存在[17]。由此分析纳米材料诱导的自噬对细胞命运的影响可能与材料的尺寸及形貌有关。本研究合成的维生素C碳点是平均粒径为5.36nm的球形粒子,与CdTe量子点的尺寸(2~5nm)接近。碳点是由Xu等[18]在制备单壁碳纳米管过程中首次发现,并由Sun等[19]在其基础上制备出的碳纳米粒子,因此碳点与单壁碳纳米管在生物学功能上可能相似。此外,碳点与SiO2纳米颗粒形貌相近,均为球状;而P-VO2是长100nm、宽10nm的柱状材料,与碳点差距较大。因此推测维生素C碳点诱导的自噬可能起到促进肿瘤细胞死亡的作用,但仍需进一步研究。
综上所述,本研究合成的维生素C碳点能够抑制KB细胞的增殖,并能诱导其发生自噬和凋亡,但相关的分子机制有待进一步深入探讨。此外,自噬与细胞凋亡间的相互作用及其机制也尚不明确,有待于通过流式细胞术检测碳点处理后细胞内ROS水平的变化及自噬抑制剂处理对细胞凋亡率的影响,并通过Western blotting法对凋亡相关蛋白如caspase-3水平变化进行进一步研究。
| [1] | Lin YX, Gao YJ, Wang Y, et al. pH-sensitive polymeric nanoparticles with gold (Ⅰ) compound payloads synergistically induce cancer cell death through modulation of autophagy[J]. Mol Pharm, 2015, 12(8): 2869–2878. DOI:10.1021/acs.molpharmaceut.5b00060 |
| [2] | Alshatwi AA, Athinarayanan J, Vaiyapuri Subbarayan P. Green synthesis of platinum nanoparticles that induce cell death and G2/M-phase cell cycle arrest in human cervical cancer cells[J]. J Mater Sci Mater Med, 2015, 26(1): 1–9. DOI:10.1007/s10856-014-5323-0 |
| [3] | Juan J, Cheng L, Shi M, et al. Poly-(allylamine hydrochloride)-coated but not poly (acrylic acid)-coated upconversion nanoparticles induce autophagy and apoptosis in human blood cancer cells[J]. J Mater Chem B, 2015, 3(28): 5769–5776. DOI:10.1039/C5TB00646E |
| [4] | Durán N, Simões MB, de Moraes ACM, et al. Nanobiotechnology of Carbon Dots:A Review[J]. J Biomed Nanotechnol, 2016, 12(7): 1323–1347. DOI:10.1166/jbn.2016.2225 |
| [5] | Chen Q, Espey MG, Sun AY, et al. Pharmacologic doses of ascorbate act as a prooxidant and decrease growth of aggressive tumor xenografts in mice[J]. Proc Natl Acad Sci USA, 2008, 105(32): 11105–11109. DOI:10.1073/pnas.0804226105 |
| [6] | Kim AD, Kang KA, Kim HS, et al. A ginseng metabolite, compound K, induces autophagy and apoptosis via generation of reactive oxygen species and activation of JNK in human colon cancer cells[J]. Cell Death Dis, 2013, 4(8): e750. DOI:10.1038/cddis.2013.273 |
| [7] | Panzarini E, Inguscio V, Tenuzzo BA, et al. Nanomaterials and autophagy:new insights in cancer treatment[J]. Cancers(Basel), 2013, 5(1): 296–319. |
| [8] | Liu R, Wang Y, Yuan Q, et al. The Au clusters induce tumor cell apoptosis via specifically targeting thioredoxin reductase 1(TrxR1) and suppressing its activity[J]. Chem Commun(Camb), 2014, 50(73): 10687–10690. DOI:10.1039/C4CC03320E |
| [9] | Wahab R, Kaushik NK, Kaushik N, et al. ZnO nanoparticles induces cell death in malignant human T98G gliomas, KB and non-malignant HEK cells[J]. J Biomed Nanotechnol, 2013, 9(7): 1181–1189. DOI:10.1166/jbn.2013.1652 |
| [10] | Wahab R, Siddiqui MA, Saquib Q, et al. ZnO nanoparticles induced oxidative stress and apoptosis in HepG2 and MCF-7 cancer cells and their antibacterial activity[J]. Colloids Sur Biointerfaces, 2014, 117: 267–276. DOI:10.1016/j.colsurfb.2014.02.038 |
| [11] | White E, DiPaola RS. The double-edged sword of autophagy modulation in cancer[J]. Clin Cancer Res, 2009, 15(17): 5308–5316. DOI:10.1158/1078-0432.CCR-07-5023 |
| [12] | Khan MI, Mohammad A, Patil G, et al. Induction of ROS, mitochondrial damage and autophagy in lung epithelial cancer cells by iron oxide nanoparticles[J]. Biomaterials, 2012, 33(5): 1477–1488. DOI:10.1016/j.biomaterials.2011.10.080 |
| [13] | Chen GY, Meng CL, Lin KC, et al. Graphene oxide as a chemosensitizer:diverted autophagic flux, enhanced nuclear import, elevated necrosis and improved antitumor effects[J]. Biomaterials, 2015, 40: 12–22. DOI:10.1016/j.biomaterials.2014.11.034 |
| [14] | Wu J, Chen Q, Liu W, et al. Cytotoxicity of quantum dots assay on a microfluidic 3D-culture device based on modeling diffusion process between blood vessels and tissues[J]. Lab Chip, 2012, 12(18): 3474–3480. DOI:10.1039/c2lc40502d |
| [15] | Liu HL, Zhang YL, Yang N, et al. A functionalized single-walled carbon nanotube-induced autophagic cell death in human lung cells through Akt-TSC2-mTOR signaling[J]. Cell Death Dis, 2011, 2(5): e159. DOI:10.1038/cddis.2011.27 |
| [16] | Yu Y, Duan J, Yu Y, et al. Silica nanoparticles induce autophagy and autophagic cell death in HepG2 cells triggered by reactive oxygen species[J]. J Hazard Mater, 2014, 270: 176–186. DOI:10.1016/j.jhazmat.2014.01.028 |
| [17] | Zhou W, Miao Y, Zhang Y, et al. Induction of cyto-protective autophagy by paramontroseite VO2 nanocrystals[J]. Nanotechnology, 2013, 24(16): 165102. DOI:10.1088/0957-4484/24/16/165102 |
| [18] | Xu X, Ray R, Gu Y, et al. Electrophoretic analysis and purification of fluorescent single-walled carbon nanotube fragments[J]. J Am Chem Soc, 2004, 126(40): 12736–12737. DOI:10.1021/ja040082h |
| [19] | Sun YP, Zhou B, Lin Y, et al. Quantum-sized carbon dots for bright and colorful photoluminescence[J]. J Am Chem Soc, 2006, 128(24): 7756–7757. DOI:10.1021/ja062677d |
 2017, Vol. 43
2017, Vol. 43


