扩展功能
文章信息
- 庞磊, 孙小婷, 魏骐, 李志文, 董愫, 麻海春
- 前列腺素受体EP4在心肌肥厚和心肌缺血/再灌注损伤中作用的研究进展
- Progress research on effect of prostaglandin E receptor subtype 4 on myocardial hypertrophy and myocardial ischemia/reperfusion injury
- 吉林大学学报(医学版), 2016, 42(06): 1249-1253
- Journal of Jilin University (Medicine Edition), 2016, 42(06): 1249-1253
- 10.13481/j.1671-587x.20160639
-
文章历史
- 收稿日期: 2016-05-23
无论是在发达国家还是发展中国家,有心脏病史,尤其是心肌肥大病史的患者,缺氧导致的心肌缺血/再灌注(myocardial ischemia/reperfusion,MI/ R)损伤的发病率和死亡率明显高于正常人[1]。在大多数人群中,超重或者过度肥胖的人更容易患缺血性心肌病,这可能是由于肥胖会改变冠状动脉的血流或者使某些激素失调(如脂联素和瘦素等)。报道[2]显示:全世界肥胖人口的数量已经在过去的30年里呈现爆发式增长,超重和肥胖在2010年已经导致超过340万人死亡,心血管疾病是其主要死因。因此,研究MI/R损伤机制及其与相关疾病的关系(如肥胖、代谢综合征等)有重要临床意义。前列腺素E2 (prostaglandin E2,PGE2)是一种内源性脂质介质[3],主要由环氧合酶(cyclooxygenase,COX)介导产生。花生四烯酸是合成前列腺素的重要前体,主要由磷脂酶A2从细胞膜中的磷脂产生。前列腺素H2是各种前列腺素合成的首要前体。参与PGE2合成的有膜结合型前列腺素合酶1(microsomal prostaglandin E synthases-1,mPGES-1)、膜结合型前列腺素合酶2(mPGES-2)和胞质型前列腺素E2合酶(cytosolic PGE2 synthases,cPGES)[3-5]。PGE2通过激活前列腺素E受体(EPS)4种亚型发挥其不同的作用,分别被命名为EP1、EP2、EP3和EP4。在这些亚型中,EP4受体是分布最广泛的亚型并且存在于几乎所有的组织中,如心脏、脂肪组织、骨骼肌和肺,并参与各种病理生理过程。与野生型小鼠比较,EP4基因敲除鼠表现出低体质量和高脂饮食喂养后不易肥胖。然而,虽然EP4基因敲除鼠不易肥胖,但是其寿命也短于正常小鼠。另外,EP4基因敲除小鼠甘油三酯等脂质代谢紊乱,这表明在控制脂质稳态的过程中,EP4信号传导扮演着重要的角色。同时,PGE2-EP4信号传导通路的激活可以对心脏产生多重影响,表明EP4有作为药物作用靶点并能同时治疗心血管及代谢相关疾病的可能。然而,有关EP4在缺血性心脏病以及其他疾病(如脂质代谢障碍、糖尿病和肥胖等)并发模型下的作用研究较少。本文就PGE2-EP4信号通路在缺血性心脏病中(包括心肌肥大和MI/R损伤)作用的研究进展进行简要概述。
1 EP4的结构和信号通路EP4是一种G蛋白偶联受体,N末端位于细胞外,C末端位于细胞胞浆内,中段形成7个跨膜螺旋结构、3个细胞外环和3个细胞内环,其中胞浆面的第3个环与激活型G-蛋白(Gs)偶联[6]。在EP4外第2环的N-糖基化位点为配体结合的重要位置。其中,EP4的C末端在所有的PGE2受体中最长。在人类和小鼠中,EP4分别由488和513个氨基酸残端组成,EP4在这两者的氨基酸序列中有高达88%的同源性[7-8]。跨膜信息传递有关的G蛋白由α、β和γ亚单位组成, 受体激动后, 引起GTP与α亚单位结合, 导致Gα与Gβγ分离[9]。EP4主要是和激活型G蛋白α (stimulated Gα,Gsα)偶联, 在PGE2刺激下,诱导细胞中环腺苷酸(cAMP)水平升高[8]。cAMP水平升高激活蛋白激酶A (protein kinase A,PKA),PKA使得下游蛋白磷酸化,其中多数是被称为效应元件结合因子(cAMP response element binding protein,CREBP)的核转录因子[10]。被激活的CREBP可结合至特定位点、调节相关基因的表达,如B细胞淋巴瘤2(B-cell lymphoma 2,Bcl2)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)等,而该基因在缺血性心脏疾病发展过程中也起重要作用[11]。长期以来, PKA被认为是介导cAMP生物学效应的唯一下游信号分子。但新近发现的新型cAMP靶分子-cAMP直接激活交换蛋白(exchange protein directly activated by cAMP,Epac)的发现打破了这一说法。Epac包括Epac1和Epac2 2种Epac亚型,均可以转化下游蛋白-Ras相关蛋白1,使其由失活的鸟苷二磷酸形式转化为激活的鸟苷三磷酸形式,从而引发下游信号通路。EP4同时还能与抑制型G蛋白(Giα)偶联[12]。经过PGE2刺激后, Giα抑制腺苷酸环化酶活性,导致cAMP水平下降[13]。另外,通过Giα的激活,EP4介导并激活了磷酸激酶3 (phosphatidylinositol 3-kinase,PI3K)依赖性通路[14]。PI3K的激活抑制了PKA的活性,却激活了蛋白激酶B, 也可以磷酸化CREBP。另一方面,EP4通过PI3K /细胞外信号调节激酶(extracellular signal-regulated kinases,ERK)信号传导途径诱导早期生长反应因子1(EGR-1)的产生,并促进PGE2合酶的表达,表明EP4介导的下游信号和PGE2之间存在着正反馈调节。此外,通过对人骨髓cDNA文库进行的酵母双杂交筛选结果显示:EP4受体相关蛋白(EP receptor-associated protein,EPRAP)能与EP4受体胞浆中的C端相结合,而其相互作用能明显抑制NFκB p105亚基的磷酸化,从而抑制NFκB的活化[15]。PGE2结合EP4受体后,激活Gsα/ cAMP/ PKA/ cAMP/CREB信号通路,或者Gsα/ cAMP/Epac信号通路。EP4同时还能与Giα蛋白偶联,从而抑制cAMP / PKA/ CREB信号通路并激活PI3K通路。PI3K的活化不仅刺激蛋白激酶B (PKB)/ CREB途径,也通过ERK诱导EGR-1的表达。EPRAP还能抑制P105的磷酸化,并进一步抑制核因子κB (NFκB)的激活。见图 1(封三)。
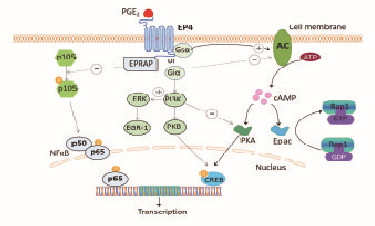
|
| 图 1 EP4介导的下游信号通路 Figure 1 Down-stream signaling pathway mediated by EP4 |
|
|
病理性心肌肥厚是细胞的代偿性反应,造成病理性心肌肥厚的主要原因有压力负荷过大、神经激素刺激、生长因子刺激和细胞因子刺激等。心肌肥大的早期阶段是循环代偿期,随着病情的进展,心脏结构形态会逐渐发生改变,进而发生心功能不全,最终导致心力衰竭,进入失代偿期。但是目前具体机制尚不清楚。
在心肌细胞中,PGE2促进蛋白质合成,增加了细胞表面面积并剂量依赖性地促进心肌细胞肥大相关基因,如心房利钠肽(atrial natriuretic peptide,ANP)和脑钠肽(brain natriuretic peptide,BNP)的表达[16-18]。在心肌梗死模型小鼠中,注射NS-398或罗非昔布(COX-2特异性抑制剂)的小鼠心肌梗死诱导的PGE2水平上升程度及心肌细胞肥大明显小于对照组[19]。mPGES-1敲除的小鼠心肌缺血之后,心肌PGE2水平并未明显上升,同时心肌细胞横截面积明显小于野生型小鼠,表明PGE2能在体内及体外同样促进心肌细胞肥大的产生[20]。
2.1 EP4在心肌肥厚中的作用PGE2导致心肌肥厚是由EP4受体信号的激活来介导的,因为EP4特异性拮抗剂(L-161982或ONO-AE3-208)明显阻断PGE2的促心肌细胞肥大作用,包括蛋白质合成、ANP mRNA的表达和BNP在新生心肌细胞中的表达[16, 18]。与体外实验结果一致的是,心肌细胞特异性敲除EP4基因的小鼠心肌梗死后,心肌细胞肥大程度明显小于野生型小鼠[21]。然而,全身性EP4敲除小鼠与野生型小鼠在正常情况[22]或压力超负荷(TAC)情况下所诱导的心肌肥厚模型中,小鼠心肌细胞横截面积并无明显差异[23]。这些研究差异产生的原因可能为:①心肌肥大的发展是一个非常缓慢的过程,如果没有连续的刺激,病程进展可能需要很长的时间,可能难以检测到明显心脏肥大的EP4野生型和敲除小鼠之间基础条件下的发展差异。②EP4受体在不同类型的细胞中广泛分布显示其参与了体内不同的生物学功能,如抗炎反应和能量代谢等。全身性EP4基因敲除小鼠,其体内的炎症信号通路或脂质代谢通路可能受干扰,间接对心肌肥厚的发展产生影响。炎症过程和能量代谢均与心肌肥大的发病有关。因此,基础条件或TAC引起的心肌肥厚状态下,全身性EP4敲除小鼠可能会通过其他途径代偿影响心肌肥厚的发病机制。③不同的心肌肥大的刺激途径可能激活不同的信号通路,并可能有不同的心肌细胞的基因表达模式[24]。因此,很有可能PGE2-EP4信号通路仅参与心肌梗死诱导的心肌肥大,却不参与TAC介导的心脏肥大。④在某些研究[23]中,EP4野生型和敲除小鼠的心脏/身体质量比仅在TAC实验模型建立4周后进行了比较,但通常来说TAC引起的心脏肥大在4周时已经达到了顶点。因此,应该同时在模型建立的早期和晚期阶段进行比较,从而得到相对可信的结论。综上所述,心肌细胞中的EP4是介导PGE2心肌肥厚效果的主要受体,但其明确的病理作用需要在未来研究中进行进一步证实。
EP4的活化通过与Gsα蛋白结合导致细胞中cAMP水平升高,而cAMP通过PKA和Epac发挥其生物学功能。尽管有研究[25]证明cAMP产生β肾上腺素能刺激诱导心脏肥大,但很显然不是通过cAMP/PKA或cAMP/Epac信号通路介导PGE2产生的心肌肥大,因为cAMP活化剂、cAMP抑制剂(SQ22536)、PKA抑制剂(H89)和Epac活化剂(8-CPT-2ME-cAMP)在不同浓度条件下对心肌细胞中PGE2诱导蛋白质合成无任何作用[18, 26-27]。
促分裂原活化蛋白激酶(MAPKs)介导的信号级联反应是心肌细胞肥大过程中非常重要的信号通路,而促分裂原活化蛋白激酶有4个主要的亚家族成员,包括细胞外信号调节激酶(ERK1/2或P42/ P44 MAPK)、c-JunN-末端激酶(JNK)、P38蛋白和ERK5[28]。ERK1/2抑制剂U0126能明显降低PGE2的促心肌细胞肥大作用,而P38蛋白激酶阻断剂(SB203580)和JNK抑制剂(SP600125)却无该效果[18]。通过PGE2激活的ERK1/2能明显被EP4拮抗剂ONO-208所抑制,表明ERK1/2的信号传导级联参与了PGE2-EP4介导的心脏肥大[18, 27]。ERK5是否参与PGE2诱导的蛋白质合成仍需要进一步研究。
G-蛋白偶联受体的活化能进一步激活表皮生长因子受体(epithelial growth factor receptor,EGFR),而这可能会导致ERK1 / 2信号的活化。EP4拮抗剂L-161982在心肌细胞中明显抑制由PGE2介导的EGFR磷酸化。EGFR抑制剂AG-1478完全阻断由PGE2介导的ERK1 /2的活化和PGE2-EP4介导的蛋白质合成,表明EGFR活化可能与PGE2/ EP4和ERK1 / 2信号通路有关联,并参与了PGE2在心肌细胞中促蛋白质合成作用[27]。
2.2 STAT-3信号通路与心肌肥大的关系信号传导和转录激活子3(STAT-3)途径是另一个在心脏肥大的发展中发挥重要作用的信号传导通路。体内外研究结果表明:经过不同信号刺激之后,STAT-3信号的激活促进心肌肥厚相关基因的表达从而促进心肌细胞肥大。PGE2在心肌细胞中能呈现剂量和时间依赖性地诱导STAT-3活化,而ERK1 / 2抑制剂(U0126)和EP4拮抗剂(GW627368X或AH23848B)能明显抑制PGE2诱导的STAT-3的活化[26]。在STAT-3基因沉默的心肌细胞中,PGE2介导的蛋白质合成也受到明显抑制,表明心肌肥大可能是由于STAT-3的活化作用于PGE2-EP4-ERK1 / 2通路产生的。
在野生型对照小鼠中,心肌梗死诱导的心脏肥大伴随着明显增加的STAT-3磷酸化,但STAT-3磷酸化的增加在心肌细胞特异性敲除EP4小鼠的心脏中并不存在,表明EP4-STAT3信号通路促进了心肌肥厚。
一旦STAT-3信号通路被激活并转移至细胞核中,将刺激COX-2基因表达,从而促进PGE2的合成,而新合成的PGE2也能进一步通过EP4受体激活STAT-3信号通路并形成正反馈循环,表明PGE2可能通过EP4-EGFR-ERK1 / 2-STAT-3的级联反应参与心肌肥大的发展。经过PGE2刺激后,EP4受体的激活能进一步促进EGFR的激活,并导致ERK1/2/STAT-3信号通路的活化。一旦STAT-3信号通路被激活并转移到细胞核中,其他细胞肥大相关基因以及COX-2基因的表达将被刺激,从而促进PGE2的合成,新合成的PGE2也能进一步通过EP4受体激活STAT-3信号通路并形成正反馈循环。而EP4受体下游的cAMP/PKA或cAMP/Epac信号通路则并无介导PGE2促心肌肥大的效果。见图 2(封三)。
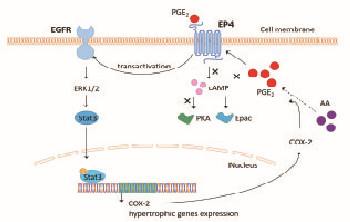
|
| 图 2 PGE2介导的心肌细胞肥大中的EP4信号通路 Figure 2 EP4 signaling pathway in PGE2-mediated mycardial hypertrophy |
|
|
缺血所引起的组织损伤是致死性疾病的主要原因,缺血性心脏病是由于冠状动脉的部分或完全阻塞引起的,缺血的心肌组织恢复血流会给组织造成更加严重的伤害,称为MI/R损伤。MI/R损伤的病理生理过程有可能涉及到许多因素,如氧自由基的形成、心肌能量代谢的改变、细胞凋亡的活化和炎症反应等。
心肌缺血期间,PGE2水平明显升高,可能是缺氧诱导因子(HIF-1α)/ COX-2通路激活的结果。对于不同类型的细胞,如在癌细胞系HT29 [29]和人支气管上皮BEAS-2B细胞[30]中,COX-2已被证明是HIF-1α的一个下游蛋白。研究[31]发现:COX-2在MI/R损伤心肌组织中的表达与HIF-1α的表达呈正相关关系,尽管无直接证据显示COX-2与HIF-1α有关联,但是心脏PGE2可能是通过HIF-1α/ COX-2通路在心肌缺血过程中产生。
PGE2水平的升高可通过EP4受体在MI/R过程中发挥保护作用。事实上,内源性PGE2可以通过体内和体外途径降低MI/R过程中心脏的损伤。同样,在使用EP4激动剂处理的动物心肌梗死面积明显小于对照组,心功能(包括左室收缩压和舒张压)得到明显改善。在HIF-1α+/-小鼠中缺血预处理所诱导的心肌保护作用完全丧失[32]。脯氨酸羟化酶1敲除小鼠能通过诱导HIF-1α的表达减少细胞凋亡,从而减轻MI/R损伤,另外COX-2对MI/R损伤也起一定的保护作用。因此,由HIF-1α/ COX-2来源的PGE2-EP4信号通路在心肌缺血过程中起保护作用。
虽然MI/R中EP4的下游信号未被研究证实,但是也有多种潜在的下游通路:①cAMP-PKA通路,通过细胞膜上的EP4受体的活化,即腺苷酸环化酶催化三磷酸腺苷转化,目前至少有9种亚型腺苷酸环化酶, 其中腺苷酸环化酶Ⅴ和Ⅵ是在哺乳动物心肌中主要表达的类型[33]。在心脏腺苷酸环化酶Ⅵ过度表达小鼠中,不良左室重构与左室收缩功能减弱,心肌缺血后,小鼠死亡率降低[34]。通过激活下游蛋白的cAMP, PKA呈现缺血状态且可能通过持续的缺血在其负性肌力作用下发挥心脏保护作用[35], 表明心肌缺血过程中, cAMP-PKA可能介导了PGE2-EP4信号通路的心脏保护作用。②STAT-3信号,除了在心脏肥大中的作用,STAT-3信号活化后可以在缺血后处理时发挥心肌保护作用,表明STAT-3信号传导的激活可通过清除氧自由基或改善线粒体功能实施心脏保护作用。在心肌细胞中,PGE2可呈剂量和时间依赖性地通过EP4受体激活STAT-3信号通路[26]。在心肌细胞特异性敲除EP4基因小鼠心脏组织中,与对照组比较,STAT-3信号激活程度明显降低,而且小鼠心肌梗死后心功能更差[21]。MI / R诱导的组织损伤涉及细胞凋亡的活化[36]。在新生大鼠心室肌细胞中,PGE2能通过STAT-3和ERK1 / 2的活化防止心肌细胞凋亡[37]。以上研究结果表明:STAT-3的信号传导的激活可能在心肌缺血期间对PGE2-EP4介的MI/R损伤起保护作用。
心肌缺血时,炎症细胞如巨噬细胞可以浸润到缺血心肌中并产生促炎性细胞因子和趋化因子,包括TNF-α、IL-6、IL-1β和单核细胞趋化蛋白1(MCP-1),这能进一步加剧MI/R损伤[38]。因此,在MI/R过程中,EP4受体有可能通过其激活产生的抗炎效果发挥心脏保护作用。EP4激动剂明显减低TNF-α、IL-6、IL-1β和MCP-1水平以及缺血后巨噬细胞浸润的程度[39]。EP4/STAT-3信号可以通过控制COX-2的表达建立一个正反馈循环,而新近合成的PGE2不仅可以触发更大的STAT-3活化,而且能通过旁分泌方式作用于浸润的炎症细胞的EP4受体并发挥抗炎作用。PGE2能作用于心肌细胞上的EP4受体,并通过其下游cAMP/PKA或者EP4/STAT-3信号通路发挥心脏保护作用。同时,增强的PGE2能扩散到心肌细胞周围浸润的炎性细胞,如巨噬细胞等,通过作用于EP4受体发挥抗炎作用进而缓解MI/R过程中引起的损伤。见图 3(封三)。
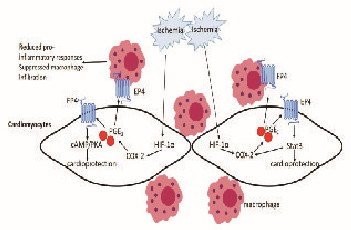
|
| 图 3 心肌缺血过程中HIF-lα/COX-2活化和心肌PGE2水平 Figure 3 Activation of HIF-lα/COX-2 and level of PGE2 in myocardium during myocardial ischemia |
|
|
因此,EP4受体可能在多个层面对MI/R起保护作用。而EP4激动剂可作为一种新的方法用来治疗MI/R损伤。
4 结论心脏肥大不仅是心肌缺血的危险因素,而且心肌缺血同样能促进心肌肥大的发生,并进一步加剧MI/R损伤。PGE2-EP4信号传导的激活可通过完全相反的途径对缺血性心脏事件发挥作用。EP4可通过激活EGFR / ERK1 / 2 / STAT-3信号通路促进心肌肥厚,而PGE2-EP4信号同样可通过cAMP/PKA或STAT-3通路保护MI/R损伤。尽管尚无研究显示STAT-3信号通路对EP4介导的心脏起保护作用,但是在体内模型中,心肌细胞特异性敲除EP4基因小鼠在建立心肌梗死模型后,表现为心脏肥大程度降低但心脏功能更加恶化,表明EP4信号的激活可能通过代偿性心肌细胞的肥大来维持正常心脏功能。
综上所述,关于EP4的潜在不利影响需要特别评估,从而确定EP4可以在心脏组织中激活,且不会触发不必要的副作用。此外,PGE2-EP4信号通路的在心脏中的作用应受到重视,以发现新的诊疗方法治疗患者的缺血性心脏疾病及其相关疾病。
| [1] | Ferdinandy P, Hausenloy DJ, Heusch G, et al. Interaction of risk factors, comorbidities, and comedications with ischemia/reperfusion injury and cardioprotection by preconditioning, postconditioning, and remote conditioning[J]. Pharmacol Rev, 2014, 66: 1142–1174. DOI:10.1124/pr.113.008300 |
| [2] | Pang L, Ma H, Cai Y, et al. Inhibition of COX-2/PGE2/EP4 signaling protects against post-hypoxic apoptosis In H9C2 cardiomyocytes[J]. FASEB, 2016, 30: 937–939. |
| [3] | Murakami M. Lipid mediators in life science[J]. Exp Anim, 2011, 60: 7–20. DOI:10.1538/expanim.60.7 |
| [4] | Harizi H, Corcuff JB, Gualde N. Arachidonic-acid-derived eicosanoids:roles in biology and immunopathology[J]. Trends Mol Med, 2008, 14: 461–469. DOI:10.1016/j.molmed.2008.08.005 |
| [5] | Pang L, Cai Y, Tang EH, et al. Prostaglandin E receptor subtype 4 signaling in the heart:role in ischemia/reperfusion injury and cardiac hypertrophy[J]. J Diabetes Res, 2016, 2016: 1324347. |
| [6] | Kobilka BK. G protein coupled receptor structure and activation[J]. Biochim Biophys Acta, 2007, 1768: 794–807. DOI:10.1016/j.bbamem.2006.10.021 |
| [7] | Sugimoto Y, Narumiya S. Prostaglandin E receptors[J]. Biolog Chem, 2007, 282: 11613–11617. DOI:10.1074/jbc.R600038200 |
| [8] | Yokoyama U, Iwatsubo K, Umemura M, et al. The prostanoid EP4 receptor and its signaling pathway[J]. Pharmacol Rev, 2013, 65: 1010–1052. DOI:10.1124/pr.112.007195 |
| [9] | Tuteja N. Signaling through G protein coupled receptors[J]. Plant Signaling Behavior, 2009, 4: 942–947. DOI:10.4161/psb.4.10.9530 |
| [10] | Delghandi MP, Johannessen M, Moens U. The cAMP signalling pathway activates CREB through PKA, p38 and MSK1 in NIH 3T3 cells[J]. Cell Signal, 2005, 17: 1343–1351. DOI:10.1016/j.cellsig.2005.02.003 |
| [11] | Ichiki T. Role of cAMP response element binding protein in cardiovascular remodeling:good, bad, or both?[J]. Arterioscler Thromb Vasc Biol, 2006, 26: 449–455. |
| [12] | Fujino H, Regan JW. EP (4) prostanoid receptor coupling to a pertussis toxin-sensitive inhibitory G protein[J]. Mol Pharmacol, 2006, 69: 5–10. |
| [13] | Anand-Srivastava MB. Modulation of Gi proteins in hypertension:role of angiotensin Ⅱ and oxidative stress[J]. Curr Cardiol Rev, 2010, 6: 298–308. DOI:10.2174/157340310793566046 |
| [14] | Fujino H, West KA, Regan JW. Phosphorylation of glycogen synthase kinase-3 and stimulation of T-cell factor signaling following activation of EP2 and EP4 prostanoid receptors by prostaglandin E2[J]. J Biol Chem, 2002, 277: 2614–2619. DOI:10.1074/jbc.M109440200 |
| [15] | Minami M, Shimizu K, Okamoto Y, et al. Prostaglandin E receptor type 4-associated protein interacts directly with NF-kappaB1 and attenuates macrophage activation[J]. J Biol Chem, 2008, 283: 9692–9703. DOI:10.1074/jbc.M709663200 |
| [16] | He Q, Harding P, LaPointe MC. PKA, Rap1, ERK1/2, and p90RSK mediate PGE2 and EP4 signaling in neonatal ventricular myocytes[J]. Am J Physiol Heart Circ Physiol, 2010, 298: H136–143. DOI:10.1152/ajpheart.00251.2009 |
| [17] | Qian JY, Leung A, Harding P, et al. PGE2 stimulates human brain natriuretic peptide expression via EP4 and p42/44 MAPK[J]. Am J Physiol Heart Circ Physiol, 2006, 290: H1740–1746. DOI:10.1152/ajpheart.00904.2005 |
| [18] | Miyatake S, Manabe-Kawaguchi H, Watanabe K, et al. Prostaglandin E2 induces hypertrophic changes and suppresses alpha-skeletal actin gene expression in rat cardiomyocytes[J]. J Cardiovasc Pharmacol, 2007, 50: 548–554. DOI:10.1097/FJC.0b013e318145ae2e |
| [19] | LaPointe MC, Mendez M, Leung A, et al. Inhibition of cyclooxygenase-2 improves cardiac function after myocardial infarction in the mouse[J]. Am J Physiol Heart Circ Physiol, 2004, 286: H1416–1424. |
| [20] | Degousee N, Fazel S, Angoulvant D, et al. Microsomal prostaglandin E2 synthase-1 deletion leads to adverse left ventricular remodeling after myocardial infarction[J]. Circulation, 2008, 117: 1701–1710. DOI:10.1161/CIRCULATIONAHA.107.749739 |
| [21] | Qian JY, Harding P, Liu Y, et al. Reduced cardiac remodeling and function in cardiac-specific EP4 receptor knockout mice with myocardial infarction[J]. Hypertension, 2008, 51: 560–566. DOI:10.1161/HYPERTENSIONAHA.107.102590 |
| [22] | Xiao CY, Yuhki K, Hara A, et al. Prostaglandin E2 protects the heart from ischemia-reperfusion injury via its receptor subtype EP4[J]. Circulation, 2004, 109: 2462–2468. DOI:10.1161/01.CIR.0000128046.54681.97 |
| [23] | Hara A, Yuhki K, Fujino T, et al. Augmented cardiac hypertrophy in response to pressure overload in mice lacking the prostaglandin I2 receptor[J]. Circulation, 2005, 112: 84–92. DOI:10.1161/CIRCULATIONAHA.104.527077 |
| [24] | Frey N, Katus HA, Olson EN, et al. Hypertrophy of the heart:a new therapeutic target?[J]. Circulation, 2004, 109: 1580–1589. DOI:10.1161/01.CIR.0000120390.68287.BB |
| [25] | Metrich M, Berthouze M, Morel E, et al. Role of the cAMP-binding protein Epac in cardiovascular physiology and pathophysiology[J]. Pflugers Arch, 2010, 459: 535–546. DOI:10.1007/s00424-009-0747-y |
| [26] | Frias MA, Rebsamen MC, Gerber-Wicht C, et al. Prostaglandin E2 activates Stat3 in neonatal rat ventricular cardiomyocytes:A role in cardiac hypertrophy[J]. Cardiovasc Res, 2007, 73: 57–65. DOI:10.1016/j.cardiores.2006.09.016 |
| [27] | Mendez M, LaPointe MC. PGE2-induced hypertrophy of cardiac myocytes involves EP4 receptor-dependent activation of p42/44 MAPK and EGFR transactivation[J]. Am J Physiol Heart Circ Physiol, 2005, 288: H2111–2117. DOI:10.1152/ajpheart.00838.2004 |
| [28] | Rose BA, Force T, Wang Y. Mitogen-activated protein kinase signaling in the heart:angels versus demons in a heart-breaking tale[J]. Physiol Rev, 2010, 90: 1507–1546. DOI:10.1152/physrev.00054.2009 |
| [29] | Kaidi A, Qualtrough D, Williams AC, et al. Direct transcriptional up-regulation of cyclooxygenase-2 by hypoxia-inducible factor (HIF)-1 promotes colorectal tumor cell survival and enhances HIF-1 transcriptional activity during hypoxia[J]. Cancer Res, 2006, 66: 6683–6691. DOI:10.1158/0008-5472.CAN-06-0425 |
| [30] | He J, Wang M, Jiang Y, et al. Chronic arsenic exposure and angiogenesis in human bronchial epithelial cells via the ROS/miR-199a-5p/HIF-1alpha/COX-2 pathway[J]. Environ Health Perspect, 2014, 122: 255–261. |
| [31] | Abbate A, Santini D, Biondi-Zoccai GG, et al. Cyclo-oxygenase-2(COX-2) expression at the site of recent myocardial infarction:friend or foe?[J]. Heart, 2004, 90: 440–443. DOI:10.1136/hrt.2003.010280 |
| [32] | Cai Z, Zhong H, Bosch-Marce M, et al. Complete loss of ischaemic preconditioning-induced cardioprotection in mice with partial deficiency of HIF-1 alpha[J]. Cardiovasc Res, 2008, 77: 463–470. |
| [33] | Leineweber K, Bohm M, Heusch G. Cyclic adenosine monophosphate in acute myocardial infarction with heart failure:slayer or savior?[J]. Circulation, 2006, 114: 365–367. DOI:10.1161/CIRCULATIONAHA.106.642132 |
| [34] | Takahashi T, Tang T, Lai NC, et al. Increased cardiac adenylyl cyclase expression is associated with increased survival after myocardial infarction[J]. Circulation, 2006, 114: 388–396. DOI:10.1161/CIRCULATIONAHA.106.632513 |
| [35] | Birkenmeier K, Janke I, Schunck WH, et al. Prostaglandin receptors mediate effects of substances released from ischaemic rat hearts on non-ischaemic cardiomyocytes[J]. Eur J Clin Invest, 2008, 38: 902–909. DOI:10.1111/eci.2008.38.issue-12 |
| [36] | Krijnen PA, Nijmeijer R, Meijer CJ, et al. Apoptosis in myocardial ischaemia and infarction[J]. J Clin Pathol, 2002, 55: 801–811. DOI:10.1136/jcp.55.11.801 |
| [37] | Frias MA, Somers S, Gerber-Wicht C, et al. The PGE2-Stat3 interaction in doxorubicin-induced myocardial apoptosis[J]. Cardiovasc Res, 2008, 80: 69–77. DOI:10.1093/cvr/cvn171 |
| [38] | Frangogiannis NG. Targeting the inflammatory response in healing myocardial infarcts[J]. Curr Med Chem, 2006, 13: 1877–1893. DOI:10.2174/092986706777585086 |
| [39] | Hishikari K, Suzuki J, Ogawa M, et al. Pharmacological activation of the prostaglandin E2 receptor EP4 improves cardiac function after myocardial ischaemia/reperfusion injury[J]. Cardiovasc Res, 2009, 81: 123–132. DOI:10.1093/cvr/cvn254 |
 2016, Vol. 42
2016, Vol. 42


