扩展功能
文章信息
- 陈阳, 鄂长勇, 关连越, 刘文韬, 王丽娜, 张学文
- CHEN Yang, E Changyong, GUAN Lianyue, LIU Wentao, WANG Lina, ZHANG Xuewen
- 四氯化碳诱导的肝硬化小鼠肝部分切除后肝再生模型的建立及评价
- Establishment of liver regeneration model of cirrhosis mice induced by CCl4 after partial hepatectomy and its evaluation
- 吉林大学学报(医学版), 2016, 42(06): 1243-1248
- Journal of Jilin University (Medicine Edition), 2016, 42(06): 1243-1248
- 10.13481/j.1671-587x.20160638
-
文章历史
- 收稿日期: 2015-05-07
2. 吉林大学中日联谊医院肝胆胰外科, 吉林 长春 130033;
3. 吉林大学第一医院神经内科, 吉林 长春 130021
2. Department of Hepatobiliary and Pancreas Surgery, China-Japan Union Hospital, Jilin University, Changchun 130033, China;
3. Department of Neurology, First Hospital, Jilin University, Changchun 130021, China
肝脏作为人体重要的代谢器官,具有强大的再生能力。研究[1-2]表明:肝脏大部分切除后约1个月即可恢复至原肝脏的质量和功能,6~9个月即可恢复至原肝脏大小。肝硬化是由于多种损伤因素,如病毒、酒精和化学物质等长期作用于肝脏后造成的肝实质细胞及非实质细胞损伤、修复的一个复杂的病理生理过程,可导致肝癌的发生[3-4]。与正常肝脏比较,并发肝硬化的肝癌手术切除后肝脏再生过程中局部微环境的改变对肿瘤术后复发、转移可能产生重要影响[5]。目前,正常肝脏组织的肝再生动物模型已经比较成熟,但肝硬化条件下,肝部分切除诱导肝再生的动物模型报道不多。本实验采用四氯化碳(CCl4)诱导小鼠肝硬化后,利用肝部分切除诱导肝再生模型,评估肝硬化小鼠的肝再生能力和肝再生过程中的病理学变化,旨在建立可广泛应用的肝硬化小鼠肝部分切除后肝再生模型。
1 材料与方法 1.1 实验动物、主要试剂和仪器健康成年ICR雄鼠50只,由吉林大学实验动物中心提供,动物许可证号:SCXK (吉)2013-0001,11~12周,体质量为28~31 g,饲养于无特定病原体环境(SPF级)中,温度控制在(22.0±2.0)℃,自由进水,标准鼠食喂养,12 h昼夜生活环境。CCl4为上海新中化学试剂厂产品,使用前用豆油配成体积分数为20% CCl4的油剂溶液;小鼠肝细胞生长因子(HGF) ELISA试剂盒购自上海逸峰生物科技有限公司;丙氨酸氨基转移酶(ALT)试剂盒购自南京建成生物工程研究所。显微外科手术器械1套(可反复高压消毒),电凝笔1个,自制泡沫塑料鼠板数个,电子天平(精确到0.000 1 g)1个。
1.2 CCl4诱导肝硬化模型的建立将50只小鼠随机分为实验组和对照组,每组25只。实验组动物按5 mL·kg-1体质量腹腔注射体积分数为20%的CCl4油剂溶液,每周2次,连续8周。对照组小鼠腹腔注射等量等次的豆油溶剂。实验周期为8周,观察2组小鼠一般活动、精神状况和饮食量,实验前后称量小鼠体质量。
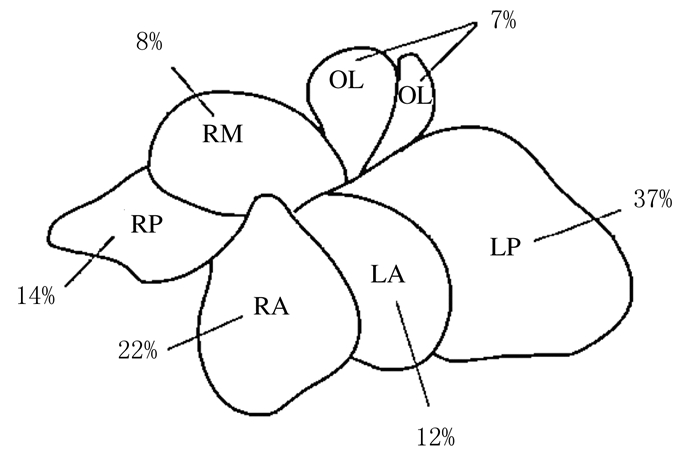
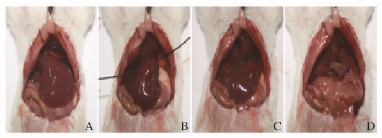
1.3 小鼠肝部分切除术小鼠肝硬化模型建立成功后行37%肝脏部分切除术,即左外叶切除术,见图 1。小鼠术前不禁食水,于手术当日早晨8时分别称取体质量并记录,氯胺酮+甲苯噻嗪按1.2 mL·100-1g腹腔注射麻醉,麻醉满意后将其固定在自制泡沫鼠板上,取上腹横切口,常规消毒,切口长约3 cm,打开腹腔,用止血钳向上拉开剑突,充分暴露肝脏,离断镰状韧带,用1号手术丝线结扎左外侧叶肝蒂,沿结扎线尽可能近地切除左外侧叶,用湿棉签清除腹腔内积液,确认无活动性出血后用3-0手术丝线关腹,见图 2(封三)。缝合后皮下注射0.2 mL青霉素进行消炎。2组小鼠手术操作均在SPF级环境中完成。术后常规饲养,观察小鼠的存活情况,记录2组小鼠手术成功率及术后6周的生存率。
|
| 图 1 各肝叶在总肝质量中的比重 Figure 1 Specific density of each hepatic lobe to total liver mass |
|
|
|
| 图 2 小鼠肝部分切除过程的示意图 Figure 2 Schematic diagram of procedure of partial hepatectomy of mice |
|
|
分别在术前、肝切除术后3 d和1、3及6周于2组中各随机选取4只小鼠,摘眼球取血,处死后取小鼠肝脏,称质量后置于4%甲醛溶液中固定,常规方法制作石蜡切片。切片行常规HE染色和Masson染色,光学显微镜下观察小鼠肝组织结构变化。所取血标本置于冰上静置,4℃离心后取血清,-80℃低温保存。肝再生率计算公式:肝再生率=[手术后取材时的肝质量-(手术前总肝质量-切除肝质量)]/手术前总肝质量×100%。小鼠总肝质量按5.5%体质量计算。
1.5 小鼠血清HGF水平的测定采用ELISA法测定小鼠血清HGF水平,参照试剂盒说明进行操作,酶标仪450 nm处检测酶标板各孔的吸光度(A)值,根据标准曲线计算检测样本的浓度。
1.6 小鼠血清ALT水平的测定血清ALT水平测定按照ALT水平检测试剂盒说明书进行。
1.7 统计学分析采用SPSS 22.0统计软件进行统计学分析。2组小鼠体质量和手术时间以x±s表示,组间比较采用t检验。以α=0.05为检验水准。
2 结果 2.1 肝硬化模型建立后2组小鼠的一般情况实验组小鼠随着给药时间的延长活动逐渐减少,精神萎糜,毛发蓬乱无光泽,饮食量减少,常钻入垫料中卷缩而卧,8周时体质量较原体质量平均增长(20.7±4.7) g;对照组小鼠活动如常,反应机警,毛发有光泽,饮食量正常,8周时体质量较原体质量增长(24.8±5.3) g,高于实验组(P=0.043 2)。
2.2 2组小鼠的手术时间和术后6周内存活率在预实验基础上,2组小鼠完成37%肝脏部分切除的时间为(18.2±1.1) min。本实验术中无结扎线脱落所致下腔静脉、门静脉或肝动脉出血,无胆瘘等。手术成功率为100%。2组小鼠术后数小时内均出现萎靡不振、毛发竖立、嗜睡状态,5~10 h后恢复活动,可自由进食和饮水。术后6周内2组小鼠的存活率均为100%。
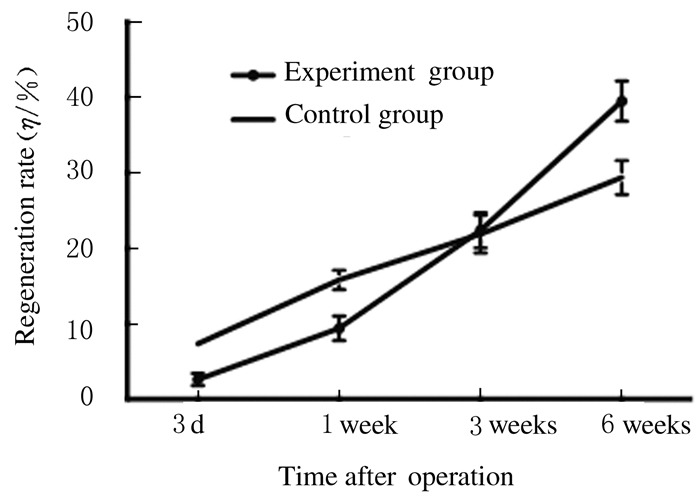
2.3 肝部分切除术后2组小鼠的新生肝质量和肝再生率实验组小鼠新生肝质量和肝再生率在术后3周内低于对照组(3d:P < 0.01;1周:P < 0.01),在3周时两者基本持一致(P=0.773),而在术后6周时实验组小鼠的肝再生率高于对照组(P < 0.01)。见图 3和4。

|
| 图 3 术后2组小鼠新生肝质量 Figure 3 Neonatal liver mass of mice in two groups after operation |
|
|
|
| 图 4 术后2组小鼠肝再生率 Figure 4 Regeneration rates of liver of mice in two groups after operation |
|
|
大体标本:术前对照组小鼠肝脏呈暗红色,质软,表面光滑;术后3 d及1周时肝脏明显充血肿大;术后3周及以后恢复至术前情况。术前实验组小鼠肝脏质地较脆,表面可见许多小结节;术后3 d、1周及3周时均观察到肝脏充血肿大;术后3周及6周时肝脏表面结节数量减少。
HE染色和Masson染色结果显示:术前对照组小鼠肝小叶结构完整,肝索排列有序,肝细胞有轻微的脂肪变,无坏死及炎细胞浸润;实验组小鼠肝小叶结构破坏,肝索排列紊乱,肝细胞可见脂肪变性和坏死等,汇管区炎性细胞浸润,纤维组织增生,纤维条索形成,肝纤维化趋势明显。术后实验组可见枯否氏细胞数量增多,处于分裂期的肝细胞呈不规则分布,细胞核明显增大,胞浆疏松,纤维隔及汇管区炎性细胞浸润加重,随着时间的推移,肝细胞脂肪变及坏死逐渐减少,肝纤维化现象逐渐减退。见图 5(封三)。

|
| 图 5 手术前后2组小鼠组织结构形态表现 Figure 5 Morphology of structure of mice in two groups before and after operation |
|
|
实验组小鼠血清HGF水平明显高于对照组(P < 0.05);2组小鼠血清HGF水平均于术后第3天有所升高(P < 0.05);随后逐渐恢复至术前水平;实验组小鼠血清HGF水平升高程度较对照组更为明显,且恢复较慢。见图 6。

|
| 图 6 术后2组小鼠血清HGF水平 Figure 6 Levels of serum HGF of mice in two groups after operation |
|
|
肝切除后小鼠血清ALT水平迅速升高。与术前比较,术后3 d对照组小鼠血清ALT水平升高明显(P < 0.05),术后1周基本降至术前水平。手术前后各时点实验组小鼠血清ALT水平均高于对照组(P < 0.05),肝切除术后较术前明显升高(P < 0.05),且升高幅度明显高于对照组(P < 0.05),术后1周时达高峰,术后3周时下降明显(P < 0.05),术后6周时基本降至术前水平,ALT水平升高的持续时间较对照组明显延长。见图 7。

|
| 图 7 术后2组小鼠血清ALT水平 Figure 7 Levels of serum ALT of mice in two groups after operation |
|
|
本研究结果显示:与对照组比较,实验组小鼠的肝再生表现出了明显的再生延迟现象。病理结果和血清ALT水平变化提示实验组小鼠术后肝再生时存在大量细胞坏死及凋亡,随着时间的推移,小鼠肝纤维化程度逐渐减轻。
本实验采用CCl4诱导建立小鼠肝硬化模型,具有耗时短和病变典型的优点,是经典的研究肝硬化的模型[6-7]。腹腔注射CCl4 8周后小鼠明显呈病态反应:活动减少、精神萎靡、饮食减量和体质量增长缓慢。对其解剖后可见肝表面颜色偏暗,有多个小结节,质地较脆。组织病理学检测结果表明:肝小叶结构破坏、肝索排列紊乱、肝细胞变性坏死、纤维组织增生、纤维条索形成,符合肝硬化的表现,提示小鼠肝硬化模型建立成功。
目前肝再生模型多采用肝左叶联合中叶切除,切除质量占总肝质量的60%~70%[8],但在肝硬化基础上进行的肝大部切除模型由于术后生存率较低,难以普及。陈平等[9]对皮下注射CCl4 6周的大鼠行70%肝部分切除,其1周内死亡率为24%。Kuramitsu等[10]进行类似的小鼠实验结果显示:小鼠术后生存率仅为68.9%,术后10 d肝再生率为11%。本文作者预实验时对4只肝硬化小鼠行70%肝切除术,其中1只小鼠因术中失血过多死亡,1只小鼠术后精神萎靡,几乎不能活动,不能进食水,于术后第2天死亡,只有2只小鼠成功存活。分析原因可能如下:①肝硬化小鼠肝功能受到影响,肝大部切除后难以代偿;②肝硬化小鼠凝血机制较差,易出血;③实验室条件有限且需要熟练的技术支持。研究[11]显示:肝切除后肝再生速度与肝切除量有关,切除量太大(>85%)或太小( < 30%)均可导致再生较慢。因此,在前期实验的基础上,本实验尝试仅行肝左叶切除(约37%)观察肝再生效果。本研究结果显示:术后25只小鼠全部存活,术后1周肝硬化小鼠肝再生率为9.41%,与Kuramitsu等[10]的研究结果相近,表明在肝硬化基础上行37%肝切除模型的成活率高、存活时间长且同样可观察到肝再生,另外,该模型便于继续观察肝迅速再生时期过后的机体变化,使得模型的应用范围更加广泛。
目前常见的肝切除手段主要有4种:丝线结扎法、止血夹法、基于血管定位的肝实质保留法以及基于血管定位的显微手术法[11-12]。丝线结扎法最为常用且经典,具有手术时间短、操作简单便捷、止血效果确切、重复性强和成本较低等优点,但是风险较高,可能导致下腔静脉狭窄和肝脏充血。本实验选择了该方法,术中未发生结扎线脱落所致下腔静脉、门静脉或肝动脉出血以及胆瘘等手术并发症,手术成功率达到100%。结合文献[12-15]及手术经验,本文作者认为施行该手术应注意如下几点:①手术建议选择横向切口,便于手术操作且术后恢复较好;②用止血钳向上拉开剑突,离断镰状韧带,充分暴露肝脏,以便于结扎肝叶;③灵活利用棉签作为牵拉、显露和止血的工具,避免肝脏损伤,及时发现出血并处理;④结扎时应靠近肝叶基底,尽量减少肝叶的残留,但要注意对血管的损伤及线结可能造成的下腔静脉阻塞等,结扎时动作应轻柔,避免撕扯到肝下的血管;⑤残肝断面可能会出现渗血或胆漏,利用电刀或电烙铁电烧断面效果较好;⑥术后保温、补液和应用抗生素预防感染有利于提高小鼠术后成活率。
评价肝再生有多种方法,肝质量/体质量是较直观、简单的方法,但准确性不高,肝再生率排除了肝再生过程中体质量变化的影响,能比较准确地反映肝再生情况[16]。本研究统计肝切除术后3 d和1、3及6周时小鼠新生肝质量及肝再生率发现:实验组小鼠肝再生率在术后3周内低于对照组,在术后3周时两者基本一致,而在术后3周之后实验组小鼠的肝再生率高于对照组。小鼠肝质量于5~6周时可恢复至术前水平,表明肝硬化小鼠肝再生启动较为延迟,再生缓慢。对照组小鼠术后1周时肝再生速度逐渐减缓,此时肝硬化小鼠的肝再生仍保持较高的势头。在术后6周时,肝硬化小鼠的新生肝质量和肝再生率均高于对照组,本文作者认为:对照组小鼠于术后6周时肝代偿已基本足够,而实验组小鼠肝功能较差,无用增殖及无用组织较多,故而需要进一步的分裂、再生来恢复肝功能。
HGF主要由间质细胞产生,在肝、肺和肾等多个脏器中分泌。HGF可以刺激肝细胞的DNA合成,且在肝再生过程中起重要作用,是目前已知的最强的促肝再生因子[17-19],其水平变化可以间接反映肝再生的情况。由于肝硬化是慢性肝损伤的过程,肝再生已广泛发生,本文作者发现实验组小鼠的血清HGF水平高于对照组。在进行肝切除术后,2组小鼠血清HGF水平均有所升高,对照组小鼠血清HGF水平在术后1周左右即降回术前水平,而实验组小鼠血清HGF水平在术后第6周时才恢复,进一步说明了肝硬化小鼠的肝再生延迟。
另外,本研究还检测了小鼠血清ALT水平以反映其肝功能变化情况,文献[19]报道:正常和肝硬化大鼠术后血清ALT水平与肝再生率呈明显负相关关系。本研究检测ALT水平的时间点较少,并未发现其变化与肝再生率的关系。但从结果可看出术前实验组小鼠血清ALT水平高于对照组,这是由于CCl4的作用造成硬化肝脏的肝细胞持续损伤,术后2组小鼠血清ALT水平均升高,实验组小鼠血清ALT水平升高较对照组更明显,表明肝切除术本身可以造成肝细胞的损伤,而实验组小鼠肝损伤程度更为严重。实验组小鼠血清ALT水平达到峰值的时间较对照组延迟,这可能与肝再生率变化相关。
综上所述,本文成功建立了肝硬化小鼠肝部分切除后肝再生模型并进行了初步评价。该模型具有稳定、可靠、生存期长、操作简单快捷和成本较低的优点,值得推广。
| [1] | Starzl TE, Koep LJ, Weil RR, et al. Right trisegmentectomy for hepatic neoplasms[J]. Surg Gynecol Obstet, 1980, 150(2): 208–214. |
| [2] | Nagasue N, Yukaya H, Ogawa Y, et al. Human liver regeneration after major hepatic resection. A study of normal liver and livers with chronic hepatitis and cirrhosis[J]. Ann Surg, 1987, 206(1): 30–39. DOI:10.1097/00000658-198707000-00005 |
| [3] | Hackl C, Schlitt HJ, Renner P, et al. Liver surgery in cirrhosis and portal hypertension[J]. World J Gastroenterol, 2016, 22(9): 2725–2735. DOI:10.3748/wjg.v22.i9.2725 |
| [4] | Iwaisako K, Taura K, Koyama Y, et al. Strategies to detect hepatic myofibroblasts in liver cirrhosis of different etiologies[J]. Curr Pathobiol Rep, 2014, 2(4): 209–215. DOI:10.1007/s40139-014-0057-8 |
| [5] | Suárez-Cuenca JA, Chagoya de Sánchez V, Aranda-Fraustro A, et al. Partial hepatectomy-induced regeneration accelerates reversion of liver fibrosis involving participation of hepatic stellate cells[J]. Exp Biol Med (Maywood), 2008, 233(7): 827–839. DOI:10.3181/0709-RM-247 |
| [5] | Nikfarjam M, Malcontenti-Wilson C, Fanartzis M, et al. A model of partial hepatectomy in mice[J]. Invest Surg, 2004, 17(5): 291–294. DOI:10.1080/08941930490502871 |
| [6] | 马学惠. 肝纤维化动物模型的造模方法[J]. 中华肝脏病杂志, 1996, 4(1): 58–60. |
| [7] | Domenicali M, Caraceni P, Giannone F, et al. A novel model of CCl4-induced cirrhosis with ascites in the mouse[J]. J Hepatol, 2009, 51(6): 991–999. DOI:10.1016/j.jhep.2009.09.008 |
| [8] | Inderbitzin D, Studer P, Sidler D, et al. Regenerative capacity of individual liver lobes in the microsurgical mouse model[J]. Microsurgery, 2006, 26(6): 465–469. DOI:10.1002/(ISSN)1098-2752 |
| [9] | 陈平, 李昆, 董家鸿. 肝硬变大鼠肝部分切除术动物模型的制作及评价[J]. 第三军医大学学报, 2002, 24(4): 488–490. |
| [10] | Kuramitsu K, Sverdlov DY, Liu SB, et al. Failure of fibrotic liver regeneration in mice is linked to a severe fibrogenic response driven by hepatic progenitor cell activation[J]. Am J Pathol, 2013, 183(1): 182–194. DOI:10.1016/j.ajpath.2013.03.018 |
| [11] | Martins PN, Theruvath TP, Neuhaus P. Rodent models of partial hepatectomies[J]. Liver Int, 2008, 28(1): 3–11. |
| [12] | 李一, 胡建军, 韩伟, 等. 小鼠部分肝切除术的现状与应用[J]. 世界华人消化杂志, 2011, 19(3): 275–280. |
| [13] | 罗志新, 赵刚. 小鼠肝部分切除模型[J]. 现代生物医学进展, 2012, 12(15): 2994–2997. |
| [14] | Greene AK, Puder M. Partial hepatectomy in the mouse:technique and perioperative management[J]. J Invest Surg, 2003, 16(2): 99–102. DOI:10.1080/08941930390194424 |
| [15] | 汤朝晖, 吴孟超. 利用分叶顺次肝切除术建立小鼠肝脏大部切除后再生模型[J]. 第二军医大学学报, 2009, 30(5): 524–526. |
| [16] | 陈栋, 陈实, 吴力群, 等. 大鼠肝切除术后肝损伤程度与肝再生状态的动态对比研究[J]. 中华肝胆外科杂志, 2002, 8(6): 354–357. |
| [17] | Karabulut S, Tas F, Akyüz F, et al. Clinical significance of serum hepatocyte growth factor (HGF) levels in hepatocellular carcinoma[J]. Tumor Biol, 2014, 35(3): 2327–2333. DOI:10.1007/s13277-013-1308-8 |
| [18] | 张静雯, 时永全, 韩英. 肝硬化的治疗进展[J]. 临床肝胆病杂志, 2015, 31(3): 465–468. |
| [29] | 吴晓峰, 伏志, 刘召波, 等. 肝硬化门静脉高压患者行脾切除断流术后早期门静脉血栓形成的原因分析[J]. 临床肝胆病杂志, 2015, 31(3): 400–403. |
 2016, Vol. 42
2016, Vol. 42


