扩展功能
文章信息
- 郭晓兰, 谭茵, 陈文生, 林玉茵, 戴建威
- GUO Xiaolan, TAN Yin, CHEN Wensheng, LIN Yuyin, DAI Jianwei
- GHRHR-SV1抗体的制备及其蛋白在黑色素瘤细胞中的表达
- Preparation of GHRHR-SV1 antibodyand expression ofits protein in melanoma cells
- 吉林大学学报(医学版), 2016, 42(06): 1237-1242
- Journal of Jilin University (Medicine Edition), 2016, 42(06): 1237-1242
- 10.13481/j.1671-587x.20160637
-
文章历史
- 收稿日期: 2016-03-22
生长激素释放激素受体(growth hormone-releasing hormone receptor, GHRHR)是G蛋白偶联受体第二家族成员,GHRHR只存在于垂体和极少数垂体外正常组织中。在垂体前叶,GHRHR可与生长激素释放激素(GHRH)特异性结合,激活下游信号通路,释放生长激素,从而促进细胞的生长[1]。研究[2-5]显示:GHRHR的剪接变异体广泛存在于不同类型的肿瘤组织和癌细胞系中,其中,生长激素释放激素受体剪接变异体1(growth hormone-releasing hormone receptor splice variant 1, GHRHR-SV1)的存在最广泛,且其结构与垂体型GHRHR最相似,仅氨基端胞外区的25个氨基酸序列替代了垂体型GHRHR的89个氨基酸序列[6-7],其能与GHRH结合,调节GHRH的促细胞增殖作用[8]。Barabutis等[9]将垂体型GHRHR和GHRHR-SV1转染到本身无这2个基因的MCF-7细胞系中,结果显示:与垂体型GHRHR比较,GHRHR-SV1能更强有力地促进细胞的增殖,提示GHRHR-SV1在肿瘤的发生发展过程中可能发挥重要作用,因此,为了进一步研究GHRHR-SV1的功能,根据GHRHR-SV1胞外区特异性抗原决定簇序列,本研究构建原核表达载体pET-GHRHR-SV1, 表达并纯化GHRHR-SV1蛋白,将其免疫家兔,制备兔多克隆抗体,检测抗体效价,并利用其检测肿瘤细胞中SV1蛋白的表达情况,为后续的肿瘤细胞机制研究奠定实验基础。
1 材料与方法 1.1 菌株、质粒和细胞大肠杆菌DH5α、BL21(DE3)和质粒pET-32a (+)保存于广州医科大学生化实验室,小鼠黑色素瘤细胞B16-F10购自美国ATCC细胞库。
1.2 实验动物、主要试剂和仪器新西兰雄性家兔2只,体质量为2 kg,购自广东省实验动物中心。限制性内切酶、DNA ligation kit、异丙基-β-D-硫代半乳糖苷(IPTG)和PCR试剂购自日本TaKaRa公司,凝胶回收和质粒提取试剂盒购自北京天根公司,His Bind Purification kit购自德国Novagen公司,HRP酶标羊抗兔二抗购自美国BD公司,ECL化学发光液购自上海碧云天公司。恒温摇床和恒温CO2培养箱购自美国Thermo公司,PCR仪、凝胶成像系统和蛋白电泳仪购自美国Bio-Rad公司,酶标仪Sunrise-Basie购自奥地利Tecan公司。
1.3 原核表达载体pET-GHRHR-SV1的构建设计GHRHR-SV1基因序列如下:5′-GGATCCATGGTTCCGGGCACCCCGTCTCC-TCTGCTGGGTCGTGGTAAAGAACTGTGGCT-GGAGTCCCTGGCGGCTCTGCCATACTGCCT-CGAG-3′,将该基因送往上海生工合成并将其连接于克隆载体PUC57,质粒命名为PUC-SV1。利用限制性内切酶BamHⅠ和XhoⅠ对质粒PUC-SV1和pET-32a (+)进行双酶切,反应产物经1.5%凝胶电泳鉴定, 确定大小正确后回收。采用T4连接酶将GHRHR-SV1和pET-32a (+)连接,将连接产物转化入感受态细胞DH5α中,重组菌采用pET-32a (+)通用引物进行菌落PCR及电泳鉴定,如果相应孔道318 bp处出现条带,则该重组菌为阳性克隆,将其送往公司测序。
1.4 GHRHR-SV1蛋白表达量的检测和条件优化将pET-GHRHR-SV1转化入感受态细胞BL21中,经菌液PCR鉴定后,将其转入LB液体培养基中,摇菌至吸光度(A)值约为0.8。
1.4.1 IPTG浓度不同时蛋白的表达量分别加入0、0.5、1.0、1.5和2.0 mmol·L-1 IPTG于37℃诱导表达蛋白4 h,SDS-PAGE电泳后经考马斯亮蓝染色,根据目的条带颜色的深浅来检测蛋白的表达量。
1.4.2 诱导时间不同时蛋白的表达量加入1.0 mmol·L-1IPTG,于37℃诱导1、2、4和6 h后,SDS-PAGE电泳后经考马斯亮蓝染色,根据目的条带颜色的深浅检测蛋白的表达量。
1.4.3 诱导温度不同时蛋白的表达量加入1.0 mmol·L-1 IPTG,分别在37℃、30℃和25℃下诱导4 h,SDS-PAGE电泳后经考马斯亮蓝染色,根据目的条带颜色的深浅来检测蛋白的表达量。
1.5 GHRHR-SV1蛋白的可溶性分析和纯化诱导蛋白表达后,收集菌体,分别冰浴超声20 min和1 h,超声结束后离心,取2组(20 min组和1h组)的上清和沉淀分别进行SDS-PAGE电泳后经考马斯亮蓝染色,根据目的条带颜色的深浅来检测蛋白的表达量。
通过可溶性分析可知蛋白以可溶形式存在,将超声破碎后所得的上清用滤膜过滤;将His·Bind树脂加入空色谱柱后,清洗、离子化和平衡色谱柱,再加入制备好的抽提物,流速为每小时10倍床体积,加入结合缓冲液,再加入漂洗缓冲液,最后加入洗脱缓冲液洗脱结合蛋白,洗脱液分段收集,将收集的洗脱液、空载体表达产物和纯化前的重组载体表达产物进行SDS-PAGE电泳后染色,在凝胶成像仪上扫描并进行灰度分析,计算目的条带灰度占总条带灰度的比例,从而获得蛋白的纯度。
1.6 ELISA法检测家兔血清中抗GHRHR-SV1的效价选取雄性家兔,抽取免疫前的血清作为阴性对照,背部多点皮下注射纯化后的蛋白,首次免疫量为1 mg,以后免疫用量为500 μg,加强免疫4次,第4次加强免疫1周后颈动脉放血收集多抗血清。首先用棋盘滴定法确定抗原抗体的最佳反应浓度,再用最佳蛋白浓度包被96孔板,4℃包被过夜,PBST洗板3次,用牛血清白蛋白(BSA)37℃封闭2 h,洗板。加入不同稀释度的兔多抗作为一抗,并将免疫前血清设为阴性对照,将PBS设为空白对照。加入HRP酶标羊抗兔二抗(1:5 000),37℃孵育1 h,洗板。加入TMB显色底物,显色5~20 min,待显色满意后加入等体积2 mmol·L-1 H2SO4终止反应,用酶标仪检测A (450)值,兔多抗与阴性血清A值的比值大于2.1即判为阳性。
1.7 Western blotting法检测B16-F10细胞中GHRHR-SV1蛋白的表达采用Western blotting法检测细胞中GHRHR-SV1蛋白的表达,RIPA裂解液裂解细胞后,将裂解物进行SDS-PAGE电泳,转膜至PVDF膜上,用含5%BSA的TBST封闭膜2 h, TBST洗膜3次, 加入封闭液稀释的兔多抗(1:1 000),4℃孵育过夜,TBST洗膜3次,加入封闭液稀释的HRP标记的羊抗兔二抗(1:5 000),室温孵育1 h,TBST洗膜3次,将膜用ECL化学发光,检测是否出现相对分子质量约为39 500的目的条带,如果出现则表示B16-F10细胞表达GHRHR-SV1蛋白。
2 结果 2.1 原核表达载体pET-GHRHR-SV1的构建质粒PUC-SV1和pET-32a (+)经双酶切后进行凝胶电泳鉴定,GHRHR-SV1基因大小约为91 bp,pET-32a (+)质粒大小约为5 860 bp,与预期结果一致(图 1A)。PCR法鉴定结果显示:阳性克隆可扩增出长度约为318 bp的目的条带(图 1B); 测序结果表明:GHRHR-SV1基因成功插入pET32a (+)中,并且三联密码子阅读框正确,成功构建了原核表达载体pET-GHRHR-SV1(图 1C)。
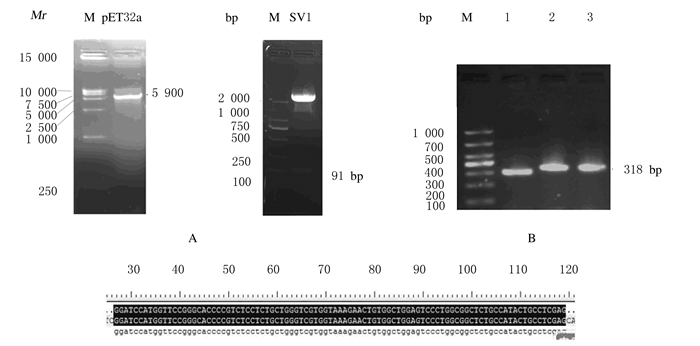
|
| A: Electrophoregram of PUC-SV1 and pET-32a (+) (M: DNA marker; SV1:Target gene; PET32a: Linearized plasmid); B:PCR identification (M: DNA marker; Lane 1:Control; Lane 2-3:PCR product of recombinant plasmid); C: DNA sequencing diagram. 图 1 原核表达载体pET-GHRHR-SV1的构建和鉴定 Figure 1 Construction and identification of prokaryotic expression vector pET-GHRHR-SV1 |
|
|
pET-32a (+)表达产物相对分子质量约为21 000,重组载体表达产物相对分子质量约为24 000。SDS-PAGE电泳结果表明:IPTG可诱导目的蛋白的表达,当IPTG浓度为2 mmol·L-1时,目的蛋白的表达量最高(图 2A);IPTG诱导蛋白表达2 h,蛋白表达量明显比1 h高,但超过2 h, 蛋白表达量无明显变化(图 2B)。当温度为25℃时,IPTG诱导重组菌表达目的蛋白量最大(图 2C)。
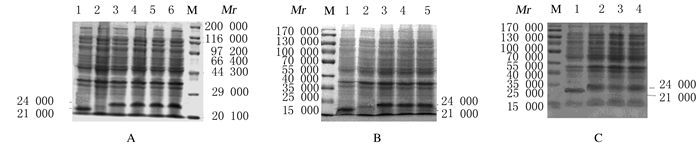
|
| A: Different dosages of IPTG (M: Protein molecular weight marker; Lane 1:Non-recombinant vector; Lane 2-6: 0, 0.5, 1.0, 1.5, and 2.0 mmol·L-1 IPTG); B: Different time (M: Protein molecular weight marker; Lane 1:Non-recombinant vector; Lane 2-5: 1, 2, 4, and 6 h); C: Different temperatures (M: Protein molecular weight marker; Lane 1:Non-recombinant vector; Lane 2-4:37℃, 30℃, and 25℃). 图 2 不同条件下GHRHR-SV1蛋白表达量电泳图 Figure 2 Electrophoregram of expressionamounts of GHRHR-SV1 protein under different conditions |
|
|
超声破碎1 h后, 目的蛋白在上清中的表达量比沉淀中多,提示目的蛋白主要以可溶形式存在(图 3A)。经His-Bind亲和层析柱纯化后,SDS-PAGE电泳结果显示:纯化的重组蛋白相对分子质量约为24 000,与预期相符,蛋白纯度约为80%(图 3B)。
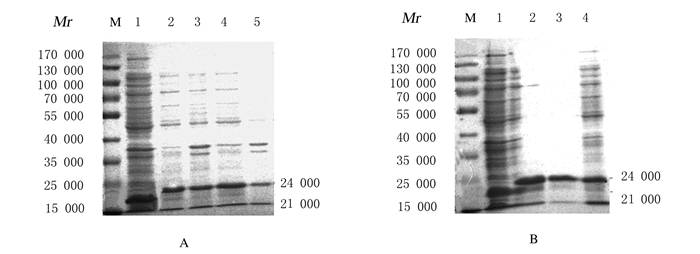
|
| A: Soluble form of GHRHR-SV1 protein (M: Protein molecular weight marker; Lane 1: Non-recombinant vector; Lane 2-3: Supernatant and precipitation at 20 min; Lane 4-5: Supernatant and precipitation at 1 h); B: Purification (M: Protein molecular weight marker; Lane 1: Non-recombinant vector; Lane 2-3:Purified fusion protein; Lane 4: Protein before purification). 图 3 GHRHR-SV1蛋白的可溶性分析和纯化电泳图 Figure 3 Electrophoregram of dissolved analysis and purification of GHRHR-SV1 protein |
|
|
GHRHR-SV1蛋白包被量为1.25 ng时,抗原抗体反应的线性关系较好。采用最佳蛋白浓度包被96孔板,不同稀释度的兔多抗作为一抗,出现阳性的抗体最高稀释度(即抗体效价)为1:1 600 000。见图 4和表 1。

|
| 图 4 ELISA法确定最佳抗原浓度 Figure 4 Optimal concentration of antigen tested by ELISA method |
|
|
| (n=3, x±s) | ||||||||
| Group | A (450) | |||||||
| 1:100 000 | 1:200 000 | 1:400 000 | 1:800 000 | 1:1 600 000 | 1:3 200 000 | 1:6 400 000 | No Ab | |
| Antiserum | 0.545±0.043 | 0.433±0.021 | 0.255±0.004 | 0.157±0.004 | 0.101±0.000 | 0.068±0.004 | 0.060±0.001 | 0.051±0.003 |
| Serum before immunity | 0.050±0.011 | 0.052±0.000 | 0.051±0.001 | 0.048±0.004 | 0.048±0.008 | 0.049±0.000 | 0.054±0.000 | 0.049±0.001 |
| P/N | + | + | + | + | + | - | - | - |
| “+”:Positive; “-”:Negative. | ||||||||
Western blotting法检测结果显示:在蛋白相对分子质量约为39 500处可见明显的条带,表明B16-F10细胞表达GHRHR-SV1蛋白(图 5)。
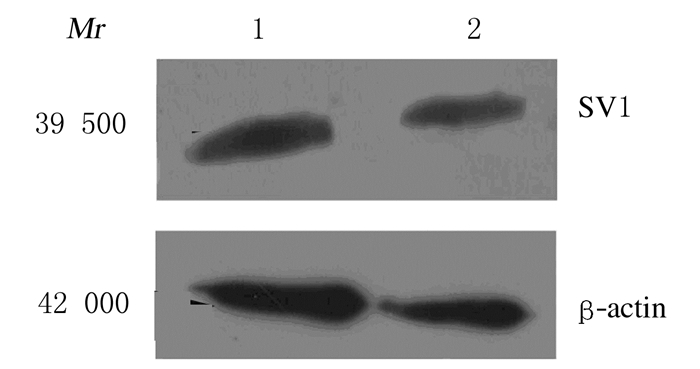
|
| Lane 1, 2:GHRHR-SV1 protein. 图 5 Western blotting法检测B16-F10细胞中GHRHR-SV1蛋白表达 Figure 5 Expressions of GHRHR-SV1 protein in B16-F10 cells detected by Western blotting method |
|
|
GHRHR只存在于垂体和极少数垂体外正常组织中,但目前研究表明GHRHR-SV1在多种肿瘤细胞中表达,Mezey等[10]发现GHRHR-SV1在人的恶性胶质瘤组织中表达;Fahrenholtz等[11]发现GHRHR-SV1在各种前列腺细胞系中高度表达。研究[12]显示:GHRHR-SV1主要是通过介导GHRH来促进细胞的增殖,从而参与肿瘤的发生发展过程。Kiaris等[13]研究发现:GHRHR-SV1在无GHRH参与的条件下也能促进细胞的增殖,但具体通过何种途径来发挥作用尚未阐明,有待进一步的研究。以SV1为靶点,开发新型抗肿瘤药物将是肿瘤防治研究的重要方向[14-15],本文作者推测采用SV1特异性抗体封闭GHRHR-SV1的作用可能也是拮抗肿瘤细胞增殖的有效手段。
GHRHR-SV1蛋白氨基端胞外区的25个氨基酸序列与垂体型GHRHR不同,本研究针对这25个氨基酸序列设计半抗原,根据半抗原氨基酸序列预算表达蛋白的相对分子质量约为3 000,属于相对分子质量较小的蛋白,不利于发挥免疫原性,为了加强免疫性并促进蛋白的稳定表达,将半抗原基因克隆至表达载体上,与载体自身包含的基因以融合蛋白的形式表达,得到相对分子质量约为24 000的融合蛋白。选用IDA His Bind树脂进行纯化,His-Tag组氨酸中咪唑基与Ni2+的螯合, 使蛋白得到纯化。多次多点免疫家兔制备兔多克隆抗体,ELISA法检测结果表明该抗体效价高,为1:1 600 000;采用ExPASy Molecular Biology Server软件预测细胞中GHRHR-SV1蛋白相对分子质量为39 500,采用该抗体检测出黑色素瘤细胞B16-F10表达GHRHR-SV1蛋白。本研究结果进一步验证了GHRHR-SV1蛋白在肿瘤细胞中的表达,为后续的抗肿瘤研究奠定了基础。
在后续的实验研究中,本课题组将采用该抗体进一步验证GHRHR-SV1在各种类型肿瘤细胞中的表达,并探究其对肿瘤细胞增殖的拮抗作用以及相关机制。
| [1] | Barabutis N, Schally AV. Growth hormone-releasing hormone:extrapituitary effects in physiology and pathology[J]. Cell Cycle, 2010, 9(20): 4110–4116. DOI:10.4161/cc.9.20.13787 |
| [2] | Mackrides N, Ganjei-Azar P, Perez R, et al. GHRH receptor expression in malignant mixed mullerian tumors:a potentially targetable biopredictor[J]. Int J Gynecol Pathol, 2016, 35(2): 142–146. DOI:10.1097/PGP.0000000000000229 |
| [3] | Theophanous E, Petraki C, Scorilas A, et al. The immunohistochemical expression of growth hormone-releasing hormone receptor splice variant 1 is a favorable prognostic marker in colorectal cancer[J]. Mol Med, 2009, 15(7/8): 242–247. |
| [4] | Dioufa N, Farmaki E, Schally AV, et al. Growth hormone-releasing hormone receptor splice variant 1 is frequently expressed in oral squamous cell carcinomas[J]. Horm Cancer, 2012, 3(4): 172–180. DOI:10.1007/s12672-012-0108-8 |
| [5] | Klukovits A, Schally AV, Szalontay L, et al. Novel antagonists of growth hormone-releasing hormone inhibit growth and vascularization of human experimental ovarian cancers[J]. Cancer, 2012, 118(3): 670–680. DOI:10.1002/cncr.26291 |
| [6] | Rekasi Z, Czompoly T, Schally AV, et al. Isolation and sequencing of cDNAs for splice variants of growth hormone-releasing hormone receptors from human cancers[J]. Proc Natl Acad Sci U S A, 2000, 97(19): 10561–10566. DOI:10.1073/pnas.180313297 |
| [7] | Toller GL, Horvath JE, Schally AV, et al. Development of a polyclonal antiserum for the detection of the isoforms of the receptors for human growth hormone-releasing hormone on tumors[J]. Proc Natl Acad Sci U S A, 2004, 101(42): 15160–15165. DOI:10.1073/pnas.0406348101 |
| [8] | Kiaris H, Chatzistamou I, Papavassiliou AG, et al. Growth hormone-releasing hormone:not only a neurohormone[J]. Trends Endocrinol Metab, 2011, 22(8): 311–317. DOI:10.1016/j.tem.2011.03.006 |
| [9] | Barabutis N, Tsellou E, Schally AV, et al. Stimulation of proliferation of MCF-7 breast cancer cells by a transfected splice variant of growth hormone-releasing hormone receptor[J]. Proc Natl Acad Sci U S A, 2007, 104(13): 5575–5579. DOI:10.1073/pnas.0700407104 |
| [10] | Mezey G, Treszl A, Schally AV, et al. Prognosis in human glioblastoma based on expression of ligand growth hormone-releasing hormone, pituitary-type growth hormone-releasing hormone receptor, its splicing variant receptors, EGF receptor and PTEN genes[J]. J Cancer Res Clin Oncol, 2014, 140(10): 1641–1649. DOI:10.1007/s00432-014-1716-1 |
| [11] | Fahrenholtz CD, Rick FG, Garcia MI, et al. Preclinical efficacy of growth hormone-releasing hormone antagonists for androgen-dependent and castration-resistant human prostate cancer[J]. Proc Natl Acad Sci U S A, 2014, 111(3): 1084–1089. DOI:10.1073/pnas.1323102111 |
| [12] | Barabutis N, Siejka A, Schally AV, et al. Activation of mitogen-activated protein kinases by a splice variant of GHRH receptor[J]. J Mol Endocrinol, 2010, 44(2): 127–134. DOI:10.1677/JME-09-0121 |
| [13] | Kiaris H, Chatzistamou I, Schally AV, et al. Ligand-dependent and -independent effects of splice variant 1 of growth hormone-releasing hormone receptor[J]. Proc Natl Acad Sci U S A, 2003, 100(16): 9512–9517. DOI:10.1073/pnas.1533185100 |
| [14] | Schally AV, Perez R, Block NL, et al. Potentiating effects of GHRH analogs on the response to chemotherapy[J]. Cell Cycle, 2015, 14(5): 699–704. DOI:10.1080/15384101.2015.1010893 |
| [15] | Schally AV, Varga JL. Antagonists of growth hormone-releasing hormone in oncology[J]. Comb Chem High Throughput Screen, 2006, 9(3): 163–170. DOI:10.2174/138620706776055449 |
 2016, Vol. 42
2016, Vol. 42


