扩展功能
文章信息
- 许德权, 卓龙泉, 张永昶, 赵玲
- XU Dequan, ZHUO Longquan, ZHANG Yongchang, ZHAO Ling
- 图像引导放疗技术在直肠癌患者术前调强放疗中的应用
- Application of image-guided radiation therapy technology in patients with rectal cancer treated with intensity modulated radiation therapy technology before operation
- 吉林大学学报(医学版), 2016, 42(06): 1226-1229
- Journal of Jilin University (Medicine Edition), 2016, 42(06): 1226-1229
- 10.13481/j.1671-587x.20160635
-
文章历史
- 收稿日期: 2016-09-12
近年来我国结直肠癌的发病率逐年上升,且直肠癌比结肠癌更常见。直肠癌术前同步放、化疗突破了传统的先手术后放、化疗的治疗理念,有效地降低了肿瘤负荷,减轻了放疗副反应,提高了手术保留肛门的概率,从而改善了患者的生活质量,因此在直肠癌治疗领域中越来越受到重视及认可。调强放疗技术(intensity modulated radiation therapytechnology,IMRT)在肿瘤放射治疗中被广泛应用,图像引导放疗技术(image-guided radiotherapy technology,IGRT)是一种四维放射治疗技术,其在三维放疗技术的基础上加入了时间因数的概念,考虑到了人体组织和器官在治疗过程中的生理运动和多次治疗间的摆位误差等因素,在患者进行治疗前、治疗中利用各种先进的影像设备对肿瘤及危及器官进行实时监控,通过对治疗床的调整及根据器官位置的变化调整治疗条件使照射野紧紧“追随”靶区,做到精确治疗[1-2],同时降低了危及器官因误差而导致的不必要照射,因此IGRT被广泛应用于肿瘤精确放疗中[3-5]。本研究对直肠癌术前放疗中IGRT相关数据给予统计分析,以了解IGRT在盆腔肿瘤治疗过程中的积极作用和临床价值。
1 资料与方法 1.1 一般资料收集2013年1月-2015年7月收治的在本院治疗并经病理结果证实、初诊无远处转移的直肠癌患者67例,男性4例,女性26例,男女比例为1.58:1;年龄为41~74岁,年龄 < 50岁者15例,年龄>50岁者52例,平均年龄为55岁,PS评分≤2分,所有患者放疗前均接受盆腔磁共振、肺CT、腹部及颈部彩超检查,根据第7版国际抗癌联盟(Union for International Cancer Control, UICC)及美国癌症联合会(American Joint Committee on Cancer, AJCC) TNM临床分期标准确立临床分期为Ⅱ~Ⅲ期(CT3-4N0M0或CT1-4N1-2M0), 其中Ⅱ期患者29例(ⅡA期14例,ⅡB期15例),Ⅲ期患者38例(ⅢA期14例,ⅢB期12例,ⅢC期12例)。
1.2 模拟定位和制订放疗计划CT模拟定位前1 h嘱患者排空膀胱,40~50 min内口服含有20 mL20%复方泛影普胺的温水800~1 000 mL,使小肠显影并充盈膀胱。所有患者均采用俯卧位,身下垫特制的有孔腹部定位板,使下腹部坠入孔内,双手置于额前,体部“U”形热塑膜固定体位。三维激光灯摆位,于热塑膜上标记“十”字线,采用德国西门子公司生产的SOMATOM sensation open24层大孔径CT模拟机定位扫描,层厚5 mm。重建三维图像后采用计算机网络将定位CT图像传输至特殊治疗计划系统(treament planning system,TPS),勾画靶区,依据国际辐射单位与测量委员会ICRU50号和ICRU62号文件的规定将相应靶区分别定义为肿瘤靶区(GTV)、临床靶区(CTV)、计划靶区(PTV)范围和靶区外扩范围[6-7],并在相应层面上勾画靶区及危及器官,靶区经本科室副主任以上高年资医师审核通过后,由物理师采用TPS制定术前静态IMRT放疗及动态调强放疗(volumetric modulated arc therapy,VMAT)计划,计算靶区剂量分布和危及器官的限量,计划审核通过后,经计算机网络传输至ELEKTA Synergy直线加速器,开始对患者进行放疗。
1.3 图像扫描和配准方法每次放疗前1 h患者均要求排空膀胱,然后口服800~1 000 mL水以重新充盈膀胱。采用有孔腹部定位板及定位时制作的“U”形热塑膜固定患者,由2名技师采用三维激光灯校对进行等中心摆位。摆位完成后采用ELEKTA图像引导系统XVI行锥形束CT扫描(CBCT扫描),采用CBCT影像采集参数:扫描角度为100°~260°,采用S20过滤板,相应的像素尺寸为0.100 cm空间分辨率。图像采集速度为5.5 frame·s-1,共363 frames。每例患者每次CBCT扫描时间约为1 min,扫描中心为等中心点,重建层厚为3 mm,建立三维重建图像。首次治疗经主治医师参与确定扫描参数、选择配准区域和配准方法。
图像配准方法:以CBCT和模拟CT图像的重合度为依据,观察相关解剖结构和感兴趣区是否达到重合要求。配准方法包括骨性配准、灰度值配准和手动配准,图像配准符合要求后,XVI系统自动计算出左右(x轴)、上下(y轴)和前后(轴)3个方向的位移误差及3个轴向旋转误差(图 1~4,见封三),本研究均采用三维重建图像和CT模拟定位计划图像进行灰度配准,获得2组影像在三维空间的对比位移误差,离线模式下分别记录位移误差,经影像配准、确认和校正误差后开始治疗(系统误差允许范围设置为0.5 cm)。见图 1。
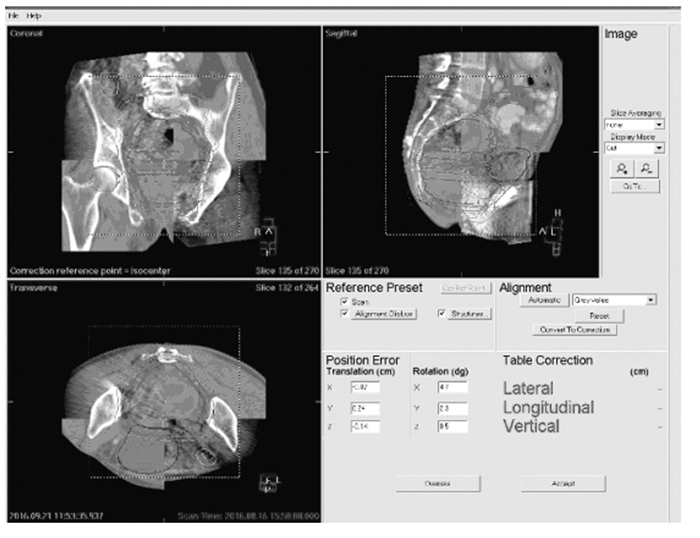
|
| 图 1 直肠癌患者在图像引导下行位置验证 Figure 1 Location of patients with rectal cancer guided by image |
|
|
采用SPSS 19.0统计软件进行统计学分析。根据Stroom等关于误差的计算方法,以患者每次摆位误差均值为个体系统误差,每次摆位误差标准差为个体随机误差;个体系统误差和随机误差均数分别定义为群体系统误差(Σ)和随机误差(σ)[6-7]。依据经典的Van-Herk等推算CTV到PTV的外放边界,即计划靶区扩边值(MPTV),MPTV=2.5Σ + 0.7σ [8-9]。校正前后获取的数值比较采用配对t检验。以ɑ=0.05为检验水准。
2 结果 2.1 摆位误差范围对67例直肠癌行术前IMRT和VMAT的患者每周行1次图像引导验证,治疗期间可完成5~6次图像引导,分析389个CBCT扫描图像,在x、y、z 3个轴位方向上的误差范围分别为(0.86~-1.13)、(1.94~-2.11)及(1.87~-1.81) cm。
2.2 系统误差、随机误差和旋转误差校正前x、y、z 3个轴位方向上的平移误差为(0.63±0.61)、(1.05±0.89)和(0.91±0.86) cm;旋转误差分别1.34°±0.97°、1.33°±1.21°和1.26°±1.30°;校正后分别为(0.23±0.22) cm、(0.56±0.49) cm、(0.47±0.46) cm及0.71°±0.69°、0.64°±0.75°、0.71±0.66°(均值表示该方向在图像引导校正后的空间位移偏差的均值,标准差表示该方向不同患者的空间位移的偏差)。校正后y轴和z轴上的平移误差小于校正前(t=3.541, P=0.001; t=3.275, P=0.000);校正后x轴和y轴上的旋转误差小于校正前(t=1.260, P=0.000; t=2.797, P=0.000)。校正前后x、y、z 3个轴位方向上的平移误差和旋转误差结果见表 1。
| (n=389, x±s) | |||||||
| kV-CBCT | Translation error (l/mm) | Rotation error (θ/°) | |||||
| x | y | z | x | y | z | ||
| Befroe correction | 0.63±0.61 | 1.05±0.89 | 0.91±0.86 | 1.34±0.97 | 1.33±1.21 | 1.26±1.30 | |
| After correction | 0.23±0.22 | 0.56±0.49 | 0.47±0.46 | 0.71±0.69 | 0.64±0.75 | 0.71±0.66 | |
| t | 3.308 | 3.541 | 3.275 | 1.260 | 2.797 | 3.442 | |
| P | 0.011 | 0.001 | 0.000 | 0.000 | 0.005 | 0.037 | |
在x、y和z3个轴位方向校正前MPTV分别为2.00、3.25和2.88 cm,校正后则为0.73、1.74和1.50 cm,分别减少了1.27、1.51及1.38 cm。
3 讨论对于临床分期为CT3N0M0或CT1-4N1-2M0的初治直肠癌患者,甚至不可手术切除的局部晚期直肠癌(CT4N0-2M0)和(或)并发可同时性切除转移灶的M1患者,均可行术前新辅助放化疗,不但可以增加手术切除率,而且可以增加保留肛门的概率,提高了患者的生活质量,减少了放射损伤[10]。
腹盆腔肿瘤放射治疗的可重复性和准确性是腹盆腔肿瘤精确放射治疗必要保证,适当的体位固定技术、组织器官及器官运动相对位置的控制可提高腹盆腔的放射治疗靶区精度。放疗过程中的摆位误差、组织器官的充盈程度和活动度等因素均可影响肿瘤靶区的相对位置,影响IMRT的精确性和可重复性。IGRT为精确放疗提供技术保障。采用IGRT时,可在治疗前采用锥形束CT获得患者每次治疗体位下的三维CT图像,将其与计划CT图像进行配准,可获得患者在三维方向上的摆位误差和旋转误差,通过移动治疗床或重新摆位来校正摆位误差[11]。实现IGRT的系统有多种,主图像配准的方式包括骨性配准、灰度值配准和手动配准[12]。灰度值配准是对配准框内的全部像素依据密度值的差异进行软件自动分析,用时1~3 min,主要适用于一些骨性组织较少的部位,如肺癌和肝胆部肿瘤等,或者一些骨性配准不能实现的情况。骨性配准是对配准框内的高密度区(密度与骨接近或大于骨)进行配准,1~2 s内即可完成,主要适用于靶区位置和骨性组织相对固定的部位,如头颈部和椎体等。手动配准为人工配准,是肉眼观察解剖结构和感兴趣区的重合情况进行调整,理论上手动配准方式考虑了不同解剖部位与临床情况,结果相对可靠,但需要有经验的医师在场,其主观性较强,不同操作者之间存在较大误差,一般不作为临床首选。本研究结果显示:头脚方向(y轴)的误差最大,其误差平均值和标准误值均最大,且其变化区间也最广,与相关文献[13-16]报道结果相符,其原因为每次摆位时,热塑膜与人体之间位置的重复性、膀胱和肠管等器官的充盈程度及运动位移不同所致,最大位移甚至出现了-2.11 cm以上的误差,即向脚一侧方向的位移最大;其次是前后方向(z轴)的误差较大,考虑为成人呼吸运动以腹式呼吸为主,呼吸幅度造成误差加大,同时也考虑为体表轮廓变化、体位旋转等因素所致;而左右方向(x轴)的误差较小。采用图像引导校正后,各方向误差得以纠正、归零,CBCT图像与模拟图像基本达到完全重合,达到了实际操作过程中的精确放疗目的。同时为临床医生设计PTV外放的数值提供了理论依据。
综上所述,应用IGRT可减少IMRT和VMAT的摆位误差,是精确放疗的有效质量保证,能够提高摆位精度,减少盆腔放疗中各种误差,提高疗效,为随后的精确放射治疗提供了极为重要的质量保证。
| [1] | Létourneau D, Wong JW, Oldham M, et al. Cone-beam-CT guided radiation therapy:technical implementation[J]. Radiother Oncol, 2005, 75(3): 279–286. DOI:10.1016/j.radonc.2005.03.001 |
| [2] | Boda-Heggemann J, Lohr F, Wenz F, et al. kV cone-beam CT-based IGRT:a clinical review[J]. StrahlentherOnkol, 2011, 187(5): 284–291. |
| [3] | Kilburn JM, Soike MH, Lucas JT, et al. Image guided radiation therapy may result in improved local control in locally advanced lung cancer patients[J]. Pract Radiat Oncol, 2016, 6(3): 73–80. DOI:10.1016/j.prro.2015.10.004 |
| [4] | Orisamolu A, Anderson N, Lin A. Setup uncertainty as determined by daily image guided radiation therapy (IGRT) for head-and-neck cancer (HNC):evaluation of safety and implications on defining planning target volume (PTV) margins[J]. Internat J Radiat Oncol Biolog, 2013, 87(2Suppl): 464–465. |
| [5] | Chung MJ, Lee GJ, Suh YJ, et al. Setup error and effectiveness of weekly image-guided radiation therapy of tomo direct for early breast cancer[J]. Cancer Res Treat, 2015, 47(7): 774–780. |
| [6] | Stroom JC, de Boer HC, Huizenga H, et al. Inclusion of geometrical uncertainties in radiotherapy treatment planning by means of coverage probability[J]. Int J Radiat Oncol Biol Phys, 1999, 43(4): 905–919. DOI:10.1016/S0360-3016(98)00468-4 |
| [7] | Stroom JC, Heijmen BJ. Geometrical uncertainties, radiotherapy planning margins, and the ICRU-62 report[J]. Radiother Oncol, 2002, 64(1): 75–83. DOI:10.1016/S0167-8140(02)00140-8 |
| [8] | van Herk M, Remeijer P, Lebesque JV. Inclusion of geometric uncertainties in treatment plan evaluation[J]. Int J RadiatOncolBiolPhys, 2002, 52(5): 1407–1422. |
| [9] | Gupta T, Chopra S, Kadam A, et al. Assessment of three-dimensional set-up errors in conventional head and neck radiotherapy using electronic portal imaging device[J]. Radiat Oncol, 2007, 2(6): 1–8. |
| [10] | Acevedo-Henao, Catalina M, Lopez Guerra, et al. Image-guided radiation therapy based on helical tomotherapy in prostate cancer:minimizing toxicity[J]. Oncol Res Treatment, 2014, 37(6): 324–330. DOI:10.1159/000362858 |
| [11] | 戴建荣, 胡逸民. 图像引导放疗的实现方式[J]. 中华放射肿瘤学杂志, 2006, 15(2): 132–135. |
| [12] | 曲颂, 朱小东, 李龄. 付国庆三种配准方式下腹部肿瘤IGRT摆位误差的比较[J]. 肿瘤防治研究, 2011, 38(12): 1434–1437. |
| [13] | 陈娜, 胡彩容, 吴君心, 等. 腹盆部肿瘤在放疗分次内的摆位误差分析[J]. 中国肿瘤, 2010, 19(8): 503–506. |
| [14] | 徐宏宇, 张军宁, 王建平, 等. 盆腔肿瘤图像引导放疗计划靶区外放的研究[J]. 实用医学杂志, 2014, 30(17): 2807–2808. |
| [15] | 周明友, 郑祖安. 影像引导技术在腹盆腔调强放疗中的应用[J]. 中国中西医结合影像学杂志, 2013, 11(4): 366–368. |
| [16] | Wu B, He J, Fu J, et al. Application of imaging-guided radiation therapy in pelvic tumor radiotherapy[J]. Zhongguo Yi Liao Qi XieZaZhi, 2015, 39(4): 299–301. |
 2016, Vol. 42
2016, Vol. 42


