扩展功能
文章信息
- 廖蕤堃, 邓小林, 曾丹妮, 吴晓凤, 文明
- LIAO Ruikun, DENG Xiaolin, ZENG Danni, WU Xiaofeng, WEN Ming
- SPIO-shRNA分子探针注射不同时间点荷瘤裸鼠肿瘤区域组织信号变化及MRI最佳扫描时间
- Changes of signals in tumor tissue of tumor-bearing nude mice after SPIO-shRNA molecular probe injection at different time points and optimal scanning time of MRI
- 吉林大学学报(医学版), 2016, 42(06): 1220-1225
- Journal of Jilin University (Medicine Edition), 2016, 42(06): 1220-1225
- 10.13481/j.1671-587x.20160634
-
文章历史
- 收稿日期: 2016-04-19
卵巢癌是女性生殖系统最常见的恶性肿瘤之一,早期发现并进行干预者生存率可达90%。但由于其早期临床症状不典型,且肿瘤位居盆腔深处,多数患者发现时已属晚期。影像学诊断在卵巢癌发现和预后评估中具有重要的价值,目前临床常用的方法主要为电子计算机断层扫描(CT)、磁共振成像(MRI)、正电子发射型计算机断层扫描(ECT)和单光子发射计算机断层成像(SPECT)等,但这些手段对于卵巢癌的早期诊断率仍然较低[1]。因此,寻找一种早期、特异性诊断卵巢癌的方法,是当今影像医学研究的热点。
分子影像学具有安全无创和原位实时检测等特点,在恶性肿瘤的早期诊断中具有极高的应用价值。在分子影像学研究中,制备特异性高的探针是其中的关键环节。在前期实验[2-3]中,本课题组采用RNAi理论,已成功制备出以多聚赖氨酸修饰的超顺磁性葡聚糖四氧化三铁纳米粒子(SPIO-PLL)作为MR阴性对比剂及载体,并与靶向卵巢癌表皮生长因子受体(epidermal growth for receptor, EGFR)基因的质粒pGenesil-1-shRNA相连接的新型分子探针,即SPIO-shRNA分子探针,随后还研究了该探针在活体内的药代动力学和主要脏器的分布特点。在此基础上,本研究主要将SPIO-shRNA分子探针应用于BALB/c荷瘤裸鼠活体MRI,观察不同时间点肿瘤区域组织信号变化趋势,并与病理结果相互印证,以期得到最佳的MRI扫描时间。
1 材料与方法 1.1 实验动物、分子探针、细胞株、主要试剂和仪器BALB/c裸鼠30只,雌性,4~6周龄,体质量(17±3) g,购自北京华阜康生物科技股份有限公司,动物许可号:SCXK (京)2014-0004,饲养由重庆医科大学动物实验中心(省部级共建重点实验室)完成。SPIO-shRNA分子探针由本课题组制备,并获得国家发明专利授权(专利号:ZL 201410064217.6);SKOV3卵巢癌细胞株(中科院上海细胞库)。细胞培养基RPMI-1640和胎牛血清(美国Gibico公司),0.25%胰蛋白酶(美国HYCLONE公司),戊巴比妥钠(德国Merck公司),核固红(武汉博士德公司),亚铁氰化钾(上海生物工程有限公司)。CO2恒温细胞培养箱(美国Thermo Forma公司),3.0T超导型MR成像仪及腕关节线圈(美国GE公司)。
1.2 SKOV3卵巢癌细胞株的培育和荷瘤裸鼠模型的建立参照本课题组成熟的细胞株培育方法[5],将SKOV3卵巢癌细胞株置于含有10%胎牛血清和RPMI-1640培养基常规培养(37℃、5%CO2孵箱),并选择对数生长期细胞,0.25%胰蛋白酶消化,收集至10mL离心管中,800 r·min-1离心5min,将无血清、无抗生素细胞悬液稀释至细胞浓度为5×107mL-1;分别于每只BALB/c裸鼠左后背部近左侧大腿区域皮下接种SKOV3卵巢癌细胞悬液约0.2 mL (含细胞数约为1×107个),定期观察裸鼠的生存状态、饮食及肿瘤生长情况,接种后(20±5) d,如瘤体直径大于1.0 cm,则提示荷瘤裸鼠建模成功,并用于后续实验。
1.3 采用SPIO-PLL-shRNA分子探针进行荷瘤裸鼠活体MRI扫描参照文献[5-6, 16]和大量反复预实验结果,最终确定本研究中用于荷瘤裸鼠MRI活体成像的反义探针剂量为18mg·kg-1。
经查阅文献[7, 11],不同探针用于MRI的扫描时间差异很大。将30只裸鼠随机分为6组,每组5只,本课题组通过前期动物药代动力学实验和反复预实验等,最终确立了6个扫描时间点,即分子探针注射前及注射后12、24、27、30和36 h,每个时间点扫描各组5只荷瘤裸鼠。
裸鼠腹腔内注入2%戊巴比妥钠麻醉后,将裸鼠置于自制泡沫板上,俯卧位,待其呼吸频率降低以便出现呼吸运动伪影最小时,置于腕关节线圈内,尾静脉注射分子探针,在设置好的时间点行MRI横断位及冠状位扫描。在参照文献[7]的基础上,经反复预实验并微调扫描参数,确定实验的具体参数:①T1WI快速自旋回波序列FSE,脉冲序列重复时间/回波时间(TE/TR)为85/300 MinFull, 冠状位FOV为11 cm,横断位FOV为6 cm,激励次数为3,层厚为2 mm,间距为0.5 mm,矩阵为320×224,翻转角为20°;②T2WI FSE:TE/TR为85/600ms,FOV为6 cm,激励次数为3,层厚为2 mm,矩阵为320×256,翻转角为17°;③T2*梯度回波(GRE):TE/TR为300ms/MinFull,FOV为6 cm,激励次数为3,层厚为2 mm,间距为0.5 mm,矩阵为320×256,翻转角为20°。
将扫描图像采集至GE AW 4.6工作站,分别测量裸鼠肿瘤及对侧肌肉组织的信号强度,统一以20 mm2的方形游标为感兴趣区(region of interest, ROI),选取最大层面测量3次,记录其平均值。
1.4 HE和普鲁士蓝染色观察裸鼠肿瘤组织和肌肉组织的形态表现每完成一个时间点扫描后,立即腹腔注入过量的2%戊巴比妥钠处死裸鼠,取肿瘤组织及接种肿瘤对侧相应区域肌肉组织,以10%缓冲甲醛溶液固定,48 h后行石蜡包埋切片、HE和普鲁斯蓝染色,光学显微镜下观察裸鼠肿瘤组织和肌肉组织的形态表现。
1.5 统计学分析采用SPSS19.0统计软件进行统计学分析。裸鼠肿瘤组织和肌肉组织T1WI FSE、T2WI FSE和T2*GRE信号强度以x±s表示,各时间点信号强度组间比较采用单因素方差分析,组间两两比较采用t检验。以α=0.05为检验水准。
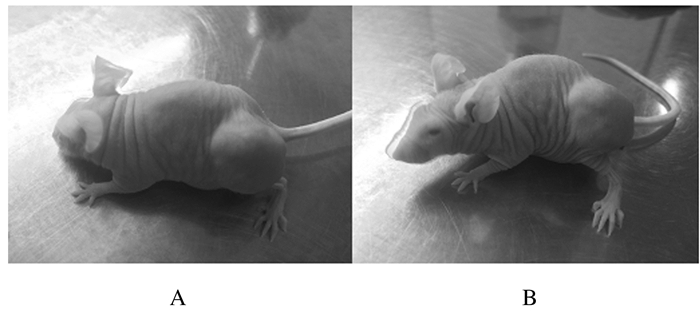
2 结果 2.1 培养不同时间裸鼠的生长情况对数期SKOV3卵巢癌细胞经皮下注射后(20±5) d,在无菌条件下培养,30只荷瘤裸鼠发育良好,质量为(22±3) g,瘤体长径均大于1 cm,瘤体色泽红润、形态规则,周边无明显红肿溃烂。见图 1。
|
| A:15 d after inoculation; B:20 d after inoculation. 图 1 接种不同时间荷瘤裸鼠的生长情况 Figure 1 Growth status of tumor-bearing nude mice at different time after inoculation |
|
|
裸鼠肿瘤组织T1WI FSE信号强度自12 h后开始增加,于27 h时达峰值,此时信号强度为813±19,随后信号强度缓慢下降,至36 h时恢复至注射前水平。与注射前比较,探针注射后12、24和27 h肿瘤组织信号强度均升高(P < 0.05)。与注射前比较,探针注射后36 h时信号强度减低,但组间比较差异无统计学意义(P>0.05)。对侧肌肉组织信号强度在注射探针后24 h时达峰值,随后下降至注射前水平,信号强度与注射前比较差异无统计学意义(P>0.05)。见图 2和表 1。

|
| 图 2 分子探针注射后不同时间点裸鼠肿瘤组织T1WI FSE信号强度图像(横断位) Figure 2 Diagram of signal intensities of T1WI FSE in tumor tissue of nude mice at different time points after injection of molecular probe (Axial) |
|
|
| (n=5, x±s) | ||||||
| Group | T1Wl FSE signal intensity | |||||
| Before injection | 12 h after injection | 24 h after injection | 27 h after injection | 30 h after injection | 36 h after injection | |
| Tumor tissue | 732±35 | 787±28* | 805±23* | 813±19* | 753±33 | 698±41 |
| Contralateral muscle tissue | 591±13 | 630±38 | 621±44 | 583±31 | 567±39 | 579±28 |
| *P < 0.05 vs before injection. | ||||||
裸鼠肿瘤组织T2WI FSE信号强度在注射探针12 h后开始下降,至27 h时达最低值,信号强度为247±43,此时可见皮下肿瘤组织信号强度明显降低,且与皮下脂肪层分界清楚,随后信号强度缓慢升高,于36 h上升至注射前水平。其中注射后12、24、27、30和36 h时T2WI FSE信号强度低于注射前(P < 0.05或P < 0.01),于27 h时较12、24、30和36h时信号强度降低更明显(P < 0.001)。裸鼠对侧肌肉组织信号强度注射探针后缓慢降低,24 h后开始回升,于27 h时恢复至注射前水平,此后信号强度维持在注射前水平。见图 3和表 2。

|
| A: Axial diagram; B: Coronal diagram. 图 3 分子探针注射后不同时间点裸鼠肿瘤组织T2WI FSE信号强度图像 Figure 3 Diagram of signal intensities of T2WI FSE in tumor tissues of nude mice at different time points after injection of molecular probe |
|
|
| (n=5, x±s) | ||||||
| Group | Signal intensity | |||||
| Before injection | 12 h after injection | 24 h after injection | 27 h after injection | 30 h after injection | 36 h after injection | |
| Tumor tissue | 774±40 | 679±21*△ | 496±34**△ | 247±43** | 360±31**△ | 612±21**△ |
| Contralateral muscle tissue | 218±22 | 204±10 | 196±18 | 224±19 | 214±27 | 222±25 |
| *P < 0.05, ** P < 0.01 vs before injection; △P < 0.01 vs 27 h after injection. | ||||||
探针注射12 h后,裸鼠肿瘤组织信号强度开始降低,以中心区域降低较明显,至27 h时达最低点,此时肿瘤组织区域信号强度(288±15)明显低于其余各时间点(P < 0.01),随后信号强度缓慢上升,36 h时信号强度升至稍低于注射前水平,其中12、24、27和30 h时T2*GRE信号强度低于注射前(P < 0.05或P < 0.01)。裸鼠对侧肌肉组织信号强度仅在注射后24 h降低,且与注射前比较差异有统计学意义(P < 0.05),随后逐渐上升至注射前水平,其余时间点T2*GRE信号强度与注射前比较差异无统计学意义(P>0.05)。见图 4和表 3。

|
| 图 4 分子探针注射后不同时间点裸鼠肿瘤组织T2*GRE信号强度图像(横断位) Figure 4 Diagram of signal intensities of T2*GRE in tumor tissue of nude mice at different time points after injection of molecular probe (Axial) |
|
|
| (n=5, x±s) | ||||||
| Group | Signal intensity | |||||
| Before injection | 12 h after injection | 24 h after injection | 27 h after injection | 30 h after injection | 36 h after injection | |
| Tumor tissue | 763±38 | 698±30*△ | 538±46**△ | 288±15** | 552±42**△ | 723±17△ |
| Contralateral muscle tissue | 561±28 | 578±11 | 398±40* | 516±40 | 570±29 | 592±30 |
| *P < 0.05, ** P < 0.01 vs before injection; △P < 0.01 vs 27 h after injcetion. | ||||||
在实验设置的各扫描时间点行HE染色观察,裸鼠肿瘤组织HE染色的结果均表现类似,均可见肿瘤组织结构紊乱,瘤细胞形态不规则,大小不一致,细胞核异型性较多,部分可见核分裂相改变;肌肉组织无明显变性、坏死等征象。见图 5(封三)。

|
| 图 5 HE染色观察肿瘤组织形态表现 Figure 5 Morphology of tumor tissue observed by HE staining |
|
|
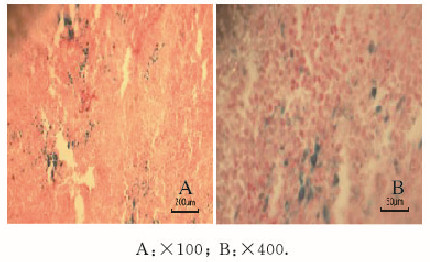
探针注射前,裸鼠肿瘤组织中未见明显蓝染Fe颗粒;在分子探针注射后的各扫描时间点,均可见肿瘤组织中存在蓝染Fe颗粒,且于注射探针后27 h时,蓝染Fe颗粒表达最丰富。而对照的肌肉组织中未见蓝染Fe颗粒。见图 6(封三)。
|
| 图 6 普鲁士蓝染色观察肿瘤组织中铁颗粒形态表现 Figure 6 Morphology of Fe particle in tumor tissue observed by Prussian blue staining |
|
|
本课题组前期工作[9-10]将卵巢癌表皮生长因子受体作为研究靶点,将葡聚糖修饰后的SPIO与多聚赖氨酸PLL相连接,形成SPIO-PLL复合物,成功构建针对表皮生长因子受体EGFR中短发夹RNA (shRNA)的SPIO-shRNA分子探针。根据RNA干扰理论,以核酸内切酶将细胞转录时产生的dsRNA片段切割成多个小片段shRNA,再与核酶复合物相结合,以沉默与shRNA同源的靶向mRNA (即卵巢癌过度表达的表皮生长因子受体),进而抑制卵巢癌肿瘤组织蛋白表达。和反义基因片段比较,小片段shRNA的特异性和稳定性更高,对肿瘤组织的抑制作用更完全。此外,本探针中所含的SPIO (Fe3O4/Fe2O3)能产生磁场效应,缩短组织的弛豫时间,在MRI扫描时可致T2WI和T2*GRE图像产生低信号改变[11]。所以,从理论上讲,将RNA干扰技术的特异性与SPIO敏感性相结合制备用于诊断卵巢癌的分子探针,可望从分子影像学水平早期特异性诊断卵巢癌。
前期实验结果及相关研究[3, 12]结果均显示:注射24 h后,分子探针主要分布于活体肝脏和脾脏中,在T2*GRE显示出信号减低;而普鲁士蓝染色结果表明:肝脏与脾脏组织中存在蓝染的Fe颗粒;这些数据为本研究设置扫描时间提供了依据。通过分析各时间点所获得的图像及信号强度,发现肿瘤组织T1WI信号强度在探针注射后27 h内呈轻度升高,27 h时达到峰值,随后逐渐降低至注射前水平,与Chen等[13]所观察到的结果相吻合,而探针注射后36 h时信号强度较注射前减低,其相关机制未见文献报道,有待进一步研究。肿瘤组织T2WI及T2*GRE信号强度在注射探针后24 h开始下降,27 h时下降到最低点,随后恢复至注射前水平,这与Quan等[14]所述结果一致。此外,肌肉组织T2*GRE信号强度虽有所变化,但与肿瘤组织中变化趋势不同,信号强度差别明显,在图像上能够得到较好的分辨率。相应各时间点的病理结果同样表明:肿瘤组织中均散在分布蓝染Fe颗粒,也从另外角度证实探针能够顺利进入肿瘤组织中,以注射后27 h聚集的Fe颗粒最多,与MRI图像上观察到的结果一致。病理检查结果表明:肝脏和脾脏组织中存在少量Fe颗粒,由此可以推断本课题组制备的纳米级分子探针(平均粒径为7.37 nm)[17]能够基本逃避网状内皮系统的吞噬,易于透过血管及组织间隙,成功富集于肿瘤组织中。本研究结果表明:SPIO-shRNA分子探针中的SPIO成功标记于针对EGFR的shRNA上,在通过静脉注射后,能够经由血液循环系统富集于肿瘤组织中,仅少量潴留于肝脏和脾脏组织,达到了预期的实验目的。
本研究结果表明:SPIO-shRNA分子探针用于活体荷瘤裸鼠的最佳扫描时间为注射探针后27 h。由于实验设备和各方面条件因素所限,探针注射后时间间隔较大,期间可能存在更加准确的扫描时间,待后续实验进一步完善。在随后的实验中,本课题组将进一步针对探针的最佳扫描浓度、最佳扫描序列和抑瘤剂量等进行研究。
| [1] | Starmans LW, Burdinski D, Haex NP, et al. Iron oxide nanoparticle-micelles (ION-micelles) for sensitive (molecular) magnetic particle imaging and magnetic resonance imaging[J]. PLoS One, 2013, 8(2): e57335. DOI:10.1371/journal.pone.0057335 |
| [2] | 文曦琳, 李易, 葛晓东, 等. 卵巢癌特异性MR分子探针的制备[J]. 基础医学与临床, 2014, 34(11): 1463–1467. |
| [3] | 邓小林, 葛晓东, 吴晓凤, 等. SPIO-shRNA双功能分子探针药动学及活体MR成像研究[J]. 药学学报, 2015(10): 1285–1289. |
| [4] | 文曦琳, 李易, 葛晓东, 等. SPIO-PLL-pshRNA分子探针转染卵巢癌SKOV3细胞及MR成像研究[J]. 重庆医科大学学报, 2014(4): 506–510. |
| [5] | 葛晓东, 李妹玲, 邓小林, 等. 外加磁场对SPIO-shRNA分子探针转染卵巢癌SKOV3细胞的影响[J]. 中国医学科学院学报, 2015, 37(1): 12–16. |
| [6] | 温志鹏, 刘海燕, 文明, 等. SPIO标记的c-erbB2反义探针用于活体荷瘤裸鼠MRI的最佳扫描浓度[J]. 南方医科大学学报, 2013, 33(4): 496–501. |
| [7] | 温志鹏, 刘海燕, 文明, 等. SPIO标记的c-erbB2反义探针用于活体荷瘤裸鼠MR的最佳扫描时间探讨[J]. 四川大学学报:医学版, 2013, 44(5): 708–712. |
| [8] | 张松.CD105靶向金磁纳米粒的合成及其对乳腺癌血管生成的MRI和CT实验研究[D].重庆:第三军医大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-90031-1014360073.htm |
| [9] | Burnett J, Rossi J. RNA-based therapeutics:current progress and future prospects[J]. Chem Biol, 2012, 19(1): 60–71. DOI:10.1016/j.chembiol.2011.12.008 |
| [10] | Farra R, Grassi M, Grassi G, et al. Therapeutic potential of small interfering RNAs/micro interfering RNA in hepatocellular carcinoma[J]. World J Gastroenterol, 2015, 21(30): 8994–9001. DOI:10.3748/wjg.v21.i30.8994 |
| [11] | Michele W, Wenlian Z, Mohammad H, et al. Magnetic resonance imaging contrast of iron oxide nanoparticles developed for hyperthermia is dominated by iron content[J]. Int J Hyperthermia, 2014, 30(3): 192–200. DOI:10.3109/02656736.2014.913321 |
| [12] | Shahbazigahrouei D, Abdolahi M. Detection of MUC1-expressing ovarian cancer by C595 monoclonal antibody-conjugated SPIONs using MR imaging[J]. Scientif World J, 2013, 2013(6): 609151. |
| [13] | Chen Z, Xiao EH, Kang Z, et al. In vitro and in vivo magnetic resonance imaging with chlorotoxin-conjugated superparamagnetic nanoprobes for targeting hepatocarcinoma[J]. Oncol Rep, 2016, 35(5): 3059–3067. |
| [14] | Quan G, Du X, Huo T, et al. Targeted Molecular Imaging of Antigen OC183B2 in Ovarian Cancers Using MR Molecular Probes[J]. Academ Radiol, 2010, 17(12): 1468–1476. DOI:10.1016/j.acra.2010.07.006 |
| [15] | Casettari L, Vllasaliu D, Lam JKW, et al. Actively-targeted LTVSPWY peptide-modified magnetic nanoparticles for tumor imaging[J]. Int J Nanomed, 2012, 7(2): 3981–3989. |
| [16] | Daryoush SG, Mohammad A. Superparamagnetic iron oxide-C595:Potential MR imaging contrast agents for ovarian cancer detection[J]. J Med Phys, 2013, 38(4): 198–204. DOI:10.4103/0971-6203.121198 |
| [17] | 李易, 文曦琳, 孙红武, 等. 超顺磁性氧化铁(SPIO)与多聚赖氨酸(PLL)纳米粒的制备、结构验证及其空间结构表征[J]. 复旦学报:医学版, 2014, 41(3): 309–314. |
 2016, Vol. 42
2016, Vol. 42


