扩展功能
文章信息
- 文爱平, 汪海娇, 金景姬, 蔡勇, 朱继红, 谌伦华
- WEN Aiping, WANG Haijiao, JIN Jingji, CAI Yong, ZHU Jihong, CHEN Lunhua
- 子宫内膜癌组织中hMOF蛋白和mRNA表达及其临床意义
- Expressions of hMOFprotein and mRNA in endometrial cancer tissue and their clinical significances
- 吉林大学学报(医学版), 2016, 42(06): 1138-1142
- Journal of Jilin University (Medicine Edition), 2016, 42(06): 1138-1142
- 10.13481/j.1671-587x.20160617
-
文章历史
- 收稿日期: 2016-01-30
2. 吉林大学第一医院妇产科, 吉林 长春 130021;
3. 吉林大学生命科学院表观遗传学教研室 艾滋病国家重点实验室, 吉林 长春 130012;
4. 吉林大学 第一医院生殖中心, 吉林 长春 130021
2. Department of Obstetrics and Gynecology, First Hospital, Jilin University, Changchun 130021, China;
3. National Key Laboratory of Acquired Immune Deficiency Syndrome, Department of Epigenetics, School of Life Sciences, Jilin University, Changchun 130012, China;
4. Reproductive Medicine Center, First Hospital, Jilin University, Changchun 30021, China
目前学术界普遍认为肿瘤是基于各种致瘤因子作用导致DNA突变而产生,但现有研究[1]显示某些肿瘤的发生发展可能不涉及DNA序列的改变,而与表观遗产学DNA的修饰密切相关。表观遗传学主要研究在DNA序列不发生改变的情况下,基因表达或细胞显型的变化,通过对相关基因表达的调控而参与肿瘤的发生发展,目前已知的变化有DNA甲基化、基因组印记、染色组重塑和母体效应等,其中组蛋白的修饰改变是参与细胞调控和基因表达的重要内容,例如组蛋白的甲基化、乙酰化对DNA的特定调节进而对生物体的基因表达产生影响[2-6]。组蛋白乙酰化是表观遗传学研究的重要内容,乙酰化酶hMOF蛋白通过对组蛋白3、4(H3/H4)赖氨酸氨基端的作用,在核苷酸复制、修复、转录过程中和染色组重塑过程中起关键作用,hMOF蛋白的表达水平与肿瘤的发生密切相关。子宫内膜癌是女性常见的生殖道恶性肿瘤,其中以子宫内膜腺癌最为常见,近年来其发病率在世界范围内呈上升趋势,美国2010年约有43 470人被诊断为子宫内膜腺癌,其中约7 950人死亡[7]。中国尚无确切的统计数据,但有国内学者[8]统计:北京和上海等地近20年子宫内膜癌发病率明显上升,成为严重危害女性健康的恶性肿瘤疾病,但子宫内膜腺癌的具体发病机制尚不清楚。本课题组前期研究[2]结果表明子宫内膜腺癌的发病与组蛋白乙酰化酶hMOF蛋白有关联。本研究采用免疫组织化学染色和RT-PCR技术进一步研究hMOF蛋白及基因在子宫内膜腺癌组织中的表达情况,旨在探讨两者间的关系及临床意义。
1 资料与方法 1.1 组织标本采集收集2013-2014年川北医学院附属医院手术切除并经术后病理证实为子宫内膜腺癌(38例)和子宫肌瘤行全子宫切除患者的正常子宫内膜(20例)组织,取其部分新鲜组织储存于液氮中或保存为石蜡切片。患者年龄38~76岁,平均年龄为(54.0±8.3)岁。根据国际妇产科联盟(FIGO)分期(2009)标准,38例子宫内膜腺癌患者Ⅰ期16例,Ⅱ期14例,Ⅲ~Ⅳ期8例。根据世界卫生组织(WHO)标准,高分化子宫内膜腺癌(G1)15例,中分化(G2)14例,低分化(G3)9例。
1.2 免疫组织化学染色检测子宫内膜癌和正常子宫内膜组织中hMOF蛋白表达采用免疫组织化学SP染色法进行实验,hMOF单克隆一抗购于美国ORIGNEN公司(编码TA315899),石蜡切片于枸橼酸盐液中进行修复,hMOF抗体稀释比例为1:250,其余步骤按照SP试剂盒说明书完成。以磷酸盐缓冲液(PBS)作为阴性对照,已知阳性组织结果为阳性对照。
1.3 RT-PCR法检测子宫内膜癌和正常子宫内膜组织中hMOF基因的表达取储存于液氮中的癌组织和正常内膜组织,采用Biozol RNA试剂盒(美国Bimiga公司)分别提取上述组织中的RNA,检测其浓度,后用cDNA试剂盒(上海研拓生物科技公司)逆转录总RNA为cDNA,存于-30℃待用,设定带有荧光标记hMOF基因引物,引物序列及PCR产物长度见表 1。引物由上海旭冠生物科技发展有限公司合成,以GAPDH为内参。PCR反应步骤及条件:SYBR Green 12.5μL,浓度为2mmol ·L-1的引物各2.5 μL,dH2O 4.5 μL,cDNA模板3.5 μL (3×10-6 g·L-1),共30个循环,变性92℃、40 s,退火63℃、40 s,延伸70℃、40 s,内参GAPDH共30个循环;变性93℃、40 s,退火63℃、40 s,延伸72℃、40 s。
| Gene | Primer sequence | Product length (bp) |
| hMOF | F′:5′-GAAGTCACGGTGGAGATC-GGA-3′ R′:5′-CTTGGCCAGCAGACACGG-TT-3′ |
220 |
| GAPDH | F′:5′-ATGGGTCAGAAGAATTCCT-ATGT-3′ R′:5′-AGCCACACGCAGCTCATT-3′ |
170 |
免疫组织化学SP法以细胞核中出现棕黄色染色颗粒作为阳性细胞判定标准,高倍镜(×200)下随机选取4~5个视野。参照Soslow等[9]的方法,依据阳性细胞百分率和染色强度双重判定标准进行评分,再将两者评分乘积作为最终评分进行统计学分析。阳性细胞百分率:阳性细胞的百分率<10%为0分,10%≤百分率≤30%为1分,31%≤百分率≤50%为2分,51%≤百分率≤75%为3分,百分率>75%为4分;染色强度:基本不染色或未染色为0分,浅染色为1分,中染色为2分,强染色为3分;两者乘积0分为阴性(-),1~4分为弱阳性(+),5~8分为阳性(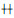

按照说明书配制其反应体系,hMOF检测以GAPDH为内参基因,加入组织cDNA后在实时PCR仪上进行实验,目的基因的表达量=2-ΔΔCt(ΔΔCt:对照组目的基因Ct值即对照组内参基因Ct值,实验组目的基因Ct值即实验组内参基因Ct值),ΔCt1=对照组hMOFCt值-对照组GAPDH值,ΔCt2=实验组hMOFCt值-实验组GAPDH值,ΔΔCt=ΔCt2-ΔCt1。
1.5 统计学分析采用SPSS17.0统计软件进行统计学分析。子宫内膜癌组织和正常子宫内膜组织中hMOF阳性表达率、不同临床病理特征子宫内膜内膜癌组织中hMOF阳性表达率和正常子宫内膜组织以及子宫内膜癌组织中hMOF mRNA表达水平上调者所占比率的比较采用χ2检验。以α=0.05为检验水准。
2 结果 2.1 子宫内膜腺癌组织和正常子宫内膜组织中hMOF蛋白阳性表达率子宫内膜腺癌组织中hMOF蛋白阳性表达率明显低于正常子宫内膜组织(P=0.037),见图 1(插页四)和表 2。不同临床病程特征患者中,子宫内膜腺癌的临床病理分期和组织分化程度不一者其hMOF蛋白阳性表达率比较差异具有统计学意义(χ2=6.591, P=0.037;χ2=7.351, P=0.025),但不同年龄患者其hMOF蛋白阳性表达率比较差异无统计学意义(χ2=0.000,P=1.000)。见表 3。

|
| A-C:Cancer tissue (G1-G2);D-F:Normal endometrial tissue. 图 1 hMOF蛋白在子宫内膜腺癌和正常组织中的表达(HE,×200) Figure 1 Expressions of hMOF protein in endometrial adenocarcinoma tissue and normal endometrial tissue (HE, ×200) |
|
|
| Group | n | <1 point (-) | 1-4 points (+) | 5-8 points (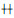 ) ) |
9-12 points ( ) ) |
Positive expression rate (η/%) | P |
| Normal tissue | 20 | 3 | 6 | 8 | 3 | 85.0 | 0.037 |
| Cancer tisuue | 38 | 16 | 13 | 6 | 3 | 57.8 |
| Clinical characteristic | n | <1point (-) | 1-4 points (+) | 5-8 points (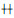 ) ) |
9-12 points ( ) ) |
Postiveexpression rate (η/%) | χ2 | P |
| Age (year) | ||||||||
| ≥45 | 2 | 9 | 6 | 3 | 3 | 57.1 | 0.000 | 1.000 |
| <45 | 17 | 7 | 5 | 4 | 1 | 58.8 | ||
| FIGO stage | ||||||||
| Ⅰ | 16 | 3 | 5 | 4 | 4 | 81.2 | 6.591 | 0.037 |
| Ⅱ | 10 | 4 | 2 | 2 | 2 | 60.0 | ||
| Ⅲ-Ⅳ | 12 | 8 | 2 | 1 | 1 | 33.3 | ||
| Pathological grade | ||||||||
| G1 | 15 | 4 | 4 | 4 | 3 | 73.3 | 7.351 | 0.025 |
| G2 | 10 | 6 | 1 | 2 | 1 | 40.0 | ||
| G3 | 13 | 10 | 1 | 1 | 1 | 23.1 | ||
在16例子宫内膜癌组织中有14例hMOF mRNA基因表达下调(87.5%,14/16),仅2例表达上调(12.5%,2/16);16例正常子宫内膜组织中仅5例hMOF mRNA表达下调(31.25%,5/16),11例表达上调(68.75%, 11/16),在子宫内膜癌组织中hMOFmRNA表达上调者所占比率较正常子宫内膜组织明显降低(P=0.003),见图 2。

|
| Lane 1, 3, 5:Normal endometrial tissue; Lane 2, 4, 6:Endometrial cancer tissue (high, moderate, andlow differentiation). 图 2 不同分化程度子宫内膜癌和正常子宫内膜组织中hMOF mRNA表达电泳图 Figure 2 Electrophoregram of expressions of hMOF mRNA in endometrial cancer tissues with different differentiation degrees and normal endometrial tissue |
|
|
组蛋白乙酰化是组蛋白修饰的重要内容之一,目前研究[9-12]显示其广泛参与细胞周期调控、DNA修复和染色质重塑等重要过程。hMOF蛋白是参与组蛋白乙酰化过程的主要成员之一,通过作用于组蛋白4上第16位赖氨酸残端(H4K16Ac)使其乙酰化而发挥其生物功能,hMOF在果蝇体内被发现,且与哺乳动物和人有极高同源性,提示在生物进化中高度保守,且具有不可替代地位[10-11],Smith等[12]与Taipale等[3]通过siRNA敲出hMOF基因后发现组蛋白4上第16位氨基酸乙酰化明显下降甚至彻底消失,进而佐证了hMOF参与及调控组蛋白4第16位赖氨酸的乙酰化。对肿瘤细胞进一步研究[13-14]显示:在恶性肿瘤细胞中H4K16Ac水平明显减少,且该变化多集中于非甲基化的DNA重复区域,而该低甲基化的状态常与染色体不稳定性呈正相关关系,近年研究[14]显示:在正常组织中hMOF蛋白与H4K16Ac呈正常表达,而在肿瘤组织中表达明显降低。Stefan等[5]在检测乳腺癌及神经细胞瘤与其正常对照组织发现:在肿瘤组织中hMOF蛋白和mRNA表达水平均较正常组织明显下调;通过对患者长期随访发现:患者远期生存率与hMOF表达水平呈正相关关系。迟长亮等[6]研究证实:肾细胞癌组织中hMOF的表达较正常组织明显降低,且hMOF的表达与肿瘤临床分期、大小、淋巴癌浸润以及远期生存率有明显相关性。Cai等[15]通过对卵巢癌组织和正常卵巢组织分析显示:hMOF mRNA和蛋白的表达在卵巢上皮癌组织中明显降低。此外,hMOF蛋白表达与卵巢癌的分期密切相关。Zhang等[16]对hMOF抑制肝细胞癌生长的研究发现:hMOF蛋白可抑制体外和体内肝细胞癌的生长,同时hMOF蛋白表达降低。Zhu等[17]通过研究hMOF蛋白和基因与胃癌患者的关系发现:胃癌患者hMOF阳性者5年总生存率较阴性者明显升高。
研究[18-19]显示:子宫内膜癌经恰当的治疗后,5年总生存率是80%,其中超过75%患者为早期患者,美国癌症学会数据统计显示:子宫内膜癌早期5年生存率可高达90%,而晚期生存率低至15%,即患者长期生存率与其临床分期密切相关,本研究结果显示:癌组织中hMOF基因和蛋白的表达水平明显低于正常子宫内膜组织,hMOF基因及蛋白在子宫内膜癌组织中呈低表达;hMOF蛋白表达水平与患者年龄无明显关联,在组织分化程度不同癌组织中其表达具有差异性,组织分化程度越差,hMOF表达水平越低;临床病理分期越晚,hMOF蛋白表达水平越低,低分化(G3)与临床病理晚期(Ⅲ-Ⅳ)患者的hMOFmRNA表达水平明显降低,这与Stefan等[5]和迟长亮等[6]研究结果相似,即子宫内膜癌组织中hMOF蛋白和mRNA表达水平均较正常组织明显降低,且在临床分期越晚以及组织分化越差的内膜癌组织中其表达降低更明显,提示hMOF在子宫内膜癌组织中的表达与其临床病理分期、组织分化程度及有无淋巴转移呈负相关关系,提示子宫内膜癌患者的治疗反应及长期无瘤生存率与hMOF蛋白及基因具有关联性,与hMOF在乳腺癌、神经细胞瘤、肾癌、胃癌和肝细胞癌等组织中的表达研究结果类似,说明hMOF蛋白和基因可能通过一定的机制参与调控子宫内膜癌的发生发展,其可能作为判断内膜癌严重程度的生物学指标以及为子宫内膜癌生物靶向治疗提供新的靶点。
本研究结果显示:子宫内膜癌,尤其是低分化子宫内膜癌和临床分期Ⅲ-Ⅳ期患者的hMOF蛋白表达水平明显降低,提示hMOF蛋白可能成为判断子宫内膜癌分级、临床分期以及预后的生物学标志。hMOF可能通过对H4K16Ac水平的调控,在子宫内膜癌的发生发展中发挥重要作用;对于hMOF蛋白在子宫内膜癌发病中的确切作用机制尚不清楚,需更进一步研究。鉴于缺失多样本、多中心实验结果,且本实验纳入的组织数量较少,部分患者随访时间不充分,尚不能通过多变量回归性分析方法确定hMOF蛋白判定子宫内膜癌预后的有效性,需要更多研究加以证明。
| [1] | Bird A. Perceptions of epigenetics[J]. Nature, 2007, 447(7143): 396–398. DOI:10.1038/nature05913 |
| [2] | 文爱平, 汪海娇, 罗乐, 等. hMOF蛋白在子宫内膜癌组织的表达及其临床意义[J]. 中国实验诊断学, 2011, 15(10): 1648–1651. |
| [3] | Taipale M, Rea S, Richter K, et al. hMOF histone acetyltransferase is required for histone H4lysine 16 acetylation in manmalian cells[J]. Mol Cell Biol, 2005, 25(15): 6798–6810. DOI:10.1128/MCB.25.15.6798-6810.2005 |
| [4] | Ehrlich M. DNA methylation in cancer:too much, but also too little[J]. Oncogene, 2002, 21(35): 5400–5413. DOI:10.1038/sj.onc.1205651 |
| [5] | PfisterS, ReaS, MikkoJ, et al. The histone acetyltrsanferase hMOF is frequently-downregulated in primarybreast carcinoma and medulloblastoma[J]. Int J Cancer, 2008, 122(6): 1207–1213. |
| [6] | 迟长亮, 芦志华, 管旌旌, 等. 组蛋白乙酰化酶hMOF在肾透明细胞癌组织中的表达及其临床意义[J]. 吉林大学学报:医学版, 2012, 38(2): 303–307. |
| [7] | Jemal A, Siegel R, Xu J, et al. Cancer statistics[J]. CA Cancer J Clin, 2010, 60(5): 277–300. DOI:10.3322/caac.20073 |
| [8] | 杨丹, 韩立敏. 1969-2003年子宫内膜癌发病率及发病因素分析[J]. 复旦大学学报:医学版, 2005, 32(4): 479–481. |
| [9] | Soslow RA, Dannenberg AJ, Rush D, et al.Cox-2 is expressed in human pulmonary, colonic, and mamary tumor[J].2000, 89(12):2637-2645. |
| [10] | Mendija S, Taipale M, Kind J, et al. Nuclear pore components are involved in the transcriptional regulation of dosage compensation in Drosophila[J]. Mol Cell, 2006, 21(6): 811–823. DOI:10.1016/j.molcel.2006.02.007 |
| [11] | Akhtar A, Becker PB. Activation of transcripition through histone H4 acetylation by MOF, an acetyltransferase essential fou dosage compensation in Drosophila[J]. Mol Cell, 2000, 5(2): 367–375. DOI:10.1016/S1097-2765(00)80431-1 |
| [12] | Smith ER, Pannuti A, Gu W, et al. The Drosophila MSL complex acetylates histone H4 at lysine 16, a chromatin modificaton linked to dosage compensation[J]. Mol Cell Biol, 2000, 20(1): 312–318. DOI:10.1128/MCB.20.1.312-318.2000 |
| [13] | Fraga MF, Ballestar E, Villar-Garea A, et al. Loss of acetylation at Lys16 and trimethylation at Lys20 of histone H4 is a common hallmark of human cancer[J]. Nat Genet, 2005, 37(4): 391–400. DOI:10.1038/ng1531 |
| [14] | Eden A, Gaudet F, Waghmare A, et al. Chromosomal instability and tumors promoted by DNA hypomethylation[J]. Science, 2003, 300(5618): 455. DOI:10.1126/science.1083557 |
| [15] | Cai M, Hu Z, Gao J, et al. Expression of hMOF in different ovarian tissues and its effects on ovarian cancer prognosis[J]. Oncol Rep, 2015, 33(2): 683–692. |
| [16] | Zhang J, Liu H, Pan H, et al. The histone acetyltransferase hMOF suppresses hepatocellular carcinoma growth[J]. Biochem Biophy Res Commun, 2014, 452(2): 575–580. |
| [17] | Zhu L, Yang L, Yu X, et al. Expression of hMOF, but not HDCA4, is responsible the global histone H4K16 acetylation in gastric carcinoma[J]. Int Oncol, 2015, 46(6): 2535–2545. |
| [18] | Nicolaijie KA, Nicole PM, EzednmPQ, et al. Follow-up practice in endometrial cancer and the association with patient and hospital characteristic[J]. Gynecol Oncol, 2013, 129(2): 324–331. DOI:10.1016/j.ygyno.2013.02.018 |
| [19] | Oldenburg CS, Dorry Boll, Kim AH, et al. The relationship of body mass index with quality of life among endometrial cancer survivous:a study from the population-based PROFILES registry[J]. Gynecol Oncol, 2013, 129(1): 216–221. DOI:10.1016/j.ygyno.2012.12.041 |
 2016, Vol. 42
2016, Vol. 42


