扩展功能
文章信息
- 雷洁, 邱爽, 刘仕成, 彭博, 李日, 白烨, 刘雅文, 于雅琴, 朱筱娟, 姜慧轶
- LEI Jie, QIU Shuang, LIU Shicheng, PENG Bo, LI Ri, BAI Ye, LIU Yawen, YU Yaqin, ZHU Xiaojuan, JIANG Huiyi
- PLA2G12A基因多态性与中国北方汉族儿童孤独症谱系障碍的关联性分析
- Analysis on association between PLA2G12A polymorphisms and autism spectrum disorder of Han nationality children in North China
- 吉林大学学报(医学版), 2016, 42(06): 1132-1137
- Journal of Jilin University (Medicine Edition), 2016, 42(06): 1132-1137
- 10.13481/j.1671-587x.20160616
-
文章历史
- 收稿日期: 2016-05-05
2. 吉林大学公共卫生学院流行病与卫生统计学教研室, 吉林 长春 130021;
3. 吉林大学第一医院儿科, 吉林 长春 130021;
4. 东北师范大学生命科学学院 遗传与细胞研究所, 吉林 长春 130024
2. Department of Epidemiology and Health Biostatistics, School of Public Health, Jilin University, Changchun 130021, China;
3. Department of Pediatrics, First Hospital, Jilin University, Changchun 130021, China;
4. Institute of Cytology and Genetics, School of Life Sciences, Northeast Normal University, Changchun 130024, China
孤独症谱系障碍(autism spectrum disorder, ASD)是一种以社会交流障碍、语言交流障碍、重复刻板的行为方式和兴趣为核心症状的神经发育障碍性疾病[1]。ASD一般在3岁前发病,WHO的诊断指导意见为其在约2岁时能被确诊[2]。2012年美国疾病预防控制中心[3]报道:ASD在男孩中的患病率为1/54,女孩中的患病率为1/252,男孩ASD患病率约为女孩的45倍。ASD是一种病因复杂的疾病,自1943年美国儿童精神科医生Leo Kanner提出后,其确切病因及机制尚不清楚,WHO[2, 4]指导意见显示:通过基因、环境、基因和环境因素的作用,可导致儿童早期大脑发育异常,从而引起ASD。家系研究、双生子研究、分子遗传学和细胞遗传学研究[5]结果均表明遗传因素对ASD的发生起重要作用。研究[6]表明ASD的遗传可能性为50%。近年来,神经细胞的异常功能与ASD的关系成为研究者们关注的焦点。神经细胞的机能活动有赖于神经细胞膜的完整性,而磷脂作为细胞膜的重要组成成分,其异常代谢将会影响神经细胞正常的生理功能,从而引起神经精神疾病[7]。PLA2G12A (phospholipase A2 group XIIA)基因位于染色体4q25,在磷脂代谢过程中起重要作用[8],并且全基因组测序结果表明该区域是ASD的易感区域[9]。因此,PLA2G12A基因可能是ASD重要的候选基因,并且国内外尚缺乏关于该基因与ASD的关联性研究。本研究旨在研究PLA2G12A基因单核苷酸多态性(SNPs)与ASD的关联性,初步阐明其是否为中国北方汉族儿童ASD的易感基因。
1 资料与方法 1.1 一般资料研究对象均来源于吉林大学第一医院小儿神经康复科。病例组:该科临床医生以《美国精神障碍诊断统计手册第五版》(DSM-V)为依据进行诊断,并通过实验室检查等排除染色体异常或与ASD有关的神经精神疾病,最终确诊汉族ASD患儿共85例,其中男性68例,女性17例,年龄2~10岁,平均年龄(4±2)岁;对照组:同期于该科门诊进行常规儿童保健检查的无神经精神障碍的汉族健康儿童共183人,其中男性148人,女性35人,年龄1~10岁,平均年龄(4±2)岁。2组研究对象年龄和性别比较差异无统计学意义(P>0.05),均衡可比。本研究通过吉林大学第一医院伦理委员会批准,2组研究对象父母或监护人均知情并签署知情同意书。
1.2 SNP位点选择检索HapMap数据库的人类基因库中4号染色体4q25区域的PLA2G12A基因,下载该基因上的SNP位点数据包,“Population”参数选择“CHB”,将数据导入Haploview4.2软件中,设置“tagger”参数为:最小等位基因频率(MAF)>10%、r2 >0.8、D′=1,运行软件。共选择4个PLA2G12A基因多态性位点,分别为rs6533451、rs2285714、rs2285713和rs11728699。
1.3 基因组DNA的提取采集2组研究对象外周静脉血5mL,于-20℃冰箱保存。按照柱式凝固血液基因组试剂盒说明书(北京康为世纪生物科技有限公司),从外周静脉血中提取DNA。
1.4 基因型检测根据PubMed数据库中的SNP序列信息,采用AssayDesigner3.1软件对4个位点设计上下游引物,rs6533451引物序列为F:5′-ACGTTGGATGGTGGGTGGATGTTCAAGTTC-3′,R: 5′-ACGTTGGATGTTCTCTGTCAG-C TGATGACC-3′;rs2285714引物序列为F:5′-ACGTTGGATGTGTTGCAACCAACACGACAG-3′,R:5′-ACGTTGGATGTCTTGGAGAGGCA-ATACTGG-3′;rs2285713引物序列为F:5′-ACGTTGGATGGACTACTTACAAGGACAAG-G-3′,R:5′-ACGTTGGATGACTTAGCTATCCTGGGGTTG-3′;rs11728699引物序列为F:5′-ACGTTGGATGGATTAGCCAAGGTTAGAGT-C-3′,R:5′-ACGTTGGATGCAGGTTCCAA CA-A TGAAGTC-3′。采用Sequenom MassARRAY平台进行基因型检测,主要涉及PCR反应、SAP反应、单碱基延伸反应、树脂纯化、点样、上机检测和数据收集。
1.5 统计学分析采用SNPStats在线分析程序对2组数据进行Hardy-Weinberg检验和遗传模型分析;采用Haploview4.2软件对数据进行连锁不平衡分析和单体型分析。采用SPSS21.0统计软件进行统计学分析。病例组和对照组研究对象基因型及等位基因频数分布的差异分析采用χ2检验。2组研究对象的年龄不符合正态分布,故其集中和离散趋势采用中位数及四分位数间距描述。以α=0.05为检验水准。
2 结果 2.1 Hardy-Weinberg平衡检验病例组和对照组研究对象PLA2G12A基因的4个位点的基因型及等位基因频数分布均符合H-W平衡检验(P>0.05),故认为本研究的研究对象具有较好的群体代表性。见表 1。
| SNP | Location | Genotyping rate (η/%) | Allele (major/minor) | MAF (case/control) | P(case/control) |
| rs6533451 | Intron 1 | 99.63 | G/A | 0.37/0.43 | 1.00/0.45 |
| rs2285714 | Exon 3 | 99.63 | C/T | 0.23/0.21 | 0.22/1.00 |
| rs2285713 | 3'UTR | 100.00 | C/T | 0.03/0.03 | 1.00/1.00 |
| rs11728699 | Intron 1 | 100.00 | G/T | 0.39/0.35 | 0.82/0.87 |
| MAF:Minor allele frequency . | |||||
2组研究对象PLA2G12A基因4个位点的基因型和等位基因频数分布的差异均无统计学意义(P>0.05)。rs2285714位点在病例组中只有2例突变纯合子,占2.4%;对照组中8例,占4.4%;rs2285713位点在病例组和对照组中均无突变纯合子。见表 2。
| SNP | Genotype/Allele | Case (η/%) | Control (η/%) | χ2 | P |
| rs6533451 | GG | 34(40.0) | 57(31.3) | 1.948 | 0.378 |
| AG | 39(45.9) | 95(52.2) | |||
| AA | 12(14.1) | 30(16.5) | |||
| G | 107(62.9) | 209(57.4) | 1.463 | 0.226 | |
| A | 63(37.1) | 155(42.6) | |||
| rs2285714 | CC | 48(56.5) | 112(61.5) | 1.560 | 0.486* |
| CT | 35(41.2) | 62(34.1) | |||
| TT | 2(2.4) | 8(4.4) | |||
| C | 131(77.1) | 286(78.6) | 0.155 | 0.694 | |
| T | 39(22.9) | 78(21.4) | |||
| rs2285713 | CC | 80(94.1) | 172(94.0) | 0.002 | 0.967 |
| CT | 5(5.9) | 11(6.0) | |||
| C | 165(97.1) | 355(97.0) | 0.002 | 0.968 | |
| T | 5(2.9) | 11(3.0) | |||
| rs11728699 | GG | 31(36.5) | 77(42.1) | 0.889 | 0.641 |
| GT | 42(49.4) | 85(46.4) | |||
| TT | 12(14.1) | 21(11.5) | |||
| G | 104(61.2) | 239(65.3) | 0.857 | 0.355 | |
| T | 66(38.8) | 127(34.7) | |||
| *Fisher exact probability. | |||||
本研究根据赤道信息准则(Akaike Information Criterion, AIC)从显性模型、超显性模型、共显性模型、隐性模型和叠加模型中选择最优模型,rs6533451、rs2285714和rs11728699位点的最优模型分别为显性模型、超显性模型及叠加模型,rs2285713位点在病例组和对照组中均无突变纯合子,故只能给出杂合子与野生纯合子比较的结果,遗传模型分析结果显示PLA2G12A基因各SNPs位点多态性与ASD无关联(P>0.05)。见表 3。
| SNP | Model | Genotype | OR (95%CI) | P |
| rs6533451 | Dominant | G/G | 1.00 | 0.17 |
| A/G-A/A | 0.69 (0.40-1.18) | |||
| rs2285714 | Overdominant | C/C-T/T | 1.00 | 0.26 |
| C/T | 1.36 (0.80-2.31) | |||
| rs2285713 | - | C/C | 1.00 | 0.96 |
| C/T | 0.98(0.33-2.91) | |||
| rs11728699 | Log-additive | - | 1.20 (0.82-1.76) | 0.35 |
| OR and 95%CI were adjusted for age and gender. “-”:No data. | ||||
采用Haploview4.2软件进行连锁不平衡检验, 分析4个位点的连锁不平衡程度,D′值均为1,r2值为0.02~0.50,分析结果显示各位点间存在较强的连锁不平衡。见图 1。
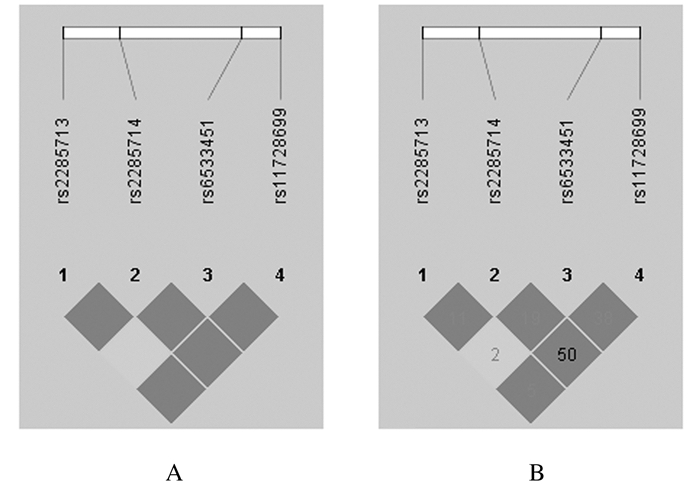
|
| A: D′ (Pairwise LD extent) value for LD (all D′ values were equal to 1); B: r2 (correlation coefficient) value multiplying 100 for LD. 图 1 PLA2G12A基因的4个SNPs位点连锁不平衡程度和相对染色体位置 Figure 1 Linkage disequilibrium (LD) structure and relative chromosomal positions of 4 SNPs sites on PLA2G12A gene |
|
|
采用Haploview4.2软件对PLA2G12A基因进行单体型分析,由于rs2285713位点无突变纯合子,故对rs6533451、rs2285714和rs11728699位点进行单体型分析,CAG单体型频率最高为40.8%,病例组和对照组研究对象各单体型频数比较差异无统计学意义(P>0.05)。见表 4。
| Haplotype | Frequency | Ratio of haplotype | χ2 | P | |
| rs6533451/rs2285714/rs11728699 | Case | Control | |||
| CAG | 0.408 | 63.0:107.0 | 155.6:210.4 | 1.436 | 0.230 9 |
| CGG | 0.232 | 41.0:129.0 | 83.4:282.6 | 0.117 | 0.732 1 |
| TGT | 0.219 | 39.0:131.0 | 78.6:287.4 | 0.145 | 0.703 3 |
| CGT | 0.141 | 27.0:143.0 | 48.4:317.6 | 0.680 | 0.409 6 |
ASD是一类严重的神经发育障碍性疾病,已成为备受社会各界关注的健康问题,无特效治疗药物,且预后差,终身致残率高,给家庭和社会均造成重大负担,因此ASD的病因研究十分必要。研究[10]表明:PLA2G12A基因的SNPs与另一种神经发育障碍性疾病--精神分裂症有关联,本研究旨在探讨在北方汉族人群中该基因SNPs与ASD的关联。
磷脂酶A2(phospholipase A2,PLA2)是一种重要的代谢和调节酶类,能催化脂蛋白和细胞膜上的磷脂甘油分子上二位酰基脂键(Sn-2)水解,形成游离脂肪酸和溶血磷脂[11]。在病理情况下,PLA2活性的增强可潜在地引起神经系统功能发生障碍以及认知功能的损伤[7, 12]。根据PLA2存在的部位、氨基酸顺序同源性和生化功能等特征,可将PLA2分为3种,分别为分泌型PLA2(secretory PLA2,sPLA2s)、胞浆型PLA2(cytosolic PLA2,cPLA2s)和非Ca2+依赖型PLA2(Ca2+-independent PLA2,iPLA2s)。sPLA2存在于胞质的颗粒中或在细胞受刺激后合成并释放到细胞外,在中枢神经系统损伤和神经外伤过程中起重要作用[13]。除此之外,sPLA2的刺激可引起突触小泡的聚集,这一过程在突触前神经传递过程中起重要作用[12],研究[14]表明:突触功能的异常与ASD相关,因此sPLA2的异常可能引起ASD。
PLA2G12A是sPLA2家族中的一种亚型,其蛋白在脑内的不同区域表达,但主要在大脑前额叶皮质中表达[8],而前额叶皮质改变与ASD认知表型相关[15]。另一方面,PLA2G12A敲除后可引起多巴胺和血清素受体的改变[16],引起神经炎症的发生。研究[17-19]表明神经炎症的发生与包括孤独症在内的神经发育障碍性疾病有关联。因此,PLA2G12A可能是ASD的易感基因,故本研究基于北方汉族儿童,以病例对照设计研究PLA2G12A多态性与ASD的关联性。
本研究结果显示:病例组和对照组研究对象中PLA2G12A基因4个SNPs位点的基因型和等位基因频数分布比较差异无统计学意义;遗传模型分析结果表明:各遗传模型下,4个SNPs位点与ASD均无关联。由于rs2285713位点无突变纯合子,故采用Haploview4.2软件对其他3个位点进行连锁不平衡分析以及单体型分析,各个单体型与ASD无关联性。
综上所述,未发现PLA2G12A基因SNPs与中国北方汉族儿童ASD有关联性,故该基因可能不是北方汉族儿童ASD的易感基因。
本课题组首次研究PLA2G12A基因SNPs与中国北方汉族儿童ASD的关系,但同时存在局限性:①本研究样本量较小;②ASD是多基因复杂性疾病,受多种因素的影响;③本研究只基于北方汉族人群,无其他人群信息。因此未来应进一步扩大样本量并同时考虑其他可能影响因素及其他人群,进行重复验证。
| [1] | Lai MC, Lombardo MV, Baron CS. Autism[J]. Lancet, 2014, 383(9920): 896–910. DOI:10.1016/S0140-6736(13)61539-1 |
| [2] | WHO.Questions and answers about autism spectrum disorders (ASD)[J/OL].http://www.who.int/features/qa/85/en/. Accessed 5 February, 2016, 10:00 pm. |
| [3] | Centers for Diseases Control and Prevention. Prevalence of autism spectrum disorders--Autism and Developmental Disabilities Monitoring Network, 14 sites, United States, 2008[J]. MMWR Surveill Summ (Washington, D.C, 2012, 61(3): 1–19. |
| [4] | Kanner L. Autistic disturbances of aff ective contact[J]. Nerv Child, 1943, 2: 217–250. |
| [5] | Muhle R, Trentacoste SV, Rapin I. The genetics of autism[J]. Pediatrics, 2004, 113(5): e472–486. DOI:10.1542/peds.113.5.e472 |
| [6] | Sandin S, Lichtenstein P, Kuja HR, et al. The familial risk of autism[J]. JAMA, 2014, 311(17): 1770–1777. DOI:10.1001/jama.2014.4144 |
| [7] | Ong WY, Farooqui T, Kokotos G, et al. Synthetic and natural inhibitors of phospholipases A2:their importance for understanding and treatment of neurological disorders[J]. ACS Chem Neurosci, 2015, 6(6): 814–831. DOI:10.1021/acschemneuro.5b00073 |
| [8] | Ee SM, Lo YL, Shui G, et al. Distribution of secretory phospholipase A2ⅫA in the brain and its role in lipid metabolism and cognition[J]. Mol Neurobiol, 2014, 50(1): 60–75. DOI:10.1007/s12035-014-8635-7 |
| [9] | Yonan AL, Alarcon M, Cheng R, et al. A genomewide screen of 345 families for autism-susceptibility loci[J]. Am J Hum Genet, 2003, 73(4): 886–897. DOI:10.1086/378778 |
| [10] | 徐洪芹.磷脂酶A2家族基因与精神分裂症关系的分子遗传流行病学研究[D].长春:吉林大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10183-1014268167.htm |
| [11] | Six DA, Dennis EA. The expanding superfamily of phospholipase A (2) enzymes:classification and characterization[J]. Biochim Biophys Acta, 2000, 1488(1/2): 1–19. |
| [12] | Farooqui AA, Ong WY, Horrocks LA. Inhibitors of brain phospholipase A2 activity:their neuropharmacological effects and therapeutic importance for the treatment of neurologic disorders[J]. Pharmacol Rev, 2006, 58(3): 591–620. DOI:10.1124/pr.58.3.7 |
| [13] | Titsworth WL, Liu NK, Xu XM. Role of secretory phospholipase a (2) in CNS inflammation:implications in traumatic spinal cord injury[J]. CNS Neurol Disord Drug Targets, 2008, 7(3): 254–269. DOI:10.2174/187152708784936671 |
| [14] | Garber K. Neuroscience.Autism's cause may reside in abnormalities at the synapse[J]. Science, 2007, 317(5835): 190–191. DOI:10.1126/science.317.5835.190 |
| [15] | Hashemi E, Ariza J, Rogers H, et al. The Number of Parvalbumin-Expressing Interneurons Is Decreased in the Medial Prefrontal Cortex in Autism[J]. Cereb Cortex, 2016. |
| [16] | Puumala T, Sirvio J. Changes in activities of dopamine and serotonin systems in the frontal cortex underlie poor choice accuracy and impulsivity of rats in an attention task[J]. Neuroscience, 1998, 83(2): 489–499. DOI:10.1016/S0306-4522(97)00392-8 |
| [17] | Firouzabadi N, Ghazanfari N, Alavi SA, et al. Genetic Variants of Angiotensin-Converting Enzyme Are Linked to Autism:A Case-Control Study[J]. PLoS One, 2016, 11(4): e0153667. DOI:10.1371/journal.pone.0153667 |
| [18] | 李霖, 张晗, 张翕婷, 等. 血管性痴呆与亚甲基四氢叶酸还原酶基因多态性研究进展[J]. 中国老年学杂志, 2016, 36(18): 4638–4640. |
| [19] | 贾少坤, 王雁, 隋爱华. NINJ2基因多态性与血管性认知功能障碍的相关性[J]. 中国老年学杂志, 2015, 35(16): 4533–4536. |
 2016, Vol. 42
2016, Vol. 42


