扩展功能
文章信息
- 李杏杏, 谭婧瑾, 姜杉, 王珂
- LI Xingxing, TAN Jingjin, JIANG Shan, WAHG Ke
- let-7和HMGA2在肺癌发生发展中作用的Meta分析
- Role of let-7 and HMGA2 in occurrence and development of lung cancer: Meta-analysis
- 吉林大学学报(医学版), 2016, 42(06): 1116-1125
- Journal of Jilin University (Medicine Edition), 2016, 42(06): 1116-1125
- 10.13481/j.1671-587x.20160614
-
文章历史
- 收稿日期: 2016-06-02
肺癌在恶性肿瘤中死亡率居首位,早期诊断和精确的预后分析是提高肺癌患者生存率的关键。研究[1-3]表明:小分子RNA (microRNA,miRNA)和高迁移率族蛋白A2 (high mobility group A2,HMGA2)与多种肿瘤的发生发展密切关联。研究[4]表明:let-7低表达与肺癌患者手术治疗后的临床预后有关,let-7低表达提示预后不良。有多位研究者[1, 5]报道的let-7低表达与肺癌预后关联性结果出现分歧。非小细胞肺癌组织中HMGA2的表达水平较正常肺组织升高,非小细胞肺癌患者的临床病理特征存在差异,因此其研究结果[6-7]不尽相同,目前尚无相关领域的Meta分析。本文作者全面检索let-7低表达与肺癌预后的关系及HMGA2与非小细胞肺癌发生发展关系的文献,评价let-7低表达对肺癌预后评估及HMGA2对不同临床特点肺癌患者预后评估的价值。
1 资料与方法 1.1 检索数据库和检索策略计算机检索PubMed、Web of Science、Medline、Cochrane Library、Google Scholar、CNKI、CBM、万方和维普等数据库,分别收集自建库以来已公开发表的关于let-7低表达与肺癌预后及HMGA2与肺癌发生发展关联性的研究,语种限定为中文和英文,检索关键词为“肺癌、肺肿瘤、非小细胞肺癌、小细胞肺癌、肺腺癌、肺鳞癌、NSCLC、SCLC、lung cancer、let-7、microRNA和预后(prognosis)”;“非小细胞肺癌、肺腺癌、肺鳞癌、NSCLC、lung adenocarcinoma、lung squamous cell carcinomas、HMGA2、HMGI-C和高迁移率族蛋白A2”。此外,对检索到的文献所引用的参考文献也进行了检索。由2名研究者独立地对文献进行检索,出现分歧时通过双方讨论达成一致。
1.2 文献纳入标准let-7低表达与肺癌预后关系的文献纳入标准:①基于人的病例研究;②关于let-7低表达与肺癌预后关联性的研究;③数据信息完整;④随访时间>1年。HMGA2与非小细胞肺癌发生发展关联性的文献纳入标准:①关于肺癌组织与癌旁正常组织中HMGA2表达的病例对照实验,所取标本来源的患者均未行放化疗治疗;②原始数据提供了HMGA2阳性表达的例数和阳性率;③关于HMAG2表达与肺癌患者病理特征之间的研究,研究中HMGA2的检测方法均为免疫组织化学(SP)法。
1.3 文献排除标准let-7低表达与肺癌预后关系的相关文献检索的排除标准:①综述、信件或年鉴;②实验室基础研究;③缺少可以计算出风险比(hazard ratio, HR)、95%可信区间(95%confidence interval, 95%CI)和P值等效应指标的原始数据或图形;④对同一研究重复发表的文献报道中较前发表的及结果不完整的文献。
HMGA2与非小细胞肺癌发生发展相关文献检索的排除标准:①数据信息不全;②实验室基础研究;③对同一研究重复发表的文献报道,只纳入近期发表的和结果最完整的文献;④检测血清HMGA2表达水平的相关研究;⑤对照组为非癌旁正常组织。
1.4 文献质量评价及Meta分析评价指标let-7低表达与肺癌预后关系文献的质量评价参照Meta-analysis Of Observational Studies in Epidemiology (MOOSE)[8]的评价标准,提取以下数据信息:①第一作者姓名和发表日期;②研究样本量、样本来源、分期和组织学类型;③let-7的检测方法及其表达水平的截点值;④随访时间;⑤总生存率、无复发生存率或肿瘤相关生存率的HR值及95%CI。
HMGA2与非小细胞肺癌发生发展关联性文献的质量评价参照Lichtenstein等[9]的病例对照研究评价标准,主要从以下5个方面进行评价:①试验设计是否科学合理;②研究对象的纳入标准及其基本构成特征明确与否;③处理因素和方法是否准确;④统计学方法是否恰当;⑤研究是否对存在的偏倚进行了分析和讨论。由2名独立的研究者对纳入研究进行质量评价,任何分歧均通过讨论达成一致。
HMGA2与非小细胞肺癌发生发展关系的Meta分析主要评价指标为肺癌组织与癌旁正常组织中HMGA2的表达阳性率。次要评价指标:①男、女性肺癌组织中HMAG2的表达阳性率;②吸烟与否的患者肺癌组织中HMGA2的表达阳性率;③肺鳞癌、腺癌组织中HMGA2的表达阳性率;④不同肿瘤大小(以3 cm为界)的肺癌组织中HMGA2的表达阳性率;⑤临床Ⅰ+Ⅱ与Ⅲ+Ⅳ分期肺癌组织中HMGA2的表达阳性率;⑥低分化和高分化肺癌组织中HMGA2的表达阳性率;⑦是否有淋巴结转移的肺癌组织中HMGA2的表达阳性率。
1.5 数据提取根据检索策略检索文献,浏览标题和摘要后,筛检出合格的文献并阅读全文,判断是否符合文献纳入标准并进行质量评价,确定最终纳入的文献。之后从纳入的文献中提取相关信息,let-7低表达与肺癌预后关系的文献主要包括第一作者姓名、发表日期、被研究者的国籍、文献总数、随访时间、let-7表达水平的检测方法、let-7家族类型、肺癌患者术后生存率的统计分析方法、生存分析和HR等(表 1);HMGA2与非小细胞肺癌发生发展关联性的文献主要包括第一作者、发表日期、纳入对象的数量和各不同病理特征患者HMGA2阳性表达的数量及阳性率(表 2~4)。上述过程由2名研究者独立完成,并交叉核对,出现分歧后经协商达成一致。
| First author |
Publication time | Country | Let-7 | n | Follow-up time (year) | Gene expression analysis method | Survival analysis method | Cut-off | HR |
| Xia[24] | 2010 | China | let-7 | 31 | >3 | qRT-PCR | Kaplan-Meier analyses | 0.5 | Non-reported |
| Landi[25] | 2010 | USA | Let-7e | 290 | >5 | qRT-PCR | Kaplan-Meier analyses | Median | Reported |
| Zhao[13] | 2014 | China | let-7c | 94 | >6 | qRT-PCR | Kaplan-Meier analyses | Median | Reported |
| Zhang[26] | 2012 | China | Let-7e | 51 | >2 | qRT-PCR | Kaplan-Meier analyses | Median | Reported |
| Takamizawa [4] | 2004 | Japan | let-7 | 143 | >5 | qRT-PCR | Kaplan-Meier analyses | Hierarchical clustering | Reported |
| Inamura[5] | 2007 | Japan | let-7 | 66 | >5 | qRT-PCR | Kaplan-Meier analyses | Hierarchical clustering | Non-reported |
| Yanaihara[27] | 2006 | USA | let-7a-2 | 52 | >1 | qRT-PCR | Kaplan-Meier analyses | Mean | Reported |
| Voortman [12] | 2010 | USA | let-7a | 638 | >8 | qRT-PCR | Multivariate Cox analyses | Median | Reported |
| Jusufovic[28] | 2012 | Italy | Let-7b | 327 | >1 | qRT-PCR | Kaplan-Meier analyses | Median | Reported |
| Capodanno[29] | 2013 | Italy | Let-7g | 55 | >5 | qRT-PCR | Kaplan-Meier analyses | Median | Non-reported |
| First author | Publication year | Gender | Smoking history | Tumor size | Stage | |||||||||||||||
| Male | Female | Yes | No | ≤3 cm | >3 cm | Ⅰ+Ⅱ | Ⅲ+Ⅳ | |||||||||||||
| + | - | + | - | + | - | + | - | + | - | + | - | + | - | + | - | |||||
| Wu[34] | 2008 | 31 | 12 | 15 | 1 | - | - | - | - | - | - | - | - | 30 | 11 | 16 | 2 | |||
| Lan[30] | 2008 | - | - | - | - | - | - | - | - | 4 | 4 | 11 | 19 | 6 | 14 | 9 | 9 | |||
| Yan[6] | 2011 | 20 | 33 | 7 | 8 | 29 | 15 | 14 | 10 | 14 | 17 | 29 | 8 | 21 | 35 | 6 | 6 | |||
| Liu[31] | 2011 | 31 | 6 | 20 | 7 | 14 | 5 | 37 | 8 | 12 | 6 | 38 | 8 | 20 | 19 | 24 | 1 | |||
| Yang[7] | 2015 | 60 | 36 | 22 | 20 | 43 | 41 | 39 | 15 | 38 | 22 | 44 | 34 | 39 | 41 | 43 | 15 | |||
| Xiao[32] | 2013 | 12 | 8 | 9 | 11 | - | - | - | - | 12 | 6 | 38 | 8 | 4 | 9 | 24 | 3 | |||
| Meyer[33] | 2007 | 4 | 9 | 2 | 3 | - | - | - | - | - | - | - | - | 1 | 7 | 5 | 5 | |||
| “-”:No data. | ||||||||||||||||||||
| First author | Publication year | Node metastasis | Pathologic type | Differentiation degree | |||||||||||
| No | Yes | Squamous cell carcinoma | Adenocarcinoma | Middle-high | Low | ||||||||||
| + | - | + | - | + | - | + | - | + | - | + | - | ||||
| Wu[34] | 2008 | 13 | 9 | 33 | 4 | 19 | 8 | 23 | 5 | - | - | - | - | ||
| Lan[30] | 2008 | 4 | 17 | 11 | 6 | - | - | - | - | 10 | 16 | 5 | 7 | ||
| Yan[6] | 2011 | 15 | 28 | 12 | 13 | 11 | 24 | 16 | 17 | 21 | 22 | 6 | 19 | ||
| Liu[31] | 2011 | 12 | 17 | 33 | 2 | 23 | 5 | 28 | 8 | - | - | - | - | ||
| Yang[7] | 2015 | 39 | 41 | 43 | 15 | 52 | 38 | 30 | 18 | 48 | 44 | 34 | 12 | ||
| Xiao[32] | 2013 | 11 | 9 | 8 | 12 | 8 | 9 | 12 | 11 | 10 | 15 | 11 | 4 | ||
| Meyer[33] | 2007 | - | - | - | - | 4 | 7 | 2 | 7 | - | - | - | - | ||
| Eide[35] | 2015 | - | - | - | - | 34 | 4 | 41 | 47 | - | - | - | - | ||
| Sarhadi[36] | 2006 | - | - | - | - | 60 | 2 | 41 | 10 | - | - | - | - | ||
| “-”:No data. | |||||||||||||||
采用Meta分析方法对各纳入文献的结果进行合并,绘制森林图;采用Q检验衡量各研究间效应量分布的异质性;采用I2统计量评价各研究间变异占总变异的百分比,若P > 0.05,I2 < 50%,说明各研究间不存在统计学异质性,应采用固定效应模型行数据合并,若P≤0.05, I2≥50%,说明各研究之间有统计学异质性,可进一步分析产生统计学异质性的原因,若认为各研究结果的方向一致,无明显临床异质性,可忽略统计学异质性,采用固定效应模型,若各研究结果方向明显相反,则采用随机效应模型进行合并及进行Meta分析;采用漏斗图判断纳入的文献是否存在发表偏倚,当漏斗图显示不对称或不完整时则认为存在发表偏倚。所有P值均为双侧检验。采用StataSE12.0统计软件进行统计学分析。以HR和95%CI作为效应量评价let-7低表达与肺癌预后的关联性,HR>1提示预后不良。以比值比(odds ratio,OR)及95%CI作为效应量评价HMGA2与肺癌发生发展的关联性,OR值的意义根据具体情况分析。对未提供HR及95%CI的纳入文献,以所提供的生存曲线图形为基础应用Engauge Digitizer 4.1软件得出所需效应量[10]。将带有无附加注释数字词根的miRNAs定义为“母版”miRNAs,同一“母版”miRNAs的变异体可看做一个整体,例如let-7a、let-7a-2、let-7b和let-7c的“母版”miRNA可被定义为let-7[11]。
2 结果 2.1 纳入研究的基本特征通过对PubMed、Web of Science、Medline、Cochrane Library、Google Scholar、CNKI、CBM、万方和维普等数据库的检索,共获得447篇公开发表的关于let-7与肺癌预后的文献。浏览和略读题目与摘要后,人工筛检排除研究内容与本研究不符的文献405篇,精读剩余的42篇文献,对全文内容进行评估。最终共有10篇文献符合纳入标准进入本研究,共1 799例患者,均为非小细胞肺癌患者。主要的临床结局为总生存率,而无复发生存率、癌症相关生存率和无进展生存率则少见。为评价let-7表达水平对患者临床结局的影响,将let-7的表达水平二分类后采用回归模型或Kaplan-Meier曲线进行生存分析,表达水平的截点值釆用中位数的有6篇,采用平均数的有1篇,采用层次聚类分析的有2篇,采用其他指标的有1篇。肺癌的预后可能受多种临床或病理因素的影响,这些混杂因素可能影响预后判断。纳入文献中有6篇文献应用回归模型进行分析校正,年龄、性别、TNM分期和病理分型的校正指标最常见。其中有1篇文献对患者[12]术后化疗进行分析的结果显示化疗并未影响预后结果。其余5篇文献对多个因素进行分析,let-7低表达与高表达的肺癌患者仅有个别临床特征不同,分析后排除多种临床或病理因素对预后的影响。
通过PubMed、Web of Science、Medline、Cochrane Library、Google Scholar、CNKI、CBM、万方和维普等数据库的检索,共获得137篇公开发表的关于HMGA2与肺癌发生发展关系的文献。浏览和略读题目及摘要后,人工筛检排除研究内容与本研究不符的120篇文献,精读剩余的17篇文献全文,最终共有9篇文献符合纳入标准。9篇文献质量评价均为高质量文献,其中有6篇文献提供了肺癌组织与癌旁组织的原始数据,共366例肺癌标本,247例癌旁正常组织标本;其中有6篇文献涉及男性和女性肺癌组织中HMGA2表达情况的比较;3篇文献涉及吸烟和不吸烟患者肺癌组织中HMGA2表达情况的比较;5篇文献涉及肿瘤大小(以3 cm为界)不同者肺癌组织中HMGA2表达情况的比较;7篇文献涉及肿瘤分期不同者肺癌组织中HMGA2表达情况的比较;6篇文献涉及肺癌有无伴随淋巴结转移者肺癌组织中HMGA2表达情况的比较;8篇文献涉及肺鳞癌、肺腺癌患者肺癌组织中HMGA2表达情况的比较;4篇文献涉及肿瘤不同分化程度者肺癌组织中HMGA2表达情况的比较。见表 2~4。
2.2 let-7低表达与肺癌预后的关系采用StataSE 12.0统计软件对纳入研究的数据进行Meta分析结果显示:相关文献之间存在统计学异质性(P=0.000,I2=78.2%)。因此釆用随机效应模型来计算HR及95%CI的合并效应量。let-7低表达预示较低总生存率,HR值为1.55(95%CI:1.16~2.09, P < 0.05)。合并后的HR值明显比单项研究中单独的HR值具有更强的统计学效力。见图 1。
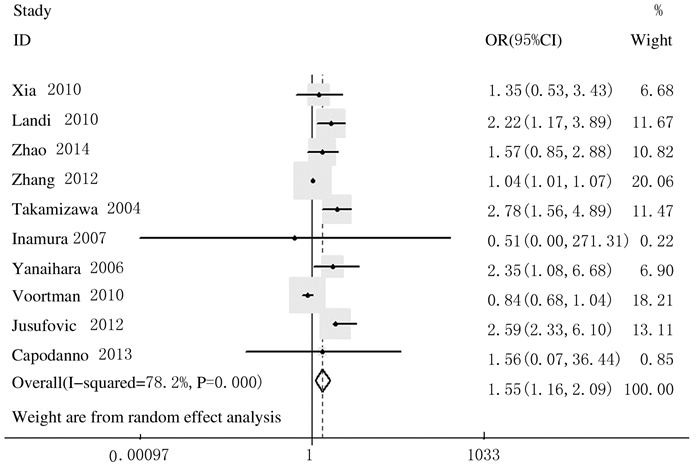
|
| 图 1 Let-7低表达与肺癌预后关系的Meta分析 Figure 1 Meta-analysis on relationship between low expression of let-7 and prognosis of lung cancer |
|
|
有关肺癌组织和癌旁正常组织中HMGA2表达的文献共纳入6篇,其中肺癌组织中HMGA2表达阳性者219例,癌旁正常组织中HMGA2阳性表达者49例,各项研究间存在统计学异质性(P=0.052,I2=54.4%),但各研究结果的方向一致,选用固定效应模型进行Meta分析。肺癌组织中HMGA2阳性表达率为59.84%(219/366),癌旁正常组织中其阳性表达率为19.84%(49/247),肺癌与癌旁正常组织中HMGA2阳性表达率比较差异有统计学意义(OR=5.92,95%CI:3.96~8.85,P=0.000)。见图 2。
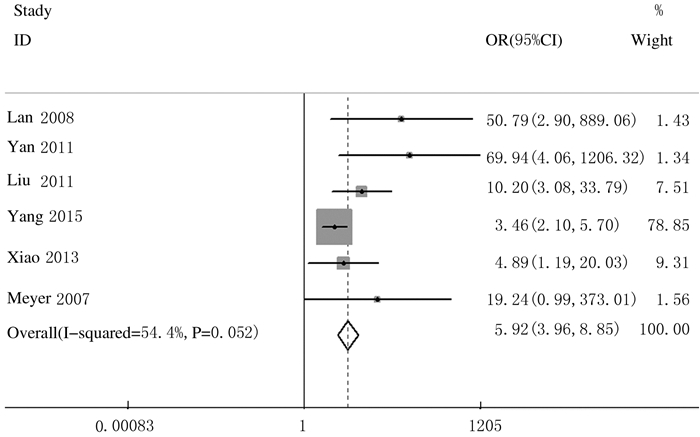
|
| 图 2 肺癌组织和癌旁正常组织中HMGA2阳性表达率的Meta分析 Figure 2 Meta-analysis on positive expression rates of HMGA2 in lung cancer tissue and adjacent normal tissue |
|
|
有关男性和女性患者肺癌组织中HMGA2表达的文献共纳入6篇,其中男性患者肺癌组织中HMGA2阳性表达者158例,女性患者肺癌组织中HMGA2阳性表达者75例,各项研究间无统计学异质性(P=0.339,I2=11.9%),因此选用固定效应模型进行Meta分析。男性患者肺癌组织中HMGA2阳性表达率为60.31%(158/262),女性患者肺癌组织中HMGA2阳性表达率为60.00%(75/125),男性和女性患者肺癌组织中HMGA2阳性表达率比较差异无统计学意义(OR=1.12,95%CI:0.71~1.78,P>0.05)。见图 3。
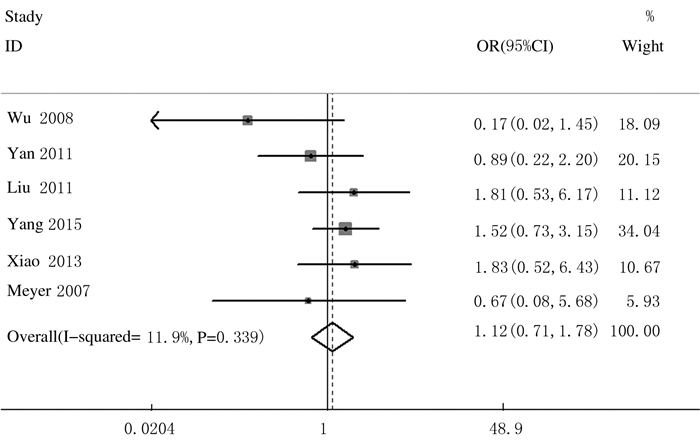
|
| 图 3 男性和女性患者肺癌组织中HMGA2阳性表达率的Meta分析 Figure 3 Meta-analysis on positive expression rates of HMGA2 in lung cancer tissue of male and female patients with lung cancer |
|
|
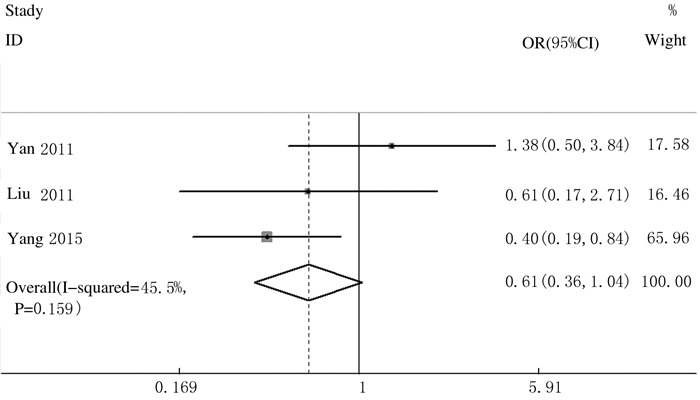
有关吸烟和不吸烟患者肺癌组织中HMGA2表达的文献共纳入3篇,其中吸烟患者肺癌组织中HMGA2阳性表达者86例,不吸烟患者肺癌组织中HMGA2阳性表达者90例,各项研究间无统计学异质性(P=0.159,I2=45.5%),因此选用固定效应模型进行Meta分析。吸烟患者肺癌组织中HMGA2阳性表达率为58.50%(86/147),不吸烟患者肺癌组织中HMGA2阳性表达率为73.17%(90/123),吸烟与不吸烟肺癌患者肺癌组织中HMGA2阳性表达率比较差异无统计学意义(OR=0.61,95%CI:0.36~1.04,P>0.05)。见图 4。
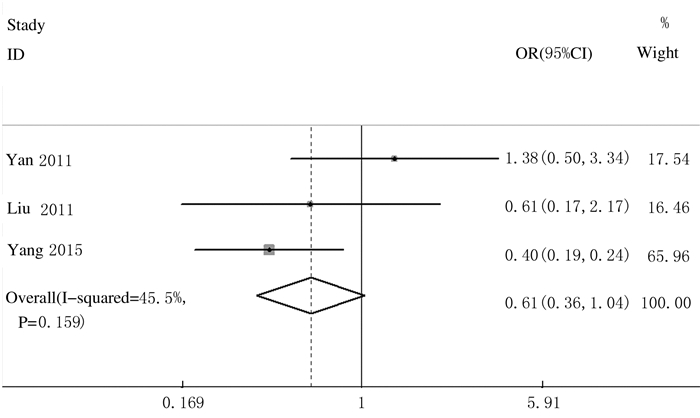
|
| 图 4 吸烟和不吸烟患者肺癌组织中的HMGA2阳性表达率的Meta分析 Figure 4 Meta-analysis on positive expression rates of HMGA2 in lung cancer tissue of patients smoking or not |
|
|
有关不同肿瘤大小患者肺癌组织中HMGA2表达的文献共纳入5篇,其中肿瘤直径≤3 cm患者肺癌组织中HMGA2阳性表达者80例,肿瘤直径>3 cm患者肺癌组织中HMGA2阳性表达160例,各项研究间存在统计学异质性(P=0.036,I2=61.1%),各研究结果方向不一致,因此选用随机效应模型进行Meta分析。肿瘤直径≤3cm患者肺癌组织中HMGA2阳性表达率为59.26%(80/135),肿瘤直径>3 cm患者肺癌组织中HMGA2阳性表达率为67.51%(160/237),不同肿瘤大小患者肺癌组织中HMGA2阳性表达率比较差异无统计学意义(OR=0.62,95%CI:0.28~1.37,P>0.05)。见图 5。

|
| 图 5 不同肿瘤大小患者肺癌组织中HMGA2阳性表达率的Meta分析 Figure 5 Meta-analysis on expression levels of HMGA2 in lung cancer tissue of patients with different tumor sizes |
|
|
有关Ⅰ+Ⅱ期和Ⅲ+Ⅳ肺癌患者肺癌组织中HMGA2表达的文献纳入7篇,其中Ⅰ+Ⅱ期肺癌患者肺癌组织中HMGA2阳性表达者121例,Ⅲ+Ⅳ期肺癌患者肺癌组织中HMGA2阳性表达者127例,各项研究间无统计学异质性(P=0.171,I2=33.7%),因此选用固定效应模型进行Meta分析。Ⅰ+Ⅱ期肺癌患者肺癌组织中HMGA2阳性表达率为47.08%(121/257),Ⅲ+Ⅳ期肺癌患者肺癌组织中HMGA2阳性表达率为75.60%(127/168),Ⅰ+Ⅱ期与Ⅲ+Ⅳ期肺癌患者肺癌组织中HMGA2阳性表达率比较差异有统计学意义(OR=0.26,95%CI:0.16~0.41,P < 0.05)。见图 6。
|
| 图 6 Ⅰ+Ⅱ期和Ⅲ+Ⅳ肺癌患者肺癌组织中HMGA2阳性表达率的Meta分析 Figure 6 Meta-analysis onpositive expression rates of HMGA2 in lung cancer tissue of lung cancer patients at Ⅰ+ Ⅱ or Ⅲ+Ⅳ stages |
|
|
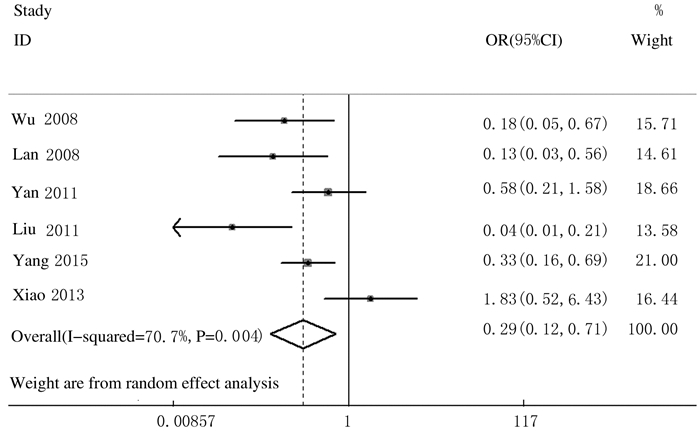
有关有无淋巴结转移患者肺癌组织中HMGA2表达的文献共纳入6篇,其中无淋巴结转移患者肺癌组织中HMGA2表达阳性者94例,有淋巴结转移患者肺癌组织中HMGA2阳性表达者140例,各项研究间存在统计学异质性(P=0.004,I2=70.7%),各研究结果方向不一致,因此选用随机效应模型进行Meta分析。无淋巴结转移患者肺癌组织中HMGA2阳性表达率为43.72%(94/215),有淋巴结转移患者肺癌组织中HMGA2阳性表达率为72.92%(140/192),有无淋巴结转移患者肺癌组织中HMGA2阳性表达率比较差异有统计学意义(OR=0.29,95%CI:0.12~0.71,P < 0.05)。见图 7。
|
| 图 7 有无淋巴结转移患者肺癌组织中HMGA2阳性表达率的Meta分析 Figure 7 Meta-analysis on positive expression rates of HMGA2 in lung cancer tissue of patients with lymph node metastasis or not |
|
|
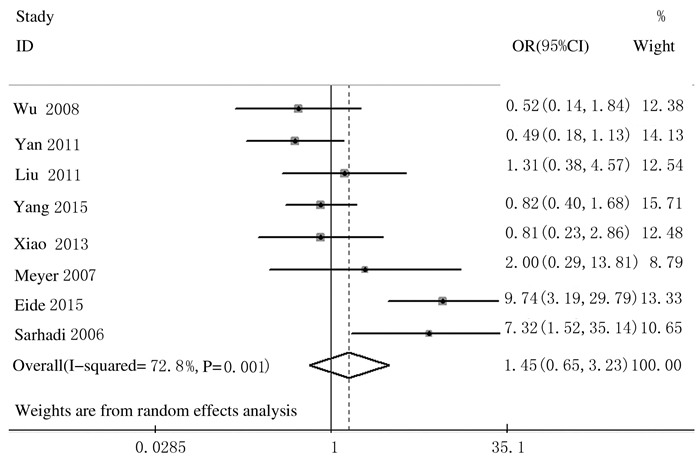
有关肺鳞癌与腺癌患者肺癌组织中HMGA2表达情况比较的文献共纳入8篇,其中肺鳞癌患者肺癌组织中HMGA2阳性表达者211例,肺腺癌组织中HMGA2阳性表达者193例,各项研究间存在统计学异质性(P=0.001,I2=72.8%),各研究结果方向不一致,因此选用随机效应模型进行Meta分析。肺鳞癌患者肺癌组织中HMGA2阳性表达率为68.06%(211/310),肺腺癌患者肺癌组织中HMGA2阳性表达率为60.69%(193/318),肺鳞癌与肺腺癌患者肺癌组织中HMGA2阳性表达率比较差异无统计学意义(OR=1.45,95%CI:0.65~3.23,P>0.05)。见图 8。
|
| 图 8 肺鳞癌与肺腺癌患者肺癌组织中HMGA2阳性表达率的Meta分析 Figure 8 Meta-analysis on positive expression rates of HMGA2 in lung cancer of lung squamous cell carcinoma and lung adenocarcinoma patients |
|
|
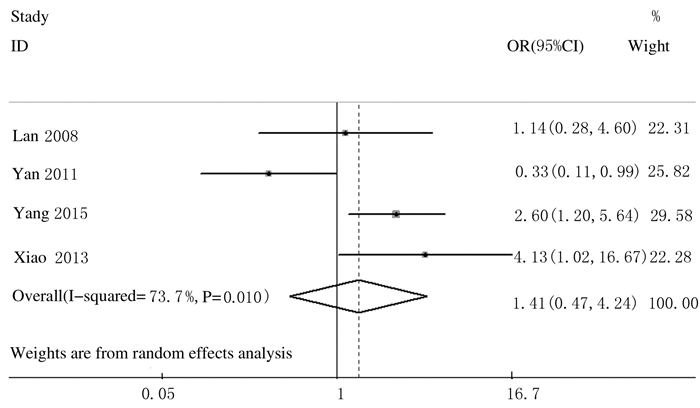
有关低分化和中、高分化肺癌患者肺癌组织中HMGA2表达的文献共纳入了4篇,低分化肺癌患者肺癌组织中HMGA2阳性表达者56例,中、高分化肺癌患者肺癌组织中HMGA2阳性表达者89例,各项研究间存在统计学异质性(P=0.01,I2=73.7%),各研究结果方向不一致,因此选用随机效应模型进行Meta分析。低分化肺癌患者肺癌组织中HMGA2阳性表达率为57.14%(56/98),中、高分化肺癌患者肺癌组织中HMGA2阳性表达率为47.85%(89/186),低分化和中、高分化肺癌患者肺癌组织中HMGA2阳性表达率比较差异无统计学意义(OR=1.41,95%CI:0.47~4.24,P>0.05)。见图 9。
|
| 图 9 低分化和中、高分化患者肺癌组织中HMGA2阳性表达率的Meta分析 Figure 9 Meta-analysis on positive expression rates of HMGA2 in lung cancer tissue of lung cancer patients with low and middle-high differentiation |
|
|
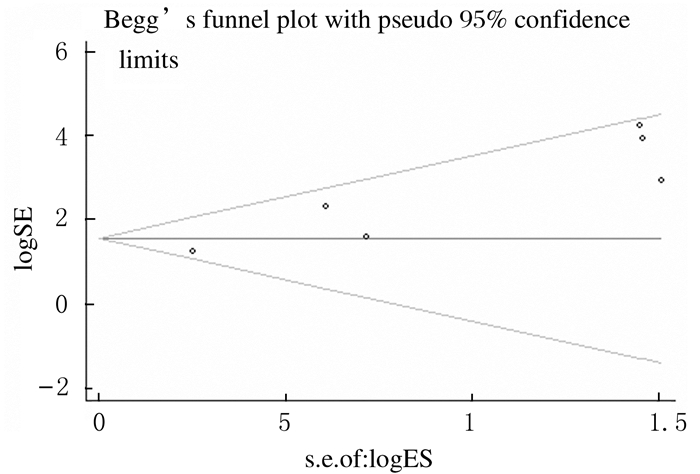
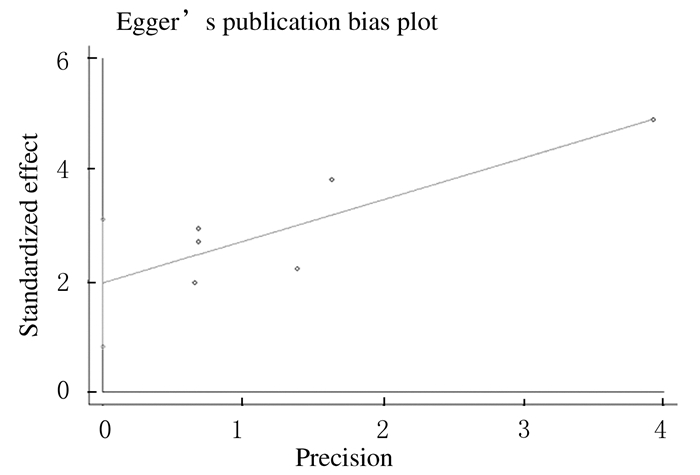
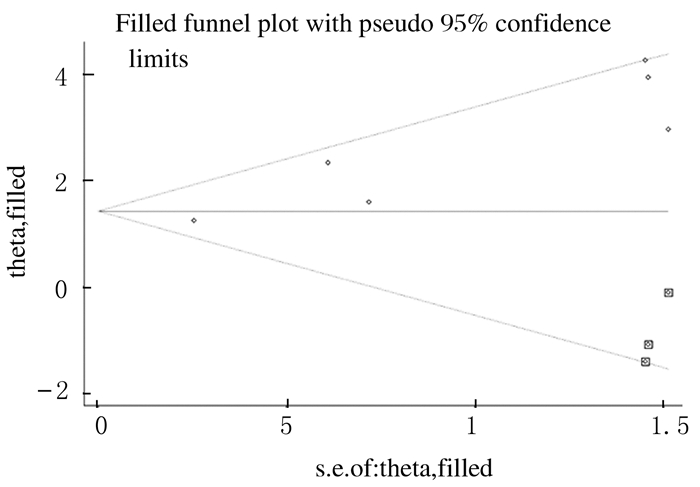
将森林图进行漏斗图定性和Begg及Egger回归定量分析。其中在肺癌组织和癌旁正常组织中HMGA2表达水平比较的研究中,发表偏倚Begg和Egger回归结果不一致(图 10和11),Begg检验结果显示:Pr>IzI=0.452;Egger回归检验结果显示P=0.009。剪补法分析结果显示剪补后结果并未逆转,因此结果比较稳健。见图 12。
|
| 图 10 肺癌组织和癌旁正常组织中HMGA2表达水平的Begg’s漏斗图 Figure 10 Begg's funnel plot of expression levels of HMGA2 in lung cancer tissue and adjacent normal tissue |
|
|
|
| 图 11 肺癌组织和癌旁正常组织中HMGA2表达水平比较的Egger’s图 Figure 11 Egger's plot of expression levels of HMGA2 in lung cancer tissue and adjacent normal tissue |
|
|
|
| 图 12 肺癌组织和癌旁正常组织中HMGA2表达水平的剪补图 Figure 12 Filled funnel plot of expression levels of HMGA2 in lung cancer tissue and adjacent normal tissue |
|
|
采用Meta分析的方法已发现多种miRNAs与肺癌、特别是与非小细胞肺癌的预后有密切关联。Xia等[8]研究表明:let-7低表达与多种癌症的预后密切关联,其中有7篇研究与肺癌相关联,提示let-7低表达与肺癌预后相关联。本次Meta分析纳入文章献数量多,患者人数多,比既往研究[8]更全面。本研究结果提示:let-7低表达与部分临床结局具有统计学关联性,let-7低表达是肺癌预后的一项危险因素,提示预后不良,但合并HR值仅为1.55,效力相对较弱。目前关于let-7是否为判断肺癌患者不良预后的独立因素仍有争议。Zhao等[13]通过回归分析证明:let-7c低表达与肺癌的转移、血管浸润和进展期有关,非肺癌患者不良预后的独立因素。Takamizawa等[4]通过回归分析发现let-7是肺癌患者不良预后的独立因素。为解决上述分歧需要更多、更标准的研究。本研究结果提示存在发表偏倚,因此应辩证地认识上述结果。
HMGA2作为一种染色体非组蛋白基因,主要参与基因转录、调节增殖分化,保证了癌细胞独立生长和迁移。研究[14-15]显示:let-7能特异性抑制HMGA2原癌基因,将能够降低HMGA2表达的有效剂量的let-7导入到肿瘤细胞中,结果并不能导致原癌基因RAS剂量的改变,表明let-7作用于HMGA2的靶向性优于RAS。除此之外,let-7还可通过负性调控癌基因C-MYC、MP-1、CRD-BP和细胞周期调节因子(如CDK6、Cyclin D2等)行使抑癌基因的功能[16-17],在非小细胞肺癌组织中let-7的表达水平下调,导致上述癌基因及细胞周期表达异常,致使肿瘤细胞增殖,最终影响肺癌预后。
HMGA2是一种非组蛋白的染色体构架蛋白,通过“AT-钩”与富含AT结构域的DNA结合,从而使DNA构象发生改变,参与调节细胞生长、增殖和凋亡等多种生物学过程,还可以通过上皮-间质转化,破坏DNA修复系统以及诱导转录细胞周期蛋白A等多种机制导致恶性肿瘤的形成。研究[18-20]显示:HMGA2蛋白参与人类多种肿瘤的发生,如结肠癌、前列腺癌和乳腺癌等。研究[2-3, 20-21]表明:HMGA2可参与肿瘤的发生发展,HMGA2在转移性肺腺癌组织中呈高表达,作为microRNA let-7家族的一种竞争性内源RNA (competing endogenous RNA, ceRNA),其可以促进癌症的进展及转移。此外,高表达HMGA2通过上调转化生长因子β(transforming growth factor-β, TGF-β)共受体Tgfbr3的表达,从而激活TGF-β信号通路。因此,高表达HMGA2既作为一种蛋白质编码基因,又作为一种非编码RNA促进癌症进展[21]。HMGA2的表达受多种分子调节,在肺癌组织中甲状腺转录因子1(thyroid transcription factor-1, TTF-1)扮演着重要的角色,但是,在低分化肺癌组织中TTF-1不表达。研究[22-23]表明:TTF-1通过直接或间接的方式诱导miR-33a的表达,从而抑制HMGA2表达,进而影响HMGA2mRNA的表达。TTF-1的缺失可引发HMGA2过表达。本研究结果显示:非小细胞肺癌组织和癌旁正常组织中HMGA2阳性表达率比较差异有统计学意义,提示HMGA2高表达与非小细胞肺癌的发生有关联性。HMGA2高表达与肺癌TNM分期及淋巴结转移与否有密切关联;TNM分期晚的肺癌患者肺癌组织中HMGA2阳性表达率较TNM分期早者高;HMGA2高表达与肺癌淋巴结的转移有关联性。
本研究的局限性:①各个文献之间存在不可消除的异质性。考虑可能源于患者的临床基本特征(如年龄、性别比例、肿瘤分期、病理类型和种族等)、数据分析、技术平台、截点值和检测的敏感性及特异性等差异。②所纳入的探讨HMGA2表达与患者性别及肺癌分化程度关系的文章数量较少,可能影响结果的真实性。③各研究之间存在发表偏倚,可能会影响最终结果。发表偏倚最可能的原因是阳性结果的报道更受重视,阴性结果则很少被发表或引用,容易遗漏。在未来的实验设计中应详细描述研究对象的特征,明确诊断标准和治疗范围,增加样本含量,加强对实验各阶段偏倚的控制。
综上所述,let-7有望成为肺癌预后的新型肿瘤标志物。本研究结果提示:HMGA2阳性表达率越高,肺癌发生的可能性就越大,就越具有侵袭性,因此HMGA2可能作为一种肺癌早期诊断的肿瘤标志物。本研究结果为肺癌的生物学行为以及预后的判断提供了新思路,为肺癌的生物学治疗开辟了新的途径。
| [1] | Shell S, Park SM, Radjabi AR, et al. Let-7 expression defines two differentiation stages of cancer[J]. Proc Natl Acad Sci U S A, 2007, 104(27): 11400–11405. DOI:10.1073/pnas.0704372104 |
| [2] | Califano D, Pignata S, Losito NS, et al. High HMGA2 expression and high body mass index negatively affect the prognosis of patients with ovarian cancer[J]. J Cell Physiol, 2014, 229(1): 53–59. |
| [3] | Kong D, Su G, Zha L, et al. Coexpression of HMGA2 and Oct4 predicts an unfavorable prognosis in human gastric cancer[J]. Med Oncol, 2014, 31(8): 130. DOI:10.1007/s12032-014-0130-5 |
| [4] | Takamizawa J, Konishi H, Yanagisawa K, et al. Reduced expression of the let-7 microRNAs in human lung cancers in association with shortened postoperative survival[J]. Cancer Res, 2004, 64(11): 3753–3756. DOI:10.1158/0008-5472.CAN-04-0637 |
| [5] | Inamura K, Togashi Y, Nomura K, et al. Let-7 microRNA expression is reduced in bronchioloalveolar carcinoma, a non-invasive carcinoma, and is not correlated with prognosis[J]. Lung Cancer, 2007, 58(3): 392–396. DOI:10.1016/j.lungcan.2007.07.013 |
| [6] | 严晓梅, 冯一中, 胥传海, 等. 微RNAlet7、高迁移率族蛋白在非小细胞肺癌中的表达及临床意义[J]. 江苏医药, 2011, 37(3): 294–297. |
| [7] | 杨大运, 齐战, 高少伟, 等. HMGA2和RKIP在非小细胞肺癌中的表达及其相关性[J]. 现代预防医学, 2015, 9: 1673–1676. |
| [8] | Xia Y, Zhu Y, Zhou X, et al. Low expression of let-7 predicts poor prognosis in patients with multiple cancers:a Meta-analysis[J]. Tumour Biol, 2014, 35(6): 5143–5148. DOI:10.1007/s13277-014-1663-0 |
| [9] | Blom IE, Goldschmeding R, Leask A. Gene regulation of connective tissue growth factor:new targets for antifibrotic therapy?[J]. Matrix Biol, 2002, 21(6): 473–482. DOI:10.1016/S0945-053X(02)00055-0 |
| [10] | Zhou ZR, Zhang T, Li B. Extracting and transforming of appropriate data of Meta-analysis in survival curve[J]. Chin J Evid Based Cardiovasc Med, 2014, 6: 3. |
| [11] | Nair VS, Maeda LS, Ioannidis JP. Clinical outcome prediction by microRNAs in human cancer:a systematic review[J]. Nair VS, 2012, 104(7): 528–540. |
| [12] | Voortman J, Goto A, Mendiboure J, et al. MicroRNA expression and clinical outcomes in patients treated with adjuvant chemotherapy after complete resection of non-small cell lung carcinoma[J]. Cancer Res, 2010, 70(21): 8288–8298. DOI:10.1158/0008-5472.CAN-10-1348 |
| [13] | Zhao B, Han H, Chen J, et al. MicroRNA let-7c inhibits migration and invasion of human non-small cell lung cancer by targeting ITGB3 and MAP4K3[J]. Cancer Lett, 2014, 342(1): 43–51. DOI:10.1016/j.canlet.2013.08.030 |
| [14] | Droge P, Davey CA. Do cells let-7 determine stemness?[J]. Cell Stem Cell, 2008, 2(1): 8–9. DOI:10.1016/j.stem.2007.12.003 |
| [15] | Mayr C, Hemann MT, Bartel DP. Disrupting the pairing between let-7 and Hmga2 enhances oncogenic transformation[J]. Science, 2007, 315(5818): 1576–1579. DOI:10.1126/science.1137999 |
| [16] | He XY, Chen JX, Zhang Z, et al. The let-7a microRNA protects from growth of lung carcinoma by suppression of k-Ras and c-Myc in nude mice[J]. J Cancer Res Clin Oncol, 2010, 136(7): 1023–1028. DOI:10.1007/s00432-009-0747-5 |
| [17] | Trang P, Wiggins JF, Daige CL, et al. Systemic delivery of tumor suppressor microRNA mimics using a nutral lipid emulsion inhibits lung tumors in mice[J]. Mol Ther, 2011, 19(6): 1116–1122. DOI:10.1038/mt.2011.48 |
| [18] | Helmke BM, Markowski DN, Meyer A, et al. The expression of HMGA2 varies strongly among colon carcinomas[J]. Anticancer Res, 2012, 32(5): 1589–1593. |
| [19] | Muller MH, Drieschner N, Focken T, et al. HMGA2 expression in the PC-3 prostate cancer cell line is autonomous of growth factor stimulation[J]. Anticancer Res, 2013, 33(8): 3069–3078. |
| [20] | Sun M, Song CX, Huang H, et al. HMGA2/TET1/HOXA9 signaling pathway regulates breast cancer growth and metastasis[J]. Proc Natl Acad Sci U S A, 2013, 110(24): 9920–9925. DOI:10.1073/pnas.1305172110 |
| [21] | Kumar MS, Armenteros-Monterroso E, East P, et al. HMGA2 functions as a competing endogenous RNA to promote lung cancer progression[J]. Nature, 2014, 505(7482): 212–217. |
| [22] | Rice SJ, Lai SC, Wood LW, et al. MicroRNA-33a mediates the regulation of high mobility group AT-hook 2 gene (HMGA2) by thyroid transcription factor 1(TTF-1/NKX2-1)[J]. J Biol Chem, 2013, 288(23): 16348–16360. DOI:10.1074/jbc.M113.474643 |
| [23] | Winslow MM, Dayton TL, Verhaak RG, et al. Suppression of lung adenocarcinoma progression by Nkx2-1[J]. Nature, 2011, 473(7345): 101–104. DOI:10.1038/nature09881 |
| [24] | Xia XM, Jin WY, Shi RZ, et al. Clinical significance and the correlation of expression between Let-7 and K-ras in non-small cell lung cancer[J]. Oncol Lett, 2010, 1(6): 1045–1047. |
| [25] | Landi MT, Zhao Y, Rotunno M, et al. MicroRNA expression differentiates histology and predicts survival of lung cancer[J]. Clin Cancer Res, 2010, 16(2): 430–441. DOI:10.1158/1078-0432.CCR-09-1736 |
| [26] | Zhang YK, Zhu WY, He JY, et al. MiRNAs expression profiling to distinguish lung squamous-cell carcinoma from adenocarcinoma subtypes[J]. J Cancer Res Clin Oncol, 2012, 138(10): 1641–1650. DOI:10.1007/s00432-012-1240-0 |
| [27] | Yanaihara N, Caplen N, Bowman E, et al. Unique microRNA molecular profiles in lung cancer diagnosis and prognosis[J]. Cancer Cell, 2006, 9(3): 189–198. DOI:10.1016/j.ccr.2006.01.025 |
| [28] | Jusufovic E, Rijavec M, Keser D, et al. let-7b and miR-126 are down-regulated in tumor tissue and correlate with microvessel density and survival outcomes in non-small-cell lung cancer[J]. PLoS One, 2012, 7(9): e45577. DOI:10.1371/journal.pone.0045577 |
| [29] | Capodanno A, Boldrini L, Proietti A, et al. Let-7g and miR-21 expression in non-small cell lung cancer:correlation with clinicopathological and molecular features[J]. Int J Oncol, 2013, 43(3): 765–774. |
| [30] | 兰芬, 熊盛道, 熊维宁, 等. 非小细胞肺癌中HMGA2的表达与细胞增殖的关系[J]. 中国组织化学与细胞化学杂志, 2008, 17(5): 416–420. |
| [31] | 刘晓静, 赵伟, 张庆宪. HMGA2、MMP2在非小细胞肺癌中的表达及临床意义[J]. 中国老年学杂志, 2011, 31(2): 209–211. |
| [32] | 肖晓辉, 刘华, 高婧. 高迁移率族蛋白A2和肿瘤转移抑制基因在非小细胞肺癌组织的表达及临床意义[J]. 临床荟萃, 2013, 28(2): 138–140. |
| [33] | Meyer B, Loeschke S, Schultze A, et al. HMGA2 overexpression in non-small cell lung cancer[J]. Mol Carcinog, 2007, 46(7): 503–511. DOI:10.1002/(ISSN)1098-2744 |
| [34] | Wu Y, Song Y, Liu H. Expression and its clinical significance of HMGA2 in the patients with non-small cell lung cancer[J]. Chin J Lung Cancer, 2008, 11(3): 377–381. |
| [35] | Eide HA, Halvorsen AR, Bjaanaes MM, et al. The MYCN-HMGA2-CDKN2A pathway in non-small cell lung carcinoma-differences in histological subtypes[J]. BMC Cancer, 2015, 16(1): 71. |
| [36] | Sarhadi VK, Wikman H, Salmenkivi K, et al. Increased expression of high mobility group A proteins in lung cancer[J]. J Pathol, 2006, 209(2): 206–212. DOI:10.1002/(ISSN)1096-9896 |
 2016, Vol. 42
2016, Vol. 42


