扩展功能
文章信息
- 赵美子, 王丹丹, 虞振静, 段颜莉, 马丽娜
- ZHAO Meizi, WANG Dandan, YU Zhenjing, DUAN Yanli, MA Lina
- 肝细胞损伤条件培养基对大鼠骨髓间充质干细胞肝向分化的促进作用
- Promotive effect of hepatocellular injury-conditioned medium on hepatic differentiation of bone marrow mesenchymal stem cells in rats
- 吉林大学学报(医学版), 2016, 42(06): 1108-1115
- Journal of Jilin University (Medicine Edition), 2016, 42(06): 1108-1115
- 10.13481/j.1671-587x.20160613
-
文章历史
- 收稿日期: 2016-09-08
目前,器官移植是治疗肝代谢异常或肝功能衰竭等终末期肝病患者的有效方案,包括生物人工肝移植和肝细胞移植,而肝脏或肝细胞移植因供体来源有限,限制了其临床应用。因此,获得高效供体肝系细胞系越来越受到人们关注[1-3]。1987年Friedenstein等[4]首先证实:哺乳动物骨髓基质中存在具有形成多种组织细胞分化潜能的细胞亚群,为原始的成纤维细胞克隆形成细胞(fibroblast colony-forming cells, FCFCs),即骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMMSCs)。骨髓干细胞主要包括成体祖细胞、造血干细胞和BMMSCs。而骨髓干细胞由于取材方便,可来自自体,可避免自体细胞异基因或异种细胞所致的免疫问题等优点而受到重视[5-7]。来自骨髓干细胞如造血干细胞或多能成体祖细胞是肝细胞分化的来源之一,而BMMSCs是否是肝系细胞的有效来源,或是否其更容易转化为肝系细胞尚无定论。BMMSCs在骨髓中的比例不到有核细胞总数的0.1%,且在体外培养时容易失去分化能力,所以BMMSCs所处的培养微环境对其存活、增殖和分化等有重要的影响,BMMSCs肝向分化的诱导条件和培养方法尚有待进一步研究。本研究采用肝细胞损伤大鼠肝组织匀浆上清和血清制备条件培养基(conditioned medium, CM),体外模拟损伤组织微环境,对大鼠BMMSCs进行诱导分化,探讨BMMSCs在肝细胞损伤条件培养基诱导下的分化潜能,旨在为骨髓干细胞移植治疗终末期肝病患者提供理论依据。
1 材料与方法 1.1 实验动物、主要试剂和仪器清洁级1周龄Wistar乳鼠90只,体质量10~13 g;6~8周龄Wistar大鼠40只,体质量180~200 g,购自吉林大学基础医学院实验动物中心,动物合格证号: SCXK (吉)2007-0003。L-DMEM培养基、胰蛋白酶和L-Glutamin (Gibico公司,美国),免疫组织化学检测试剂盒(武汉博士德生物公司),淋巴细胞分离液(Ficoll液,上海恒信化学试剂厂),抗大鼠CD105(endoglin,CD105)、白蛋白(albumin, ALB)及其二抗体IgG (Cyagenbioscience公司,美国)。-80℃低温冰箱MDF-U4086S、CO2培养箱和倒置相差显微镜(SANOY公司,日本)。
1.2 BMMSCs的分离培养取1周龄乳鼠,无菌条件下取四肢骨,用无菌1 mL注射器抽取其无血清L-DMEM冲洗髓腔,收集骨髓细胞。用含10%FBS的L-DMEM培养液重悬,接种入玻璃培养瓶,37℃、5%CO2饱和湿度孵箱培养,72 h首次换液。原代培养的大鼠BMMSCs培养6~7 d时,加入0.25%胰蛋白酶消化,用3 mL无血清L-DMEM重悬,倒入装有3 mL Ficoll液(密度为1.077 g·mL-1)的离心管中,进行密度梯度离心(参照说明书进行操作),收集的单核细胞以2×104 mL-1的密度接种于6孔板中,台盼蓝排斥实验检测细胞生长活力。当原代培养(P1)细胞融合达到70%~80%时,皆按1:2传代扩增。实验中尽量减少对细胞的损伤,缩短培养周期,保留其生物学特性。
1.3 免疫组织化学法检测BMMSCs表面标记物CD105取处于对数生长期的大鼠P3 BMMSCs,细胞约80%融合时进行爬片,参照试剂盒说明书进行操作,滴加二抗室温孵育30 min,PBS冲洗3次, 每次3 min,滴加链霉菌抗生物素-过氧化物酶溶液, 室温下孵育10 min, PBS冲洗, DAB显色, 苏木素复染, 自来水冲洗5 min返蓝。以BMMSCs中表达CD105阳性细胞占90%以上为满意结果。实验重复3次。
1.4 BMMSCs成脂诱导及鉴定取处于对数生长期的大鼠P3 BMMSCs,以0.25%胰酶消化,以1.5×104 mL-1接种于已处理过盖玻片的6孔培养板中。于培养第4、6、8和10天行油红O染色。将细胞分为20%马血清组、20%马血清+10 nmol·L-1氢化可地松(100 U·mL-1)组、10 nmol·L-1地塞米松(DM, 100 U·mL-1)+胰岛素(IS)10 mg·L-1+3-异丁基-1-甲基黄嘌呤(IBMX)100 mg·L-1+消炎痛(ID)60 mmol·L-1组和10%FBS L-DMEM组。各组BMMSCs均进行油红O染色,镜下观察脂滴形成情况,以脂滴被油红O染为红色为阳性结果。400倍镜下观察并任选15个视野,计算镜下阳性细胞所占百分比。
1.5 肝细胞损伤条件培养基的制备取6~8周龄Wistar大鼠2只,建立肝损伤大鼠模型。腹腔注射含60%CCl4的大豆油混合物(0.75 mL·kg-1),经注射后,大鼠进食量明显减少,精神不振,活动减少。肝损伤造模后24 h,以3%戊巴比妥钠麻醉模型大鼠,无菌条件下心脏取血,一般可取5~10 mL-1。3 000 r·min-1离心15 min,取上清血清;迅速取出大鼠肝组织,称取湿重,每0.15 g组织中加入1 mL L-DMEM (150 g·L-1),冰上研磨组织,4℃、12 000 g离心20 min,取上清液。将上述血清和组织匀浆上清过滤后于-20℃储存备用。
1.6 BMMSCs肝向诱导分化和功能鉴定 1.6.1 细胞分组取生长状态良好的大鼠P3 BMMSCs,以1.5×104 mL-1接种于放置无菌片的24孔培养板,并分为以下4组进行培养:0%CM组(对照组,用含10%FBS的L-DMEM培养)、10%肝细胞损伤组织匀浆上清(CM1)组(用含10%FBS的L-DMEM配制含10%CM1条件培养基培养)、10%CM1+10%肝细胞损伤血清(CM2)组(用含10%FBS的L-DMEM配制含10% CM1+10% CM2条件培养基培养)和20%CM2组(用含10%FBS的L-DMEM配制含20% CM2条件培养基培养)。CM1原液浓度为150 g·L-1。
1.6.2 免疫组织化学法检测各组细胞中ALB的阳性表达率P3 BMMSCs经CM诱导后7、14和21 d,细胞约80%融合时进行爬片(见方法1.3),以BMMSCs表达ALB阳性细胞占90%以上为满意结果。实验重复3次。400倍镜下观察并任选15个视野,计算镜下ALB的阳性表达率。
1.6.3 RT-PCR法检测各组细胞中ALB和甲胎蛋白(alpha-fetoprotein, AFP)的表达水平P3 BMMSCs经CM诱导后14d,收集细胞,4组细胞采用Trizol试剂从细胞中提取总mRNA,采用Nano-Drop分光光度计法测定mRNA浓度,按照RT-PLR Kit说明书进行逆转录cDNA, 观察各组细胞中ALB和AFP的表达水平。
1.6.4 细胞糖原染色法观察各组细胞中糖原合成阳性率室温下用4%多聚甲醛固定细胞爬片,高碘酸作用15 min,蒸馏水冲洗,Schiff试剂染色(periodic Acid-Schiff staining, PAS),苏木素复染。胞浆中呈红色颗粒为阳性结果。400倍镜下观察并任选15个视野,计算镜下细胞中糖原合成阳性率。
1.7 统计学分析采用SPSS 12.0统计软件对数据进行统计学分析。各组BMMSCs中ALB阳性表达率、糖原合成阳性率和脂滴形成阳性率以x±s表示,组间比较采用单因素方差分析,两两比较采用t检验。以α=0.05为检验水准。
2 结果 2.1 BMMSCs的形态表现大鼠骨髓细胞原代培养24 h,镜下可见大量细沙样细胞,培养48 h后细胞数量增多,72 h后进行首次换液(延长首次换液时间有利于干细胞的贴壁和增殖),镜下观察贴壁细胞呈圆形或呈梭形,见图 1A。Ficoll分离液分离出的单核细胞经培养,增殖迅速(未脱落的细胞黏附性强,并非间充质干细胞),3~5 d进入对数生长期,6~7 d铺满瓶底,可进行传代。细胞间密度较小时细胞呈梭形或纺锤形或三角形,且呈伸展状,见图 1B。当细胞扩增铺满瓶底,细胞间密度较大时,细胞呈均匀有序的细长梭形状(图 1C和D)。用该方法培养原代细胞对细胞伤害小,操作方法简单,这种差时贴壁及差速梯度法结合优化差速梯度离心时间和贴壁换液时间进行分离培养,可获得纯度较高的BMMSCs。
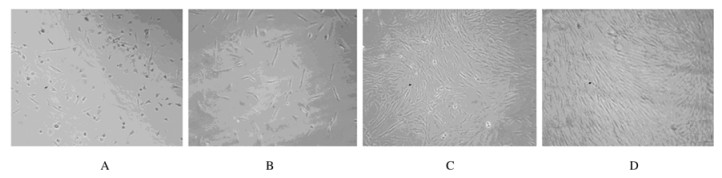
|
| A: Primary cultured; B: Cultured for 3 d; C: Cultured for 8 d; D: Cultured for 10 d. 图 1 原代培养的BMMSCs形态表现(×100) Figure 1 Morphology of primary cultured BMMSCs (×100) |
|
|
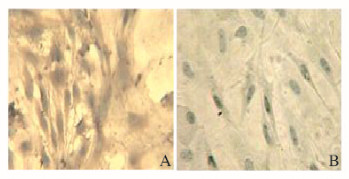
P3 BMMSCs CD105免疫组织化学染色为阳性,细胞呈棕色,HE复染细胞核为蓝色(图 2A,见插页三);无一抗的对照组细胞无染色呈阴性,细胞核为蓝色(图 2B,见插页三),提示所获得的P3细胞是CD105阳性BMMSCs,且占培养细胞数的98%以上。
20%马血清组、20%马血清+氢化可的松组和DX+IBMX+IS+ID组P3 BMMSCs经成脂诱导后,形态变得不规则,细胞逐渐变大,胞浆中出现脂滴,呈现脂肪细胞外观,并出现白色脂肪细胞集落。油红O染色可见不同数量的橘红色脂滴。BMMSCs经DX+IBMX+IS+ID组诱导后8 d脂滴体积最大(图 3A~C,见插页三),未加诱导剂的对照组BMMSCs则呈阴性反应(图 3D,见插页三)。P3 BMMSCs经20%马血清诱导后8 d、经20%马血清+氢化可的松诱导后6 d、经DX、IBMX、IS和ID联合诱导后4 d细胞中出现脂滴。3种诱导剂在诱导第8天时脂滴形成阳性率均在90%以上;与对照组比较,3种诱导剂脂滴形成阳性率均明显增加(P < 0.01),各诱导剂组间比较差异无统计学意义(P>0.05),见表 1。DX+IBMX+IS+ID组BMMSCs经诱导后首先成脂分化,出现脂滴时间最早。
|
| A: Positive expression of CD105; B: Negative expression of CD105. 图 2 BMMSCs表面抗原CD105的表达(SP, ×400) Figure 2 Expressions of surface antigens CD105 in BMMSCs (SP, ×400) |
|
|
|
| A: 20% horse serum group; B: 20% horse serum+hydrocortisone group; C: DX+IBMX+IS+ID group; D: Control group. 图 3 各组BMMSCs成脂诱导后脂肪细胞形态表现(油红O, ×400) Figure 3 Morphology of fat cells after adipogenic induction of BMMSCs in various groups (Oil red O, ×400) |
|
|
| (n=8) | ||
| Group | Positive rate of lipid droplet (η/%) | Formation time (t/d) |
| Control | 0 | 0 |
| 20% Horse serum | 90.1±1.0** | 8 |
| 20% Horse serum+ Hydrocortisone |
90.5±2.2** | 6 |
| DX+IBMX+IS+ID | 90.3±2.6** | 4 |
| * * P<0.01 vs control group. | ||
P3 BMMSCs用含CM培养液分组继续培养,诱导后7 d,10%CM1组、20%CM2组和10%CM1+10%CM2组细胞形态发生明显变化,胞浆内容物变得丰富,呈类上皮样细胞。细胞有的逐渐变圆,有的呈三角形或呈肝板样排列,形态与肝细胞相似,而未加CM的对照组细胞仍然呈成纤维梭形状。见图 4。
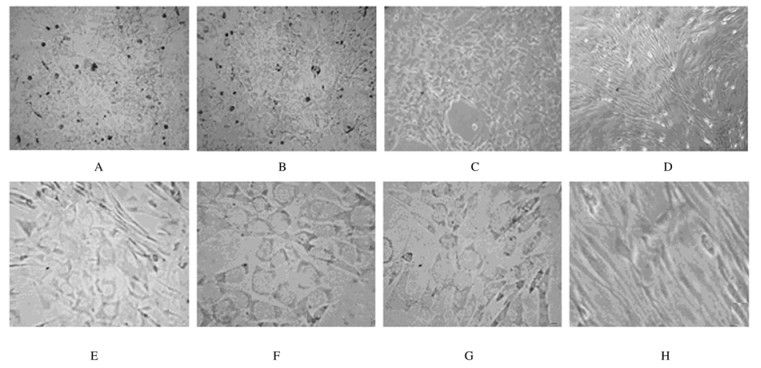
|
| A-D: ×100; E-H: ×400;A, E: 10%CM1 group; B, F: 10%CM1+10%CM2 group; C, G: 20%CM2 group; D, H: Control group. 图 4 各组BMMSCs肝向诱导后肝样细胞形态表现 Figure 4 Morphology of hepatocyte-like cells after hepatic induction of BMMSCs in various groups |
|
|
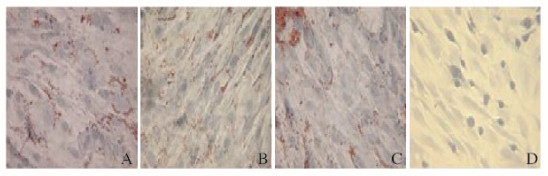
P3 BMMSCs经CM诱导后7、14和21 d进行免疫组织化学检测的结果显示:随着诱导时间的延长,与对照组比较,含CM成分的3组BMMSCs中ALB阳性表达率均明显升高(P < 0.01),见表 2。对照组细胞经诱导后呈阴性反应(图 5A~C,见插页四)。含CM成分的3组细胞经CM诱导后胞浆中可见阳性棕色颗粒(图 5D~F,见插页四)。10%CM1组和20%CM2组细胞ALB阳性表达率比较差异无统计学意义(P > 0.05),见表 2;10%CM1+10%CM2组BMMSCs中ALB阳性表达率高于10%CM1组和20%CM2组(P < 0.05),见表 2。RT-PCR检测结果显示:含CM成分的3组BMMSCs中均有肝细胞特异性标记物AFP和功能分泌蛋白ALB的表达。10%CM1+20%CM2组细胞中AFP表达水平和ALB阳性表达率略高于10%CM1和20%CM2组(P < 0.05),见表 2和图 6。
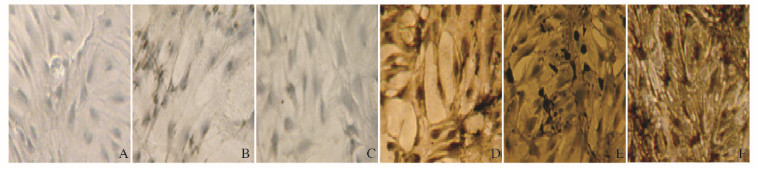
|
| A-C: Control group; D: 10%CM1 group; E: 10%CM1+ 10%CM2 group; F: 20%CM2 group. 图 5 肝向诱导后各组BMMSCs中ALB的表达(SP, ×200) Figure 5 Expressions of ALB in BMMSCs in various groups after hepatic induction (SP, ×200) |
|
|
| (n=8, x±s, η/%) | ||||
| Group | Positive expression rate of ALB | |||
| (t/d) | 7 | 14 | 21 | |
| Control | 0 | 0 | 0 | |
| 10% CM1 | 18.9±2.3* | 72.9±2.0* | 89.1±2.6* | |
| 20% CM2 | 19.5±2.0* | 73.1±3.0* | 89.8±2.3* | |
| 10% CM1+10%CM2 | 22.1±2.5*△# | 79.7±3.9*△# | 95.2±2.4*△# | |
| *P<0.01 vs control group; △P<0.05 vs 10%CM1 group; #P<0.05 vs 20%CM2 group. | ||||

|
| M: DNA marker Ⅱ; Lane 1: Control group; Lane 2: 10%CM1 group; Lane 3: 10%CM1+10%CM2 group; Lane 4: 20% CM2 group. 图 6 肝向诱导后各组BMMSCs中AFP和ALB蛋白表达电泳图 Figure 6 Electrophoregram of expressions of AFP and ALB in BMMSCs in various groups after hepatic induction |
|
|
P3 BMMSCs经CM诱导后7和14 d,经CM诱导的各组细胞中糖原染色呈阳性,可见胞浆染成红色(图 7A~C,见插页四)。对照组细胞中糖原染色呈阴性,胞浆没有着色(图 7D~F, 见插页四),随着诱导时间的延长,与对照组比较,含CM成分的3组BMMSCs中糖原合成阳性率均明显升高(P<0.01);10%CM1组和20%CM2组细胞中糖原合成阳性率比较差异无统计学意义(P>0.05);10%CM1+10%CM2组BMMSCs中糖原阳性率高于10%CM1组和20%CM2组(P < 0.05)。见表 3。
| (n=8, x±s, η/%) | ||||
| Group | Positive rate of glycogen synthesis | |||
| (t/d) | 7 | 14 | ||
| Control | 0 | 0 | ||
| 10% CM1 | 2.9±1.1* | 7.4±1.0* | ||
| 20%CM2 | 3.0±1.2* | 7.2±0.6* | ||
| 10% CM1+10% CM2 | 4.7±0.9*△# | 11.4±0.7*△# | ||
| *P<0.01 vs control group; △P<0.05 vs 10%CM1 group; #P<0.05 vs 20%CM2 group. |
||||
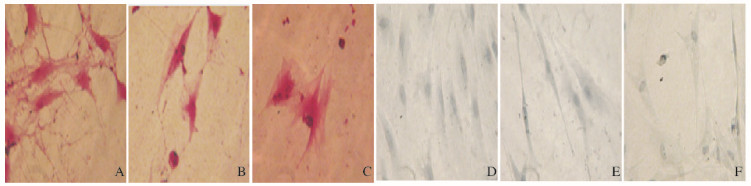
|
| A: 10%CM1 group; B: 10%CM1+10%CM2 group; C: 20%CM2 group; D-F: Control group. 图 7 肝向诱导后各组BMMSCs中糖原染色表现(PAS, ×400) Figure 7 Glycogen staining results of BMMSCs in various groups after hepatic induction (PAS, ×400) |
|
|
BMMSCs作为骨髓成体干细胞,具有很强的自我更新能力和多向分化潜能,不仅可为细胞移植提供供体,且因低免疫原性避免了移植排斥反应,逐渐受到人们的重视[8-10]。Friedenstein等[4]首先对骨髓细胞进行分离和培养, 证明其具有干细胞特性,Sato等[3]证明:BMMSCs CD34阴性细胞具有高效的肝向分化能力。BMMSCs在骨髓中所占比例很小,因此在体外大量扩增BMMSCs,建立肝细胞诱导微环境显得尤为重要。本研究选用1周龄乳鼠的骨髓作为BMMSCs的来源,经全血差时贴壁和差速梯度法结合优化梯度离心和贴壁换液时间分离培养获得BMMSCs,观察结果显示:贴壁细胞增殖速度较快,P3细胞呈均匀有序的成纤维细胞样,呈平行状、放射状或旋涡状排列。CD105是BMMSCs的特征性表型之一,是BMMSCs增殖的重要特异性标志物[11-12]。本研究结果显示:CD105呈阳性表达,以上结果与相关研究[6, 13]结果一致。P3 BMMSCs经20%马血清、20%马血清+氢化可的松、DM+IS+ID+IBMX成脂诱导后其脂滴形成均显示阳性,尤其是DM+IS+ID+IBMX组经诱导的BMMSCs分化时间只需4 d,鉴定分化潜能方法简便。本研究采用上述培养方法获得了增殖能力旺盛、成功率高且具有多向分化潜能的BMMSCs。
干细胞移植治疗肝病的重要机制是细胞移植后使移植细胞趋化,归巢至受损组织,进行细胞分化,促进组织修复,这一过程受到诸多复杂因素的调控,其关键因素和机制尚不清楚[14-15]。当组织细胞受损或内源性干细胞缺乏时,病理组织微环境可支持外源性干细胞的活性,使其趋化归巢至受损组织,填充或取代内源性干细胞而发挥很强的再生功能和自我修复能力[14]。Maher等[16]发现:肝损伤超过24 h后,由再生肝组织分离获得的内皮细胞分泌的肝细胞生长因子(hepatocyte growth factor,HGF)水平是正常大鼠分离细胞中的2~3倍。Yamazaki等[17]采用肝衰竭患者的血清、抑瘤素M、HGF和地塞米松诱导骨髓干细胞,2周后显示肝样细胞标志物,其认为肝衰竭患者血清和肝间质细胞产生的细胞因子和细胞外基质可能是促使骨髓干细胞横向分化的原因。肝组织损伤不仅对干细胞有趋化作用,而且更有利于干细胞向肝细胞定向分化。本研究选取肝细胞损伤后24 h的血清和组织匀浆上清制备肝细胞损伤条件培养液,体外模拟肝组织损伤微环境,诱导BMMSCs分化,为细胞体内移植进行诱导分化研究提供了一种更为直观的方法。本研究在P3 BMMSCs中添加3种CM培养液诱导后观察形态学结果显示:在诱导后7 d,含CM成分的3组细胞形态均发生明显变化,胞浆内容物变得丰富,呈类上皮样细胞,随着诱导时间的逐渐延长,细胞逐渐变成圆形或呈三角形或呈肝板样排列,形态与肝细胞相似。本研究中,AFP和糖原合成是目前常用于鉴定干细胞肝向分化的特异性标志物,AFP是未成熟肝细胞的标志,糖原只存在于肝细胞中。本研究结果显示:含CM成分的3组细胞中AFP表达和糖原合成均显示阳性,表明BMMSCs在3种含CM成分培养液微环境中均可向肝细胞分化。ALB主要由肝细胞合成和分泌,是最常用的一个肝细胞功能检测指标。本研究结果显示:与对照组比较,体外诱导7、14和21 d,含CM成分的3组细胞中ALB阳性表达率明显增加;诱导后7和14 d,细胞中糖原合成阳性率明显升高,进一步说明BMMSCs经诱导后所形成的肝样细胞具备肝细胞的功能。本研究结果显示:P3 BMMSCs经3种CM培养液诱导后7、14和21 d,与10%CM1组和20%CM2组比较,10%CM1+10%CM2组细胞中ALB阳性表达率明显升高;诱导后7和14 d,10%CM1+10%CM2组细胞中糖原合成阳性率明显增加;表明BMMSCs肝向分化过程中,在达到相同诱导作用效果时诱导所需的CM1和CM2浓度更低,10%CM1+10%CM2组提供的微环境更有利于BMMSCs向肝细胞分化,细胞分化的效率更高,提示肝损伤条件培养基中的诱导相关因子可能是BMMSCs分化的关键因素。
肝组织损伤会导致肝脏组织中的各种细胞因子水平发生变化,机体局部和全身作出应激反应,产生促肝细胞再生的各种酶、体液因子、细胞因子和调控基因。肝再生过程中会产生很多起重要作用的生长因子和细胞因子,如HGF、表皮生长因子(epidermal growth factor, EGF)、转化生长因子2(transforming growth factor-2, TGF-2)、白细胞介素26(IL-26)、肿瘤坏死因子2(tumor necrosis factor -2, TNF-2)、胰岛素和去甲肾上腺素等,肝损伤期HGF作为关键的肝再生因子发挥重要作用[18-20]。研究[19]显示:成纤维细胞来源的HGF并无促进细胞生长的作用,仅在细胞分化过程中促使细胞迁移和扩散。本研究采用CM1和CM2条件培养液体外模拟损伤组织微环境,确定了其对BMMSCs肝向分化的作用,说明肝组织损伤可能提供了更有利于BMMSCs向肝细胞分化的微环境,促进移植体内的干细胞进入肝脏发挥修复作用。有关诱导BMMSCs肝向分化关键因子的研究、所模拟的体内微环境中各因子之间相互作用的复杂性还有待进一步探讨。
| [1] | Yin L, Zhu Y, Yang J, et al. Adipose tissue-derived mesenchymal stem cells differentiated into hepatocyte-like cells in vivo and in vitro[J]. Mol Med Rep, 2015, 11(3): 1722–1732. |
| [2] | Winkler S, Borkham-Kamphorst E, Stock P, et al. Human mesenchymal stem cells towards nonalcoholic steatohepatitis in an immunodeficient mouse model[J]. Exp Cell Res, 2014, 326(2): 230–239. DOI:10.1016/j.yexcr.2014.04.017 |
| [3] | Sato Y, Araki H, Kato J, et al. Human mesenchymal stem cells xenografted directly to rat liver are differentiated into human hepatocytes without fusion[J]. Blood, 2005, 106(2): 756–763. DOI:10.1182/blood-2005-02-0572 |
| [4] | Friedenstein AJ, Chailakhyan RK, Gerasimov UV. Bone marrow osteogenic stem cells:invitro cultivation and transplantation in diffusion chambers[J]. Cell Tissue Kinet, 1987, 20(3): 263–272. |
| [5] | Wagers AJ, Christensen JL, Weissman IL, et al. Cell fate determination from stem cells[J]. Gene Ther, 2002, 9(10): 606–612. DOI:10.1038/sj.gt.3301717 |
| [6] | Huang J, Sha H, Wang G, et al. Isolation and characterization of exvivo expanded mesenchymal stem cells obtained from a surgical patient[J]. Mol Med Rep, 2015, 11(3): 1777–1783. |
| [7] | Lee S, Chio E, Cha MJ, et al. Cell adhesion and long-term survival of transplanted mesenchymal stem cells:a prerequisite for cell therapy[J]. Oxid Med Cell Longev, 2015, 2015(1): 1–9. |
| [8] | Haque N, Kasim NH, Rahman MT. Optimization of pretransplantation conditions to enhance the efficacy of mesenchymal stem cells[J]. Int J Biol Sci, 2015, 11(3): 324–334. DOI:10.7150/ijbs.10567 |
| [9] | Bianco P, Robey PG, Simmons PJ. Mesenchymal stem cells:revisiting history, concepts, and assays[J]. Cell Stem Cell, 2008, 2(4): 313–319. DOI:10.1016/j.stem.2008.03.002 |
| [10] | Wang Y, Deng Y, Zhou GQ. SDF-1alpha/CXCR4-mediated migration of systemically transplanted bone marrow stromal cells towards ischemic brain lesion in a rat model[J]. Brain Res, 2008, 1195(2): 104–112. |
| [11] | Barry FP, Boynton RE, Haynesworth S, et al. The monoclonal antibody SH-2, raised against human mesenchymal stem cells, recognizes an epitope on endoglin (CD105)[J]. Biochem Biophys Res Commun, 1999, 265(1): 134–139. DOI:10.1006/bbrc.1999.1620 |
| [12] | Goussetis E, Spiropoulos A, Theodosaki M, et al. Culture of bone marrow CD105+ cells allows rapid selection of pure BM-stromal cells for chimerism studies in patients undergoing allogeneic bone marrow transplantation[J]. Bone Marrow Transplant, 2005, 36(6): 557–559. DOI:10.1038/sj.bmt.1705083 |
| [13] | Bortolotti F, Ukovich L, Razban V, et al. Invivo therapeutic potential of mesenchymal stromal cells depends on the source and the isolation procedure[J]. Stem Cell Reports, 2015, 4(3): 332–339. DOI:10.1016/j.stemcr.2015.01.001 |
| [14] | Spradling A, Drummond-Barbosa D, Kai T. Stem cells find their niche[J]. Nature, 2001, 414(414): 98–104. |
| [15] | Zhao J, Zhang N, Prestwich GD, et al. Recruitment of endogenous stem cells for tissue repair[J]. Macromol Biosci, 2008, 8(9): 836–842. DOI:10.1002/mabi.v8:9 |
| [16] | Maher J, Jacquely N. Cell-specific expression of hepatocyte growth factor in liver upregulation in sinusoidal endothelial after carbon tetrachloride Invest[J]. Clin J Inc, 1993, 91(5): 2244–2252. DOI:10.1172/JCI116451 |
| [17] | Yamazaki S, Miki K, Hasegawa K, et al. Sera from liver failure patients and a demethylating agent stimulate transdifferentiation of murine bone marrow cells into hepatocytes in coculture with non-parenchymal liver cells[J]. J Hepatol, 2003, 39(1): 17–23. DOI:10.1016/S0168-8278(03)00150-8 |
| [18] | Okumoto K, Saito T, Hattori E, et al. Differentiation of bone marrow cells into cells that express liver-specific genes in vitroimplication of the Notch signals in differentiation[J]. Biochem Biophys Res Commun, 2003, 304(4): 691–695. DOI:10.1016/S0006-291X(03)00637-5 |
| [19] | Schmidt C, Bladt F, Goedecke S, et al. Scatter factor/hepatocyte growth factor is essential for liver development[J]. Nature, 1995, 373(6516): 699–702. DOI:10.1038/373699a0 |
| [20] | Rappolee DA, Basilico C, Patel Y, et al. Expression and function of FGF-4 in periimplantation development in mouse embryos[J]. Development, 1994, 120(8): 2259–2269. |
 2016, Vol. 42
2016, Vol. 42


