扩展功能
文章信息
- 张美双, 张宇, 任伯颖, 唐珊, 孙佳明, 张辉
- ZHANG Meishuang, ZHANG Yu, REN Boying, TANG Shan, SUN Jiaming, ZHANG Hui
- 人参黄连组合物对糖尿病肾病小鼠的治疗作用
- Therapeutical effect of Ginseng and Coptis composition on diabetic nephropathyin mice
- 吉林大学学报(医学版), 2016, 42(06): 1104-1107
- Journal of Jilin University (Medicine Edition), 2016, 42(06): 1104-1107
- 10.13481/j.1671-587x.20160612
-
文章历史
- 收稿日期: 2016-01-04
糖尿病的危害几乎均由其各种并发症引起[1]。糖尿病肾病(diabetic nephropathy, DN)在2型糖尿病患者中的发病率为20%~25%[2],DN发病过程为进行性肾功能缓慢减退其所引起的终末期肾病(end stage renal disease, ESRD)是导致患者死亡的主要原因[3]。DN的发病机制复杂,目前临床上还无完全有效的根治方法。人参黄连药方出自《万病回春》[4]中“参连饮”,具有益气生津和清热燥湿的功效,是中医治疗“消渴症”古方中清热益气药[5]的代表。现代中医临床研究[6-7]显示:人参黄连合用对2型糖尿病的治疗作用显著。现代药理学研究也表明:人参黄连合用具有很好的降糖作用。但人参总皂苷与黄连总生物碱联合应用治疗2型糖尿病的靶点和作用机制尚有待进一步研究。
1 材料与方法 1.1 实验动物和主要试剂250只C57雄性小鼠,体质量16~18 g,购于北京维通利华实验动物有限公司,动物合格证号:SCXK (京)2013-0001。人参总皂苷购于吉林省宏久参业科技股份有限公司,纯度>75%;黄连总生物碱为本实验室自制,采用紫外分光光度法,在波长349 nm处检测总碱纯度>99%;链脲佐菌素(streptozotocin, STZ)购于北京鼎国生物技术公司;柠檬酸和柠檬酸钠购于北京化工厂;卡托普利购于上海信谊天平药业;葡萄糖测试盒、尿微量白蛋白定量测试盒、尿素氮测试盒、肌酐测定试剂盒、总胆固醇和甘油三酯测试盒均购于南京建成生物工程研究所。
1.2 实验动物模型建立和分组小鼠正常饲料含有5%脂肪、53%碳水化合物和23%蛋白,总热量为25 kJ·kg-1;高脂饲料含有45%脂肪、48%碳水化合物、20%蛋白,总热量为44.3 kJ·kg-1。250只小鼠中随机选取10只作为正常对照组,其余240只用于制备DN模型。正常对照组小鼠饲喂正常饲料,参照文献[8];DN模型组小鼠给予高脂饲料4周,腹腔注射STZ (100 mg·kg-1)2次,每次间隔1周。正常对照组小鼠给予同等体积的枸橼酸缓冲液。STZ注射4周后,禁食,剪尾取血,测量空腹血糖(fasting blood glucose, TBG),FBG>7.0 mmol·L-1为糖尿病的诊断标准。
参照文献[9],糖尿病模型制备成功后,继续喂养1周,以1周后尿量大于造模前50%,24 h尿白蛋白大于造模前50%作为DN模型制备成功的标志。将造模成功的小鼠按体质量随机分为模型对照组、低(80 mg·kg-1+20 mg·kg-1)、中(160 mg·kg-1+40 mg·kg-1)和高(320 mg·kg-1+80 mg·kg-1)剂量人参黄连组合物组、黄连总生物碱组(320 mg·kg-1)、人参总皂苷组(80 mg·kg-1)及卡托普利(8 mg·kg-1)组,每组10只。给药期间每周记录小鼠体质量,并观察小鼠状态。
1.3 各组小鼠给药方法正常对照组与模型对照组小鼠给予等体积生理盐水,低、中和高剂量人参黄连组合物组及黄连总生物碱组、人参总皂苷组、卡托普利组小鼠的给药途径为灌胃,给药时程为8周,各组小鼠每日灌胃相应的药物(给药容积为10 mL·kg-1)。
1.4 标本的采集方法各组小鼠治疗性给药8周后,测量小鼠体质量,置于代谢笼中收集24h尿液。禁食12~16 h,以氨基甲酸乙酯(100 mg·kg-1)腹腔注射麻醉,腹主动脉取血,离心后取血清;留取小鼠肾脏,一部分以10%甲醛固定,另一部分于-80℃冰箱冻存备用。
1.5 各组小鼠生化指标和病理组织形态表现小鼠FBG、尿微量白蛋白(microalbuminuria, MAU)、尿素氮(blood urea nitrogen, BUN)、血肌酐(serum creatinine, Scr)、总胆固醇(total cholesterol, TC)和甘油三酯(triglyceride, TG)水平均按照相应试剂盒说明书进行检测。采用石蜡包埋切片法将小鼠肾组织包埋切片,采用HE染色法观察小鼠肾脏病理组织学表现。
1.6 统计学分析采用SPSS13.0统计软件进行统计学分析。各组小鼠FBG、MAU、BUN、Scr、TC和TG水平以x±s表示,组间比较采用t检验。以α=0.05为检验水准。
2 结果 2.1 各组小鼠一般生理状况实验过程中,对各组小鼠的生理状态进行观测并记录。正常对照组小鼠精神活跃,活动频繁,毛发顺滑有光泽,进食和饮水量均正常,尿量正常,体质量增加趋势稳定;模型对照组小鼠精神萎靡,活动频率低,眼球缺血苍白,毛发枯燥无光泽,呈现高饮水低进食现象,尿量多,垫料潮湿,需要每天更换;低、中和高剂量人参黄连组合物组及黄连总生物碱组、人参总皂苷组、卡托普利组小鼠糖尿病症状如尿量增多均明有显改善。各组均存在意外死亡的小鼠,其数据并未记录于最终统计结果中。
2.2 各组小鼠FBG、TC和TG水平低、中和高剂量人参黄连组合物组及黄连总生物碱组、卡托普利组小鼠FBG水平均低于模型对照组(P < 0.05),血清TC水平均低于模型对照组(P < 0.05)。中和高剂量人参黄连组合物组、黄连总生物碱组及卡托普利组小鼠TG水平均低于模型对照组,但高剂量人参黄连组合物组小鼠TG水平明显低于模型对照组(P < 0.05)。见表 1。
| Group | FBG | TC | TG |
| Normal control | 4.9±0.40 | 2.03±0.12 | 0.71±0.26 |
| Model control | 9.0±0.10 | 5.76±0.35 | 1.46±0.41 |
| Ginseng and Coptis composition | |||
| Low dosage | 7.7±0.30* | 4.82±0.36** | 1.48±0.25 |
| Middle dosage | 7.3±0.30* | 4.13±0.51** | 1.33±0.26 |
| High dosage | 5.9±0.40* | 3.80±0.43** | 1.07±0.12* |
| Coptis | 6.8±0.20* | 4.11±0.27** | 1.13±0.28 |
| Ginsenoside | 10.0±0.40 | 4.24±0.55* | 1.62±0.21 |
| Captopril | 7.4±0.20* | 3.69±0.38** | 1.25±0.16 |
| * P < 0.05,* * P < 0.01 vs model control group | |||
与模型对照组比较,低、中和高剂量人参黄连组合物组小鼠MAU水平和血清BUN水平明显降低(P < 0.01)。Scr水平的变化趋势与血清BUN水平相似,但由于标准差较大,因此其与模型对照组比较差异无统计学意义(P > 0.05)。见表 2。
| Group | 24 h urine volume (V/mL) | MAU[ρB/(mg·L-1)] | BUN[cB/(mmol·L-1)] | Scr[cB/(μmol·L-1)] |
| Normal control | 1.63±0.17 | 9.06±0.41 | 0.92±0.13 | 52.45±20.63 |
| Model control | 5.18±0.38 | 32.93±4.87 | 1.57±0.11 | 127.96±71.73 |
| Ginseng and Coptis composition | ||||
| Low dosage | 4.83±0.17* | 25.53±1.74* | 1.22±0.18** | 116.69±15.79 |
| Middle dosage | 3.65±0.36** | 21.10±1.07** | 1.09±0.20** | 67.74±27.55 |
| High dosage | 2.75±0.46** | 13.86±0.81** | 1.00±0.35** | 60.38±36.18 |
| Coptis | 4.08±0.22** | 22.22±1.82** | 1.21±0.10** | 77.84±46.19 |
| Ginsenoside | 4.77±0.17 | 23.46±1.58** | 1.32±0.22* | 116.69±15.19 |
| Captopril | 3.15±0.31** | 17.74±1.05** | 1.04±0.16** | 65.50±47.87 |
| * P < 0.05,* * P < 0.01 vs model control group. | ||||
给予STZ后3个月,DN模型制备成功,小鼠肾脏组织中可见肾小球-肾间质改变:肾小球系膜基质弥漫性增多,毛细血管基底膜弥漫性增厚,毛细血管腔变窄,肾小管上皮细胞呈颗粒样和空泡样变性及萎缩,肾间质水肿和淋巴细胞浸润。低、中和高剂量人参黄连组合物组DN小鼠的肾小球-肾间质病变均改善,其中以中和高剂量人参黄连组合物组小鼠改善效果最明显。黄连总生物碱组和卡托普利组小鼠的改善效果与中剂量人参黄连组合物组相当。人参总皂苷组DN小鼠的上述病理改变亦有改善。见图 1(插页三)。
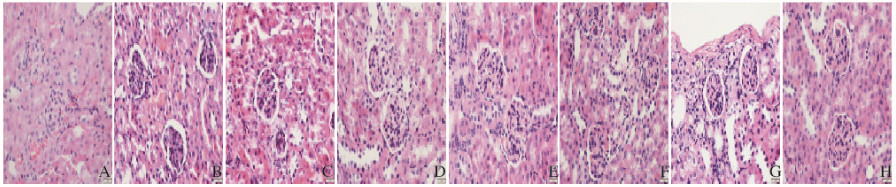
|
| A:Normal control group; B:Model control group; C-E:Low, middle, and high dosages of Ginseng and Coptis composition group; F:Coptis group; G:Ginsenoside group; H:Captopril group. 图 1 各组小鼠肾脏组织病理学表现(HE, ×400) Figure 1 Pathology of kidney tissue of mice in various groups (HE, ×400) |
|
|
本研究结果显示:人参黄连组合物能够明显降低糖尿病小鼠的FGB值,降低早期DN小鼠尿微量白蛋白及血清BUN水平,降低DN小鼠TG和TC水平,改善DN小鼠的肾脏组织形态,提示其对C57小鼠早期DN具有一定的治疗作用。人参中含有多种皂苷类成分,现代药理研究[10-14]表明:人参皂苷具有调节免疫力、改善微循环、调节血糖、抑制血小板聚集和提高组织抗缺氧能力等作用。黄连总生物碱是黄连的主要成分,具有广泛的生物活性,如抗氧化、抗炎、抗癌、抗心律失常、降压和降糖等作用[15]。临床研究和动物实验[16-18]研究结果显示:黄连总生物碱对糖尿病具有很好的降糖以及抑制氧化应激损伤的作用。中药配伍是中医用药的特色和优势,充分体现了中医的“整体观念”和“辨证论治”的精髓,所有的方剂均是在中医药理论指导下遵循配伍规律组成的。现代药理学研究[19-21]表明:人参黄连合用具有很好的降糖作用。DN作为糖尿病的并发症之一,临床症状主要表现为高血糖、高血压和蛋白尿,肾小球硬化导致肾功能不全, 最终发展至ESRD。本研究结果表明:人参黄连组合物治疗8周后,DN小鼠FBG、血清BUN、MAU、TG和TC水平均降低,肾小球-肾间质病变明显改善,表明人参黄连组合物可能通过降低小鼠血糖,修复肾小球-肾间质病变,减少MAU,改善肾功能,延缓肾脏损害进程。同时,高剂量人参黄连组合物对小鼠DN的治疗和改善情况均优于黄连总生物碱和人参总皂苷,表明配伍后的中药复方产生了协同增效的作用。但人参黄连组合物中对肾脏起保护作用的物质基础及2种药物配伍后的成分变化仍有待研究。
| [1] | Melpomeni P, Jaime U, Helen V. Glucose, advanced glycation end products, and diabetes complications:what is new and what works[J]. Diabetes Res Clin Pr, 2003, 21(4): 186–187. DOI:10.2337/diaclin.21.4.186 |
| [2] | 迟家敏, 汪耀, 周迎生. 实用糖尿病学[M]. 北京: 人民卫生出版社,2009: 511. |
| [3] | Crabbe MJ, Goode D. Aldose reductase:a window to the treatment of diabetic complications[J]. Prog Retin Eye Res, 1998, 17(3): 313–383. DOI:10.1016/S1350-9462(97)00013-X |
| [4] | 徐春娟, 陈荣. 《万病回春》与名方温清饮[J]. 中医文献杂志, 2011, 29(2): 5–7. |
| [5] | 王世东.清热益气中药配伍治疗2型糖尿病机制研究[D].北京:北京中医药大学, 2007. http://www.cnki.com.cn/Article/CJFDTotal-NZYY201423021.htm |
| [6] | 劳汝明. 清热益气汤配伍治疗2型糖尿病52例临床研究[J]. 四川中医, 2015, 33(1): 81–83. |
| [7] | 袁卉屏. 清热益气法治疗2型糖尿病临床观察[J]. 现代诊断与治疗, 2013, 24(15): 3419–3420. |
| [8] | Mattew D. Mouse models of diabetic nephropathy[J]. J Am Soc Nephrol, 2005, 16(1): 27–45. |
| [9] | 张翥, 黄松敏, 冯敏, 等. 糖尿病肾病早期白蛋白尿与Megalin的表达变化[J]. 中国中西医结合肾病杂志, 2006, 7(4): 197–200. |
| [10] | 徐凌志.AFG人参活力素的研究[D].长春:吉林农业大学, 2006. |
| [11] | Ki mK, Hy K. Korean red ginseing stimulates insulin release from isolated rat pancreatic islets[J]. J Ethnopharmacol, 2008, 120(2): 190–195. DOI:10.1016/j.jep.2008.08.006 |
| [12] | Zhang Z, Li X, Lv W, et al. Ginsenoside Re reduces insulin resistance through inhibition of c-Jun NH2 terminal kinase and nuclear factor[J]. Mol Endocrinol, 2008, 22(1): 186–195. DOI:10.1210/me.2007-0119 |
| [13] | Han KL, Jung MH. Ginsenoside 20S-protopanaxatriol (PPT) activates peroxisome proliferator-activated receptor gamma (PPARgamma) in 3T3-L1 adipocytes[J]. Biol Pharm Bull, 2006, 29(1): 110–113. DOI:10.1248/bpb.29.110 |
| [14] | Shang W, Yang Y, Jiang B, et al. Ginsenoside Rbl promotes adipogenesis in 3T3-L1 cells by enhancing PPARγ2 and C/EBPαgene expression[J]. Life Sci, 2007, 80(7): 618–625. DOI:10.1016/j.lfs.2006.10.021 |
| [15] | 徐锦堂, 王立群, 徐蓓. 黄连研究进展[J]. 中国医学科学院学报, 2004, 26(6): 704–707. |
| [16] | Li J, Shen X, Meng X. A traditional Chinese medicine JiuHuangLian (Rhizoma coptidis steamed with rice wine) reduces oxidative stress injury in type 2 diabetic rats[J]. Food Chem Toxicol, 2013, 59(8): 222–229. |
| [17] | 陈新, 黄静, 李盼盼, 等. 黄连生物碱对糖尿病小鼠降糖和氧化应激作用研究[J]. 亚太传统医药, 2012, 8(4): 24–25. |
| [18] | Lee YS, Kim WS. Berberine, a natural plant product, activates AMP-ac-tivated protein kinase with beneficial metabolic effects in diabetic and insulin-resistant states[J]. Diabetes, 2006, 55(8): 2256–2264. DOI:10.2337/db06-0006 |
| [19] | 唐姗, 胡嵘, 孙佳明, 等. 参连汤及其有效组分配伍对α-葡萄糖苷酶的影响[J]. 中国现代中药, 2012, 14(3): 22–24. |
| [20] | 姜淼, 王世东, 黄允瑜, 等. 黄连人参对药治疗2型糖尿病胰岛素抵抗机制的实验研究[J]. 新中医, 2006, 38(5): 89–91. |
| [21] | 闫寒, 马博清, 付彩雯. 糖尿病肾病发病机制研究进展[J]. 中国老年学杂志, 2015, 35(20): 5973–5975. |
 2016, Vol. 42
2016, Vol. 42


