扩展功能
文章信息
- 崔磊华, 及昕, 李明贺, 韩明林, 张宁, 孙兰芳, 韩成敏
- CUI Leihua, JI Xin, LI Minghe, HAN Minglin, ZHANG Ning, SUN Lanfang, HAN Chengmin
- miR-34a在牙龈鳞状细胞癌组织中的表达及其临床意义
- Expression of miRNA-34a in gingival squamous cell carcinoma tissue and its clinical significance
- 吉林大学学报(医学版), 2016, 42(06): 1099-1103
- Journal of Jilin University (Medicine Edition), 2016, 42(06): 1099-1103
- 10.13481/j.1671-587x.20160611
-
文章历史
- 收稿日期: 2016-06-13
牙龈鳞状细胞癌(gingival squamous cell carcinoma,GSCC)是发生于口腔牙龈组织的常见的恶性肿瘤,其构成比在口腔颌面部鳞癌患者中居第2位,其中抽烟、喝酒和咀嚼摈榔等不良生活习惯是导致GSCC发生的关键诱发因素[1]。但早期的GSCC,特别是局限在龈缘或龈乳头等部位时,易误诊为牙周病等慢性细菌感染性疾病,常造成患者的延迟就诊或误诊,影响预后。因此,寻找准确而有效的GSCC分子标志物,对临床医生早期及时诊断和治疗GSCC、防止远处转移及改善预后等具有重要意义。
小分子RNA是由17~25个核苷酸组成的非编码RNA,其通过结合到靶基因特异性序列的3′端非编码区,进而影响靶基因翻译和转录的稳定性,诱发癌基因的错乱表达,这是癌症表观遗传控制的一种重要形式之一[2-3]。位于染色体1p36.22区域的小分子RNA 34a (microRNA 34a, miR-34a)在人体正常组织中呈高表达,而在体内多种肿瘤组织如舌鳞状细胞癌[4]、喉鳞状细胞癌[5]、结直肠癌[6]和乳腺癌[7-8]组织中呈低表达甚至表达缺失。研究[9-10]显示:向肿瘤组织如头颈部鳞癌和舌鳞状细胞癌中转染miR-34a后,可抑制肿瘤细胞的生长、侵袭及迁移能力。因此miR-34a在抑制肿瘤组织发生发展的过程中起重要作用,然而miR-34a在GSCC组织中的表达水平及与患者临床病理参数的关系尚未见报道。本研究利用qRT-PCR法检测30例GSCC患者肿瘤组织和癌旁非瘤组织中miR-34a相对表达水平,进而分析miR-34a与GSCC患者临床病特征的关联。
1 材料与方法 1.1 组织标本选取2014年9月-2016年4月本院口腔颌面外科病房确诊为GSCC的患者30例,收集其肿瘤组织和相匹配的癌旁组织。其中,男性17例,女性13例;60岁以上11例,60岁以下19例;按发病部位分为上颌13例,下颌17例;按照国际抗癌联盟(Union for International Cancer Control, UICC)(第6版)中TNM分期分为:肿瘤体积≤4 cm (T1~T2期)24例,肿瘤体积>4 cm (T3~T4期)6例;按分化程度分为中、低度分化12例,高度分化18例;按是否发生淋巴结转移分为淋巴结转移5例,未发生淋巴结转移25例。分别取GSCC患者的肿瘤组织和癌旁非肿瘤组织(距癌灶>5cm)各100 mg,均在手术切除后立即收集组织标本。收集到的组织标本立即放入液氮中速冻,此后进一步将组织标本转移至-80℃冰箱保存。所有组织标本的病理学诊断由2名病理医师复核证实,且所有患者术前均未接受放、化疗。本研究经吉林大学口腔医院伦理委员会批准,严格遵照《赫尔辛基宣言》医学伦理道德准则实施,与所有患者或家属均进行充分沟通并签署知情同意书。
1.2 主要试剂和仪器TRIzol (Invitrogen公司,美国),氯仿、异丙醇和乙醇(北京生物工程有限公司,中国),逆转录和qRT-PCR试剂盒(TaKaRa公司,美国)。Nano-drop2000超微量分光光度计(Thermo公司,美国),实时荧光定量扩增仪MX3005P (Agilent公司, 美国),引物miR-34a和内参U6(上海生物工程有限公司,中国)。
1.3 HE染色观察GSCC组织病理形态表现将GSCC肿瘤组织和癌旁组织置于10%甲醛液中固定,梯度酒精脱水,透明,浸蜡,包埋,连续切片,厚4 μm,HE染色,光镜下观察GSCC组织病理,确定病理诊断(由本院病理科提供)。
1.4 肿瘤和癌旁组织中总RNA的提取和逆转录分别取-80℃冰箱保存的GSCC和癌旁组织块约0.5 cm×0.5 cm置于研钵中,加入液氮充分研磨至细粉状态,取适量细粉移入1.5 mL离心管中,加入1 mL TRIzol裂解液,室温下裂解5 min,加入200 μL氯仿剧烈震荡15 s,室温静置3 min,4℃、12 000 g离心15 min。取上清移至新的1.5mL离心管, 加入等体积异丙醇轻摇混匀,室温静置10 min,4℃、12 000 g离心10min,弃上清。向离心管中加入1 mL-20℃预冷的75%乙醇,轻柔混匀沉淀,4℃、7 500 g离心5 min,弃上清。在空气中干燥RNA沉淀至呈半透明状,避免彻底干燥,加入20 μL DEPC水溶解沉淀,获取总RNA。采用Nano-drop2000分光光度计测定RNA浓度。采用miR-34a和内参U6特异性逆转录引物,按照逆转录试剂盒说明书在冰上将RNA逆转录成cDNA,置于-80℃冰箱保存备用。
1.5 荧光实时定量PCR (qRT-PCR)法检测GSCC组织和癌旁组织中miR-34a的表达水平miR-34a的检测以U6为内参基因,引物序列miR-34a: Forward 5′-ACACTCCAGCTGGGTGGCAG-TGTCTTAGCT-3′, Reverse 5′-CAGTGCAGGG-TCCGAGGT-3′;内参U6:Forward 5′-CTCGC-TTCGGCAGCACA-3′, Reverse 5′-AACGCTTCACGAATTTGCGT -3′。加入组织cDNA 2 μL,按照说明书配制qRT-PCR总反应体系(25 μL),反应条件设为:95℃、30 s;95℃、5 s;60℃、30 s,共40个循环,在qRT-PCR仪上完成实验。检测30例GSCC组织及其对应的癌旁组织中miR-34a的相对表达水平,记录数值。每个样本设立3组平行对照,重复3次。miR-34a相对表达水平采用比较阈值分析法,即目的基因表达量=2-ΔΔCt,ΔΔCt=(肿瘤组织目的基因Ct值-肿瘤组织内参基因Ct值)-(癌旁组织目的基因Ct值-癌旁组织内参基因Ct值)。其中Ct表示qRT-PCR反应荧光强度明显大于背景值时的循环数。
1.6 统计学分析采用SPSS17.0统计软件进行统计学分析。GSCC组织和癌旁组织中miR-34a的表达水平以x±s表示,组间比较采用t检验;不同临床病理参数患者肿瘤组织中miR-34a表达水平比较采用t检验。以α=0.05为检验水准。
2 结果 2.1 GSCC组织病理形态表现高分化GSCC组织中可见明显牙龈上皮异常增生,部分区域呈浸润性生长;中分化GSCC组织中可见牙龈上皮异常增生的鳞状细胞形成癌巢和角化珠形成;低分化GSCC组织中可见牙龈上皮肿瘤细胞呈团片状及梭形,异型性明显,并有大量分裂相。见图 1(插页三)。
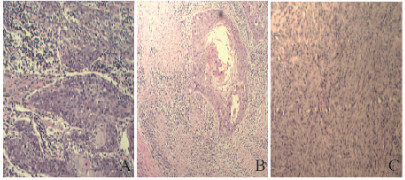
|
| 图 1 各组小鼠肾脏组织病理学表现(HE, ×400) Figure 1 Pathology of kidney tissue of mice in various groups (HE, ×400) |
|
|
与癌旁组织(1.00±0.00)比较,GSCC组织中miR-34a的表达水平(0.47±0.26)明显降低(t=3.03,P=0.004)。
2.3 不同临床病理特征GSCC患者GSCC组织中miR-34a的表达水平GSCC组织中miR-34a的表达水平与肿瘤大小及恶性程度有关联,即肿瘤体积越大或恶性分化程度越高,miR-34a的表达水平就越低,组间比较差异有统计学意义(P < 0.05),但与患者的年龄、性别、肿瘤所在部位及有无淋巴转移无关联,组间比较差异无统计学意义(P>0.05)。见表 1。
| Clinicopathological characteristic |
Expression level of miR-34a |
P |
| Gender | ||
| Male | 0.453 8±0.249 4 | 0.748 6 |
| Female | 0.485 2±0.280 8 | |
| Age (year) | ||
| <60 | 0.450 4±0.275 4 | 0.645 4 |
| ≥60 | 0.496 8±0.2399 9 | |
| Place | ||
| Maxillary | 0.439 8±0.223 2 | 0.619 3 |
| Mandibular | 0.488 5±0.289 4 | |
| Differentiation | ||
| High | 0.562 9±0.254 4 | 0.011 5 |
| Medium/Low | 0.324 1±0.206 9 | |
| Tumor size (cm) | ||
| ≤4 | 0.533 3±0.237 4 | 0.003 9 |
| >4 | 0.203 8±0.189 4 | |
| Lymph node metastasis | ||
| Positive | 0.3340±0.262 2 | 0.201 7 |
| Negative | 0.5010±0.260 5 | |
GSCC是口腔中最常见的实体恶性肿瘤,多表现为中、高分化的鳞状细胞癌,早期出现肿瘤细胞浸润牙槽突和颌骨,进而导致牙齿松动甚至脱落并伴随着剧烈疼痛[11]。肿瘤细胞进一步向后扩散到磨牙区和咽部,引起张口困难。GSCC可发生远处转移,发生在下颌的GSCC常转移到患侧颌下及颏下淋巴结,最后向颈深淋巴结转移;而发生在上颌的GSCC常转移至患侧颌下及颈深淋巴结,早期及时治疗,患者预后较好,晚期极易远处转移及复发,预后较差。GSCC对放、化疗中度敏感,且放射治疗易造成放射性骨坏死,给患者带来极大痛苦。目前GSCC的临床治疗仍以手术切除为主,且随着手术技术的不断进步和高清影像技术的普遍实施,GSCC的治疗效果已得到明显改善,但也不可避免地造成患者颌面部的缺损畸形,给患者的生理和心理造成严重负担。由于机体内引起GSCC的具体分子机制尚未完全阐明,临床上多依赖肿瘤分化程度、TNM分期等病理指标进行GSCC的临床诊断、分型、预后判断及实施后续治疗。然而这些病理指标常因患者的延迟就诊或误诊,未能及时确诊早期GSCC,进而耽误最佳治疗时机。近年发现了一些新的肿瘤标记物[12],如甲胎蛋白(alpha fetoprotein, AFP)、α-L-岩藻糖苷酶(ɑ-L-fucosidase, AFU)和组织多肽抗原(tissue polypeptide antigen, TPA)等为肿瘤的早期诊断提供了更多的参考依据,但其存在有创检查或某些标记物的敏感性及特异性低等因素又造成肿瘤的临床诊断结果准确率不高,因此在分子水平上寻找满足临床需求的敏感、特异、简便及易测的GSCC标志物,对指导临床诊断、治疗及预测GSCC患者预后等具有至关重要的作用。
研究[13]证实:位于染色体1p36.22区域的miR-34a基因广泛存在于人体角化细胞中,且在肿瘤组织中该基因表现为缺失状态,与正常机体比较,患者肿瘤血清中miR-34a呈低表达甚至缺失,是新近发现的具有重要抑癌作用的小分子RNA。研究[14]表明:敲除抑癌基因p53后,可直接下调正常组织中miR-34a的表达水平,促进GSCC分化。然而向肿瘤组织内转染miR-34a后可激活抑癌基因p53,抑制鳞状细胞癌细胞分化[15-16]。研究[17-20]显示:miR-34a与抑癌基因p53通过协同作用直接降解或间接抑制癌基因如Notch homolog 1(Notch1)和Sirtuin-6(SIRT6)的转录和翻译,进而抑制Notch1信号通路的激活,形成一条负反馈调节通路,抑制肿瘤细胞内生长因子和基质金属蛋白酶2、9和14等的表达,导致肿瘤细胞周期停滞,激活肿瘤细胞内凋亡通路,分解破坏肿瘤细胞。以上研究结果提示:抑癌基因miR-34a可发挥保护机体正常组织和防止细胞恶性转化的作用,还可作为一种有效的早期肿瘤标志物、肿瘤预后和新的肿瘤治疗靶点,在临床诊断和治疗中发挥重要作用。本研究将目的基因miR-34a和U6均在反应体系中有效扩增后,依据组间2-ΔΔCt值的差异,分别计算30例GSCC患者癌组织样本中miR-34a的相对表达水平,以评估miR-34a在GSCC中表达水平的改变。本研究结果显示:与癌旁组织比较,GSCC组织中miR-34a的表达水平明显降低,且其表达水平与肿瘤体积和恶性程度有关联,表明miR-34a在GSCC患者肿瘤组织中呈低表达,可进一步作为临床诊断GSCC的重要指标,并对患者术后肿瘤复发、死亡等预后作出更准确预测,为进一步个体化、精准的癌症治疗提供依据。miR-34a表达水平与GSCC患者年龄、性别和肿瘤部位等无关联。本研究结果显示:无淋巴结转移患者的肿瘤组织中miRNA-34a表达水平为0.501 0±0.260 5,有淋巴结转移者为0.334 0±0.262 2,miRNA-34a与淋巴结远处转移无关联,但是否存在淋巴结转移作为影响GSCC患者预后的一个重要因素,与本研究结果不符,可能与本研究样本例数不足和组间差异较大有关联,需要进一步扩大样本验证该结论。
众所周知,GSCC治疗的关键是早发现、早诊断和早治疗。然而目前GSCC患者的临床诊断分期较晚、治疗过程痛苦及治疗后癌症易复发或转移等因素造成了患者巨大的精神及物质压力,不能达到满意的治疗效果。因此对血清中与肿瘤形成密切相关的miR-34a表达水平进行检测不仅可以为GSCC的早期诊断提供有利条件,还可作为GSCC的潜在治疗靶点,具有广阔的临床应用前景。
| [1] | Sun Q, Fang Q, Guo S. A comparison of oral squamous cell carcinoma between young and old patients in a single medical center in China[J]. Int J Clin Exp Med, 2015, 8(8): 12418–12423. |
| [2] | Chen D, Cabay RJ, Jin Y, et al. MicroRNA deregulations in head and neck squamous cell carcinomas[J]. J Oral Maxillofac Res, 2013, 4(1): e2. |
| [3] | Sethi N, Wright A, Wood H, et al. MicroRNAs and head and neck cancer:reviewing the first decade of research[J]. Eur J Cancer, 2014, 50(15): 2619–2635. DOI:10.1016/j.ejca.2014.07.012 |
| [4] | Li XJ, Ren ZJ, Tang JH, et al. MicroRNA-34a:a potential therapeutic target in human cancer[J]. Cell Death Dis, 2014, 5(7): e1327. DOI:10.1038/cddis.2014.270 |
| [5] | Shen Z, Zhou C, Li J, et al. Promoter hypermethylation of miR-34a contributes to the risk, progression, metastasis and poor survival of laryngeal squamous cell carcinoma[J]. Gene, 2016, 41480(16): 1–5. |
| [6] | Tazawa H, Tsuchiya N, Izumiya M, et al. Tumor-suppressive miR-34a induces senescence-like growth arrest through modulation of the E2F pathway in human colon cancer cells[J]. Proc Natl Acad Sci USA, 2007, 104(39): 15472–15477. DOI:10.1073/pnas.0707351104 |
| [7] | Ma W, Xiao GG, Mao J, et al. Dysregulation of the miR-34a-SIRT1 axis inhibits breast cancer stemness[J]. Oncotarget, 2015, 6(12): 10432–10444. DOI:10.18632/oncotarget |
| [8] | Si W, Li Y, Shao H, et al. MiR-34a inhibits breast cancer proliferation and progression by targeting Wnt1 in Wnt/β-Catenin signaling pathway[J]. Am J Med Sci, 2016, 352(2): 191–199. DOI:10.1016/j.amjms.2016.05.002 |
| [9] | Agrawal N, Frederick MJ, Pickering CR, et al. Exome sequencing of head and neck squamous cell carcinoma reveals inactivating mutations in NOTCH1[J]. Science, 2011, 333(6046): 1154–1157. DOI:10.1126/science.1206923 |
| [10] | Siemens H, Jackstadt R, Kaller M, et al. Repression of c-Kit by p53 is mediated by miR-34 and is associated with reduced chemoresistance, migration and Stemness[J]. Oncotarget, 2013, 4(9): 1399–1415. DOI:10.18632/oncotarget |
| [11] | Seoane J, Varela-Centelles PI, Walsh TF, et al. Gingival squamous cell carcinoma:diagnostic delay or rapid invasion?[J]. J Periodontol, 2006, 77(7): 1229–1233. DOI:10.1902/jop.2006.050408 |
| [12] | Ding HG. Elevated serum alpha fetoprotein levels promote pathological progression of hepatocellular carcinoma[J]. World J Gastroenterol, 2011, 17(41): 4563–4571. DOI:10.3748/wjg.v17.i41.4563 |
| [13] | Hermeking H. The miR-34 family in cancer and apoptosis[J]. Cell Death Differ, 2010, 17(2): 193–199. DOI:10.1038/cdd.2009.56 |
| [14] | Jain AK, Allton K, Iacovino M, et al. p53 regulates cell cycle and microRNAs to promote differentiation of human embryonic stem cells[J]. PLoS Biol, 2012, 10: e1001268. DOI:10.1371/journal.pbio.1001268 |
| [15] | Bader AG. miR-34a microRNA replacement therapy is headed to the clinic[J]. Front Genet, 2012, 3: 120. |
| [16] | Cutilli T, Leocata P, Dolo V, et al. p53 as a prognostic marker associated with the risk of mortality for oral squamous cell carcinoma[J]. Oncol Lett, 2016, 12(2): 1046–1050. |
| [17] | Lefort K, Brooks Y, Ostano PA, et al. miR-34a-SIRT6 axis in the squamous cell differentiation network[J]. EMBO J, 2013, 32(16): 2248–2263. DOI:10.1038/emboj.2013.156 |
| [18] | Jia LF, Wei SB, Mitchelson K, et al. MiR-34a inhibits migration and invasion of tongue squamous cell carcinoma via targeting MMP9 and MMP14[J]. PLoS One, 2014, 9(9): 1–13. |
| [19] | 魏克敏, 张轶博, 李新. 牙龈卟啉单胞菌感染诱发雌鼠生殖异常的实验研究[J]. 解放军医学杂志, 2016, 41(8): 653–659. |
| [20] | 陈光朋, 付万垒, 杨坤富, 等. miR-182调控RECK信号通路在非小细胞肺癌进展中的作用[J]. 解放军医学杂志, 2015, 40(4): 309–314. |
 2016, Vol. 42
2016, Vol. 42


