扩展功能
文章信息
- 郗艳丽, 许娜, 李澍, 王迪, 王舒然, 牛凤兰
- XI Yanli, XU Na, LI Shu, WANG Di, WANG Shuran, NIU Fenglan
- 没食子酸对人非小细胞肺癌A549细胞增殖的抑制作用
- Inhibitory effect of gallic acid on proliferation of human non-small cell lung cancer A549 cells
- 吉林大学学报(医学版), 2016, 42(06): 1092-1098
- Journal of Jilin University (Medicine Edition), 2016, 42(06): 1092-1098
- 10.13481/j.1671-587x.20160610
-
文章历史
- 收稿日期: 2016-05-04
2. 吉林大学公共卫生学院环境卫生学教研室, 吉林 长春 130021
2. Department of Environmental Health, School of Public Health, Jilin University, Changchun 130021, China
肺癌是严重威胁人类健康的恶性肿瘤,其死亡率较高,化疗药物是治疗肺癌的主要药物。铂类药物是治疗肺癌的首选化疗药物,但该类药物的不良反应大,许多患者会产生耐药[1],寻找新的化疗药物一直是科研工作者共同努力的方向。没食子酸是一类多酚类化合物,广泛存在于红酒、绿茶和灵芝等多种食物中,且常以单体或鞣酸的形式存在[2]。没食子酸单体可降低蛋白质的美拉德反应,延长食品的贮藏时间[3]。除此之外,没食子酸还具有抗炎[4]、抗过敏[5]及抗病毒[6]等功效,其中最引人注目的是没食子酸可以抑制肿瘤细胞的增殖。研究[7-12]显示:没食子酸对多种实体瘤和非实体瘤的发生发展均有抑制作用,但具体机制有待进一步研究。没食子酸对肺癌细胞的增殖有抑制作用[13],其作用机制与促氧化作用有关联,但没食子酸对肺癌细胞A549中抗氧化酶的影响尚未见报道。本研究在体外研究没食子酸对肺癌细胞A549的毒性效应,并探讨其抑制肺癌细胞增殖的作用机制,为没食子酸抑制肺癌细胞增殖的研究奠定理论基础。
1 材料与方法 1.1 细胞、主要试剂和仪器人非小细胞肺癌A549细胞株购于中国医学科学院肿瘤细胞库。没食子酸购于美国Sigma公司,胎牛血清、胰蛋白酶、青霉素和链霉素购于美国Gibco公司,RPMI-1640培养液购于美国Hyclone公司,台盼蓝、噻唑蓝(MTT)、二甲基亚砜和瑞氏-姬姆萨复合染液购于北京索莱宝公司,Annexin Ⅴ-FITC染色液、活性氧(reactive oxygen species,ROS)检测试剂盒和BCA蛋白浓度检测试剂盒购于上海碧云天生物技术有限公司,过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)购于南京建成生物制品研究所,β-actin、Fas和FasL蛋白以及HRP标记山羊抗兔IgG购于北京博奥森生物技术有限公司。HERAcell 150Ⅰ型二氧化碳培养箱购自美国Thermo公司,Epoch take3型酶标仪购自美国BioTek公司,TI-EPFS型全电动完美对焦显微成像系统购自日本尼康公司,Mini-PROTEAN Tetra垂直电泳槽和Mini Trans-Blot槽式转印系统购自美国伯乐公司,C6流式细胞仪购自美国BD公司。
1.2 细胞培养和分组人非小细胞肺癌A549细胞复苏后接种于培养皿中,置于37℃、5%CO2培养箱中培养,取对数生长期细胞进行后续实验和检测。根据预实验结果选取对A549细胞抑制效果较好的3个没食子酸浓度(0、300、500和750 μmol·L-1)作为低、中和高剂量组给药剂量,0μmol·L-1没食子酸作为对照组剂量。
1.3 MTT法检测A549细胞存活率用胰蛋白酶消化处于对数生长期的A549细胞并离心收集,调节细胞密度至1×105mL-1接种于96孔板,每孔接种200 μL。待细胞贴壁后,按照上述分组加入没食子酸处理6、12和24 h,每个样品设6个复孔。处理结束后吸弃旧培养液,每孔加入200 μL不含血清的培养液,同时加入20 μL MTT,37℃孵育4 h后移除培养液,每孔加入150 μL DMSO,震荡10 min后,在波长为490 nm条件下检测吸光度(A)值,计算不同处理时间各组细胞存活率。
1.4 瑞氏-姬姆萨染色观察A549细胞形态表现A549细胞以2.5×105 mL-1密度接种于6孔板,每孔接种2 mL。待细胞贴壁后按照上述方法处理细胞,培养结束后移除培养液并用预冷的PBS缓冲液(1L溶液中含7.9 g NaCl、0.2 g KCl、0.24 g KH2PO4和1.8 g K2HPO4)洗涤3次,加入甲醇固定液固定细胞20 min,PBS缓冲液洗涤3次,再加入瑞氏-姬姆萨复合染液染色,PBS缓冲液洗涤3次,加入封片剂(甘油:水=9:1)防止干燥,在光镜下观察细胞形态表现,每组实验重复3次。
1.5 流式细胞术检测各组A549细胞凋亡率A549细胞以5 × 105 mL-1密度接种于6孔板,每孔接种2 mL单细胞悬浮液,置于37℃、5%CO2培养箱继续培养24 h,吸弃旧培养液,加入用不含血清培养基稀释的药物继续干预处理24 h,同时设立加入等体积的不含血清的培养液作为空白对照组,继续培养24 h。用预冷的PBS缓冲液洗涤3次,胰蛋白酶消化后收集细胞,1 000 r·min-1离心3 min,吸弃上清,加入预冷的PBS缓冲液洗涤2次,加入100 μLBinding buffer混匀,加入10 μLAnnexin Ⅴ-FITC染色液和10 μL PI染色液,混匀后孵育10 min,低速离心去上清,加入400 μLBinding buffer混匀,采用流式细胞术检测各组A549细胞的凋亡率。
1.6 Western blotting法检测A549细胞中FasL和Fas蛋白表达水平各组A549细胞用没食子酸处理后,加入预冷的PBS缓冲液洗涤3次,每孔加入120 μLRIPA细胞裂解液,置于4℃冰箱中裂解30 min,待细胞充分裂解后,4℃、1 000 r·min-1离心10 min,取上清进行蛋白定量,剩余上清以4:1比例与5×蛋白上样缓冲液充分混匀,沸水煮沸10 min以变性蛋白。变性后的蛋白提取液行SDS-PAGE电泳,电泳条件:浓缩胶浓度为5%,电压为100 V,分离胶浓度为12%,电压为120 V。湿转法将胶内蛋白转移到PVDF膜。转膜条件:300 mA、2 h。5%脱脂奶粉室温封闭1 h,TBST洗膜3次,每次5 min。加入β-actin (1:600)、Fas或FasL一抗(1:400)稀释液,4℃冰箱孵育过夜,加入二抗稀释液(1:800稀释),37℃孵育1 h。取出膜后洗涤3次,加入超敏ECL发光液并置于暗盒中压片,再将X光片置于定影液和显影液中显色。自来水清洗后晾干,扫描仪扫描成像,Image J软件对蛋白进行灰度分析。以β-actin作为对照,计算各组A549细胞中FasL和Fas蛋白的表达水平。蛋白表达水平=待测蛋白灰度值/β-actin蛋白灰度值[14]。
1.7 流式细胞术检测A549细胞中ROS水平按照1.5中方法接种A549细胞,加入没食子酸处理后收集6孔板中的细胞,用预冷的PBS缓冲液洗涤3次,胰蛋白酶消化后收集细胞,1 000 r·min-1离心3 min,吸弃上清,按试剂盒说明书加入10 mmol·L-1 DCFH-DA工作液1 mL (激发波长488 nm,发射波长525 nm),37℃避光孵育30 min,预冷PBS缓冲液洗涤细胞3次,洗去未结合的染色液,加入200 μL预冷的PBS缓冲液并充分混匀细胞,采用流式细胞术检测A549细胞中ROS水平。
1.8 分光光度法检测各组A549细胞中CAT、SOD和GSH-Px活性按照1.5中方法接种A549细胞,加入没食子酸处理后收集6孔板中的细胞,PBS缓冲液洗涤3次,加入蒸馏水低渗处理A549细胞30 min,充分裂解细胞后台盼蓝溶液检测细胞裂解程度,再低温离心收集上清。按照试剂盒说明书严格检测细胞中CAT、SOD和GSH-Px活性。
1.9 统计学分析采用SPSS 16.0统计软件进行统计学分析。各组A549细胞存活率、凋亡率、FasL和Fas蛋白表达水平、ROS水平、CAT和SOD及GSH-Px活性均以x±s表示,多组间样本均数比较采用单因素方差分析(LSD法),组间两两比较采用SNK-q法检验。以α=0.05为检验水准。
2 结果 2.1 各组A549细胞存活率对照组A549细胞存活率设为100%,没食子酸作用6 h后,低、中和高剂量没食子酸组A549细胞存活率分别为(97.68±2.29)%、(83.41±3.73)%和(70.96±2.06)%;没食子酸作用12 h后,低、中和高剂量没食子酸组A549细胞存活率分别为(95.67±3.45)%、(80.90±1.95)%和(62.47±5.59)%;没食子酸作用24 h后,低、中和高剂量没食子酸组A549细胞存活率分别为(92.75±2.01)%、(78.21±11.26)%和(55.37±4.19)%。与对照组比较,作用6 h,低剂量没食子酸组A549细胞存活率无明显变化(P>0.05),中和高剂量没食子酸组A549细胞存活率明显降低(P < 0.05);作用12和24 h后,各剂量没食子酸组A549细胞存活率明显低于对照组(P < 0.05),细胞存活率的降低与作用时间和没食子酸剂量均呈依赖性关系。与6和12 h比较,作用24 h后,各剂量没食子酸组A549细胞存活率明显降低(P < 0.05)。
2.2 各组A549细胞形态表现光镜下可见:对照组细胞形态规则,细胞大小基本一致,形态呈多边形,细胞与细胞之间连接紧密,细胞核与细胞质界限清晰,染色均匀,核仁呈深染且明显;与对照组比较,低剂量没食子酸组A549细胞数量减少,中和高剂量没食子酸组A549细胞数量减少的更加明显,且细胞与细胞之间的间隙增大,细胞排列稀疏且紊乱,多数细胞的细胞核与细胞质界限不清,细胞质皱缩,细胞体积变小、变圆,细胞呈明显凋亡特征。随着没食子酸剂量的增加,凋亡形态的细胞数量逐渐增多。见图 1(插页三)。
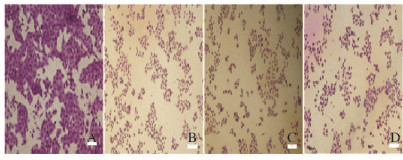
|
| A:Control group; B-D:Low, middle, and high dosages of gallic acid groups. 图 1 各组A549细胞的形态表现(bar=100 μm) Figure 1 Morphology of A549 cells in various groups (bar=100 μm) |
|
|
低、中和高剂量没食子酸组A549细胞凋亡率分别为(21.5±0.18)%、(27.5±0.30)%和(34.9±0.28)%,明显高于对照组(3.2%±0.21%)(P < 0.05)。高剂量没食子酸组A549细胞凋亡率明显高于低剂量没食子酸组(P < 0.05);中剂量没食子酸组A549细胞凋亡率虽高于低剂量组,但组间比较差异无统计学意义(P>0.05)。中和高剂量没食子酸组A549细胞凋亡率组间比较差异无统计学意义(P>0.05)。随着没食子酸剂量的增加,A549细胞凋亡率逐渐增加,呈剂量依赖关系。见图 2。
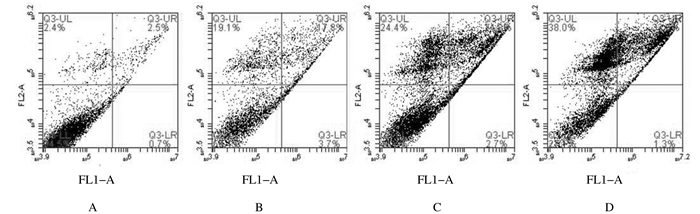
|
| A:Control group; B-D:Low, middle, and high dosages of gallic acid groups. 图 2 流式细胞术检测各组A549细胞凋亡率 Figure 2 Apoptotic rates of A549 cells in various groups detected by FCM |
|
|
Western blotting法检测,没食子酸作用于A549细胞后,低、中和高剂量没食子酸组FasL和Fas蛋白表达水平随着药物剂量的增加而呈明显升高的趋势,见图 3A。低和中剂量没食子酸组A549细胞中FasL和Fas蛋白表达水平虽高于对照组,但组间比较差异无统计学意义(P>0.05),高剂量没食子酸组A549细胞中FasL和Fas蛋白表达水平明显高于对照组(P < 0.05)。各剂量没食子酸组A549细胞中FasL和Fas蛋白的表达呈正相关关系(r=0.92,P < 0.05),FasL和Fas蛋白表达与没食子酸之间也呈剂量依赖关系,但低、中和高剂量没食子酸组A549细胞中FasL和Fas蛋白表达水平比较差异无统计学意义(P>0.05),见图 3B。
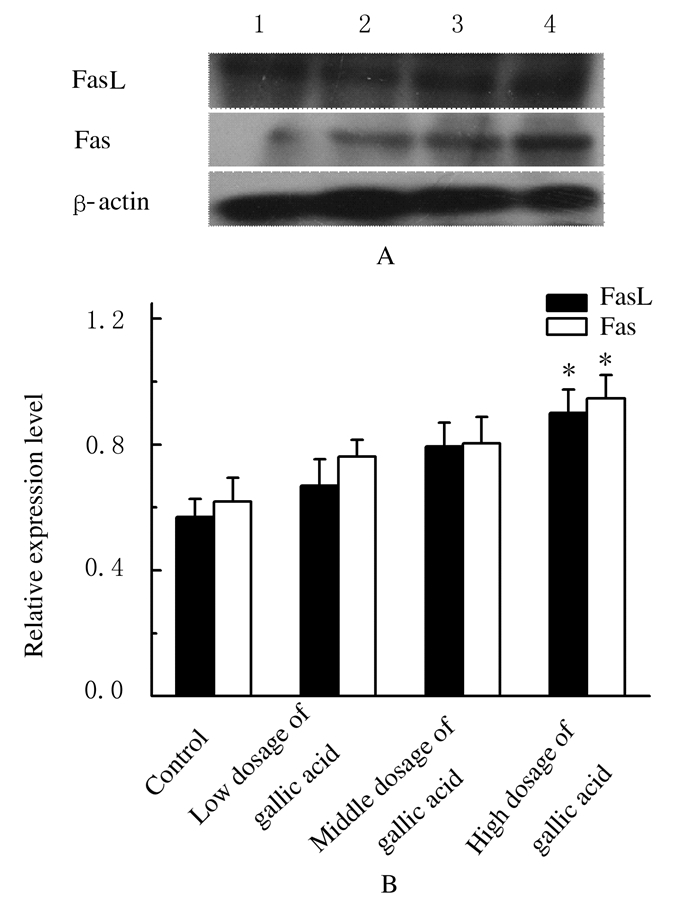
|
| *P < 0.05 compared with control group. Lane 1: Control group; Lane 2-4: Low, middle, and high dosages of gallic acid groups. 图 3 各组A549细胞中Fas和FasL蛋白表达电泳图(A)和相对表达水平(B) Figure 3 Electrophoregram (A) and relative expressionlevels (B) of FasL and Fas proteins in A549 cells in various groups |
|
|
低、中和高剂量没食子酸组A549细胞中ROS水平明显高于对照组(P < 0.05);中剂量没食子酸组A549细胞中ROS水平虽高于低剂量没食子酸组,但组间比较差异无统计学意义(P>0.05),高剂量没食子酸组A549细胞中ROS水平高于低剂量没食子酸组,且组间比较差异有统计学意义(P < 0.05);高剂量没食子酸组A549细胞中ROS水平高于中剂量没食子酸组,但组间比较差异无统计学意义(P>0.05)。见图 4。

|
| *P < 0.05 compared with control group; △P < 0.05 compared with low dosage of gallic acid group. 图 4 各组A549细胞中ROS水平直条图 Figure 4 Histogram of ROS levels in A549 cells in various groups |
|
|
低、中和高剂量没食子酸组A549细胞中CAT活性虽高于对照组,但组间比较差异无统计学意义(P>0.05),且CAT活性随没食子酸剂量增加而逐渐降低。低剂量没食子酸组A549细胞中SOD活性明显高于对照组(P < 0.05);中和高剂量没食子酸组SOD活性虽高于对照组,但组间比较差异无统计学意义(P>0.05);且SOD活性随没食子酸剂量增加而逐渐降低。低剂量没食子酸组A549细胞中GSH-Px活性高于对照组,但组间比较差异无统计学意义(P>0.05);中和高剂量没食子酸组GSH-Px活性虽低于对照组,但组间比较差异也无统计学意义(P>0.05);随着没食子酸剂量的不断增加,GSH-Px活性反而降低。低、中和高剂量没食子酸组间A549细胞中CAT、SOD和GSH-Px活性比较差异无统计学意义(P>0.05)。见表 1。
| [n=3, x±s,λB/ (U·mg-1)] | ||||
| Group | Dose (μmol·L-1) | CAT | SOD | GSH-Px |
| Control | 0 | 230.91±70.27 | 24.08±5.10 | 11.24±1.57 |
| Gallic acid | ||||
| Low dosage | 300 | 342.27±125.21 | 39.68±8.86* | 12.04±2.71 |
| Middle dosage | 500 | 287.34±70.61 | 30.88±10.69 | 9.89±3.72 |
| High dosage | 750 | 284.89±106.17 | 25.90±3.80 | 9.27±6.79 |
| *P < 0.05 vs control group. | ||||
细胞凋亡是个体发育过程中严格受到调控的细胞正常死亡形式,其最终结果是细胞死亡,但细胞凋亡并非全都是自发的程序性死亡。当细胞受到外界环境影响后,也会启动细胞凋亡,这是许多抗肿瘤药物抑制肿瘤细胞增殖的主要作用机制。本研究结果显示:随着处理时间的延长,A549细胞存活率也逐渐降低,没食子酸作用时间与细胞存活率之间存在时间依赖关系。各剂量组没食子酸作用24 h时细胞存活率明显低于6和12 h,该时点没食子酸的抑制效果最好。随着没食子酸剂量的增加,A549细胞存活率逐渐降低,且A549细胞呈现出细胞凋亡的形态学表现,具有凋亡特性细胞的比例明显升高,上述结果表明没食子酸对A549细胞增殖的抑制作用是通过诱导细胞凋亡的方式实现的。
Fas系统是目前研究的比较清楚的介导细胞凋亡的信号传导系统,王强等[15]通过观察Fas和FasL在肺癌组织以及正常支气管黏膜上皮细胞中的表达发现:Fas和FasL在肺癌组织中的表达明显低于正常支气管黏膜上皮细胞,肺癌细胞能通过降低Fas和FasL的表达逃避机体的免疫监视,促进肺癌的发生和进展。本研究结果显示:随没食子酸的剂量的增加,Fas和FasL蛋白表达水平亦升高,Fas蛋白与细胞膜表面的Fas Ligand (FasL)配体相互识别后,肿瘤细胞被机体的免疫系统快速识别,进而触发肿瘤细胞的凋亡程序,启动细胞凋亡过程。没食子酸诱导细胞凋亡的能力随着其剂量增加而逐渐增强,细胞凋亡率与没食子剂量呈正相关关系。
没食子酸作用A549细胞后,细胞中ROS水平明显升高,ROS水平与没食子酸的剂量呈依赖关系。小剂量ROS是细胞分裂增殖所必需的,但大量ROS会造成细胞发生氧化损伤,进而激活细胞凋亡途径,使肿瘤细胞发生凋亡。因ROS大量生成所致的氧化损伤可能是没食子酸诱导A549细胞大量凋亡的重要作用机制之一。为了进一步验证ROS在没食子酸诱导A549细胞凋亡过程中的作用,本研究还检测了没食子酸作用后A549细胞中CAT、SOD和GSH-Px水平,该3种抗氧化酶主要参与清除活性氧自由基,降低ROS大量生成引起的氧化损伤以及脂质过氧化作用。肺癌细胞为了降低没食子酸所致的氧化损伤对自身产生的威胁,分泌了更多CAT、SOD和GSH-Px,此时肺癌细胞的抗氧化能力增强,没食子酸对细胞的毒性作用不强。当没食子酸剂量增加时,其所致的氧化损伤进一步加剧,细胞中的抗氧化酶系统不能拮抗这种严重的氧化损伤,酶活性被大量生成的活性氧抑制,因此酶活性降低,细胞存活率也明显降低。
综上所述,没食子酸对非小细胞肺癌A549细胞增殖有抑制作用,该抑制作用是通过诱导细胞凋亡的方式实现的,很好地扩展了没食子酸的抗肿瘤作用范围,且通过对ROS水平及抗氧化酶活性的检测,推测没食子酸是通过诱导细胞进一步发生氧化损伤作用并通过Fas/FasL信号通路来诱导细胞凋亡,其毒性作用可能与细胞中ROS的产生有关联。本研究结果为研究没食子酸抑制肺癌的作用机制提供了理论依据。
| [1] | 李贞, 高丽萍. 氧化应激在顺铂肾毒性中的作用[J]. 广东医学, 2010, 31(19): 2600–2602. |
| [2] | Niemetz R, Gross GG. Enzymology of gallotannin and ellagitannin biosynthesis[J]. Phytochemistry, 2005, 66(17): 2001–2011. DOI:10.1016/j.phytochem.2005.01.009 |
| [3] | 谷满屯, 盛占武, 商文婷, 等. 没食子酸对高蛋白中间水分食品品质的影响[J]. 食品工业科技, 2016, 37(3): 79–87. |
| [4] | Pal C, Bindu S, Dey S, et al. Gallic acid prevents nonsteroidal anti-inflammatory drug-induced gastropathy in rat by blocking oxidative stress and apoptosis[J]. Free Radic Biol Med, 2010, 49(2): 258–267. DOI:10.1016/j.freeradbiomed.2010.04.013 |
| [5] | Kim SH. Gallic acid inhibits histamine release and pro-inflammatory cytokine production in mast cells[J]. Toxicol Sci, 2006, 91(1): 123–131. DOI:10.1093/toxsci/kfj063 |
| [6] | Choi HJ, Song JH, Bhatt LR, et al. Anti-human rhinovirus activity of gallic acid possessing antioxidant capacity[J]. Phytother Res, 2010, 24(9): 1292–1296. DOI:10.1002/ptr.v24:9 |
| [7] | Kaur M, Velmurugan B, Rajamanickam S, et al. Gallic acid, an active constituent of grape seed extract, exhibits anti-proliferative, pro-apoptotic and anti-tumorigenic effects against prostate carcinoma xenograft growth in nude mice[J]. Pharm Res, 2009, 26(9): 2133–2140. DOI:10.1007/s11095-009-9926-y |
| [8] | Inoue M, Sakaguchi N, Isuzugawa K, et al. Role of reactive oxygen species in gallic acid-induced apoptosis[J]. Biol Pharm Bull, 2000, 23(10): 1153–1157. DOI:10.1248/bpb.23.1153 |
| [9] | Yoshioka K, Kataoka T, HayashiT, et al. Induction of apoptosis by gallic acid in human stomach cancer KATO Ⅲ and colon adenocarcinoma COLO 205 cell lines[J]. Oncol Rep, 2000, 7(6): 1221–1223. |
| [10] | Hsu JD, Kao SH, Ou TT, et al. Gallic acid induces G2/M phase arrest of breast cancer cell MCF-7 through stabilization of p27Kip1attributed to disruption of p27Kip1/Skp2 complex[J]. J Agric Food Chem, 2011, 59(5): 1996–2003. DOI:10.1021/jf103656v |
| [11] | You BR, Moon HJ, Han YH, et al. Gallic acid inhibits the growth of HeLa cervical cancer cells via apoptosis and/or necrosis[J]. Food Chem Toxicol, 2010, 48(5): 1334–1340. DOI:10.1016/j.fct.2010.02.034 |
| [12] | Faried A, Kurnia D, Faried L S, et al. Anticancer effects of gallic acid isolated from Indonesian herbal medicine, Phaleria macrocarpa (Scheff.) Boerl, on human cancer cell lines[J]. Int J Oncol, 2007, 30(3): 605–613. |
| [13] | You BR, Park WH. Gallic acid-induced lung cancer cell death is related to glutathione depletion as well as reactive oxygen species increase[J]. Toxicol In Vitro, 2010, 24(5): 1356–1362. DOI:10.1016/j.tiv.2010.04.009 |
| [14] | 于洋, 刘亚萌, 吴少花, 等. 杨梅素对人卵巢癌SKOV3细胞的凋亡诱导作用[J]. 吉林大学学报:医学版, 2015, 41(5): 902–906. |
| [15] | 王强, 杨志雄, 廖思海. Fas、FasL和caspase-3在肺癌中的表达及其临床意义[J]. 现代肿瘤医学, 2009, 17(2): 248–251. |
 2016, Vol. 42
2016, Vol. 42


