扩展功能
文章信息
- 宋扬, 赵丽艳, 陈勇, 吕晓艳, 崔佳乐, 李蕴潜, 赵刚
- SONG Yang, ZHAO Liyan, CHEN Yong, LYU Xiaoyan, CUI Jiayue, LI Yunqian, ZHAO Gang
- TGF-β1对胶质瘤U87细胞上皮-间质转化的诱导作用
- Induction of TGF-β1 on epithelial to mesenchymal transition in glioma U87 cells
- 吉林大学学报(医学版), 2016, 42(06): 1087-1091
- Journal of Jilin University (Medicine Edition), 2016, 42(06): 1087-1091
- 10.13481/j.1671-587x.20160609
-
文章历史
- 收稿日期: 2016-07-08
2. 吉林大学第二医院检验科, 吉林 长春 130041;
3. 吉林大学基础医学院组织学与胚胎学系, 吉林 长春 130021
2. Department ofClinical of Medical Laboratory, Second Hospital, Jilin University, Changchun 130041, China;
3. Department of Histology and Embryology, School of Basic Medical Sciences, Jilin University, Changchun 130021, China
胶质瘤是中枢神经系统最常见的原发性恶性肿瘤,由于其向周围组织的侵袭性生长,手术难以彻底切除,多数患者术后易复发,预后较差[1],因此阐明促进胶质瘤侵袭的因素和机制,采取针对性治疗措施,具有重要理论意义和应用价值。细胞的上皮-间质转化(epithelial to mesenchymal transition,EMT)是指上皮细胞通过特定程序转化为具有间质细胞表型的生物学过程,使上皮细胞间的紧密连接缺失,转化为具有高迁移和高侵袭性的间质细胞性能,是肿瘤侵袭和转移的关键步骤[2]。通常EMT发生在上皮性恶性肿瘤组织中。近年研究[3-4]表明:胶质瘤也能发生EMT或EMT样改变,但胶质瘤发生EMT的情况比较复杂,尚有争议,需要更多的证据证明。本研究探讨转化生长因子β1(transforming growth factor beta 1,TGF-β1)对人恶性胶质瘤U87细胞EMT的诱导作用,并观察诱导EMT后细胞的形态及迁移能力的改变,为进一步控制胶质瘤的侵袭性生长提供理论依据。
1 材料与方法 1.1 细胞、主要试剂和仪器人恶性胶质瘤U87细胞购自南京凯基生物公司。DMEM培养基和胰蛋白酶为美国Gibco公司产品,胎牛血清(fetal calf serum, FBS)、青霉素和链霉素购自美国Hyclone公司,TGF-β1购自美国Peprotech公司,RIPA裂解液和BCA试剂盒为广州碧云天公司产品,抗上皮钙黏蛋白(E-cadherin)、抗神经钙黏蛋白(N-cadherin)、抗波形蛋白(Vimentin)、抗Snail抗体、抗Slug抗体和抗Zeb1抗体购自美国Cell Signaling Technology公司(1:1 000),抗β-actin抗体为北京博奥森公司产品(1:1 500~1:2 000)。通用台式离心机购自美国Thermo公司,生物安全柜购自苏州安泰公司。
1.2 细胞培养和传代用含有1×青霉素、1×链霉素和10%FBS的DMEM培养基培养恶性胶质瘤U87细胞,并置于37℃、5%CO2的饱和湿度培养箱中培养。每2~3d更换1次培养基,每5~6 d用胰酶消化并按1:2~1:3传代。
1.3 Western blotting法检测U87细胞中上皮标志物(上皮钙黏蛋白)、间质标志物(神经钙黏蛋白和波形蛋白)及转录因子(Snail、Slug和Zeb1蛋白)的相对表达水平取对数生长期的U87细胞接种于直径为10 cm的细胞培养皿,细胞密度为每皿5×105个,37℃培养箱中培养,待细胞生长至70%~80%融合时,换无血清培养基饥饿细胞12 h,再加入TGF-β1,终浓度分别为0×10-6(空白对照组)、2.5×10-6、5.0×10-6、10.0×10-6和20.0 ×10-6g·L-1(2.5×10-6、5.0×10-6、10.0×10-6和20.0 ×10-6g·L-1TGF-β1组),作用48 h后弃掉培养基,刮下细胞,用冷PBS收集细胞,离心后弃去上清,根据沉淀的量加入相应体积RIPA裂解液提取细胞蛋白,并用BCA试剂盒进行蛋白定量。每孔加入30~50 μg蛋白,进行聚丙烯酰胺凝胶电泳,电转蛋白至PVDF膜上,室温下用含5%脱脂奶粉的TBS封闭1 h,而后分别加入含有抗上皮钙黏蛋白(E-cadherin)、神经钙黏蛋白(N-cadherin)、波形蛋白(Vimentin)、Snail、Slug、Zeb1和β-actin的一抗(在TBST配制的5%脱脂奶粉中),4℃过夜孵育。次日,TBST洗膜3次,加入含有相应二抗用TBST配制的5%脱脂奶粉孵育1~2 h,再洗膜3次,加ECL显色剂,在Sagecreation凝胶成像系统中显影。以β-actin作为内参对照。以目的条带与β-actin灰度比值表示该蛋白相对表达水平。
1.4 倒置显微镜下观察细胞形态表现将处于对数生长期的U87细胞用胰酶消化后,接种于6孔板中,每孔2×105个细胞,待细胞过夜贴壁后换用无血清培养基培养,使细胞饥饿12 h,再换成含有10.0×10-6 g·L-1TGF-β1的无血清培养基继续培养48 h,40倍倒置显微镜下观察细胞形态表现并采集图像。
1.5 划痕愈合实验检测细胞相对迁移距离取处于对数生长期的U87细胞接种于6孔板,每孔3×105个细胞,待细胞生长至70%~80%融合时,换用无血清培养基饥饿细胞12 h,再用含10×10-6 g·L-1TGF-β1的无血清培养基诱导48 h后,用10 μL枪头尖在6孔板上平行划痕,制造划痕损伤,用PBS冲掉刮下的细胞,再换用无血清培养基培养24 h。倒置显微镜下采集图像,以划痕间隙的距离表示细胞的迁移能力。
1.6 统计学分析采用SPSS 19.0统计软件进行统计学分析。U87细胞中上皮钙黏蛋白、神经钙黏蛋白、波形蛋白、Snail、Slug和Zeb1蛋白的相对表达水平及划痕愈合实验的相对迁移距离以x±s表示,多组间样本均数比较采用方差分析,组间两两比较采用t检验。以α=0.05为检验水准。
2 结果 2.1 各组U87细胞中上皮钙黏蛋白、神经钙黏蛋白、波形蛋白、Snail、Slug和Zeb1蛋白的相对表达水平不同浓度TGF-β1作用48 h后,上皮标志物上皮钙黏蛋白的相对表达水平随着TGF-β1浓度的升高而逐渐降低,各浓度TGF-β1组U87细胞中上皮钙黏蛋白的相对表达水平分别较空白对照组降低16.3%、24.0%、41.3%和66.3%(P < 0.05或P < 0.01)。间质性标志物神经钙黏蛋白、波形蛋白的相对表达水平随着TGF-β1浓度的升高而逐渐升高,各浓度TGF-β1组U87细胞中神经钙黏蛋白相对表达水平分别较对照组增加11.5%(P>0.05)、39.4%(P>0.05)、51.0%(P < 0.05)和76.9%(P < 0.05);10.0×10-6和20.0×10-6 g·L-1TGF-β1组U87细胞中波形蛋白相对表达水平分别较空白对照组增加32.7%(P < 0.01)和111.5%(P < 0.01)。转录因子Snail、Slug和Zeb1蛋白的相对表达水平随TGF-β1浓度的升高而逐渐升高,各浓度TGF-β1组U87细胞中Snail蛋白相对表达水平分别较空白对照组升高45.1%(P>0.05)、71.6%(P<0.05)、61.8%(P<0.01)和103.9%(P<0.01);Slug蛋白分别增加20.6%、13.7%、41.2%和105.9%(P<0.05或P<0.01);Zeb1蛋白分别降低1.0%(P>0.05)和增加44.1%(P<0.01)、49.0%(P<0.01)及60.8%(P<0.01)。见图 1和表 1。
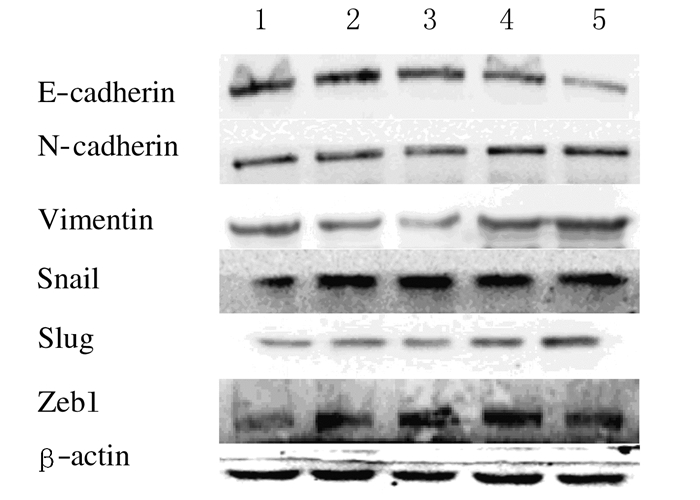
|
| Blank control group; Lane 2-5: 2.5, 5.0, 10.0, and 20.0×10-6g·L-1TGF-β1 groups. 图 1 Western blotting法检测各组U87细胞中上皮钙黏蛋白、神经钙黏蛋白、波形蛋白、Snail、Slug和Zeb1蛋白的相对表达水平电泳图 Figure 1 Electrophoregram of relative expression levels of E-cadherin, N-cadherin, Vimentin, Snail, Slug, and Zeb1 in U87 cells in various groups detected by Western blotting method |
|
|
| (x±s) | ||||||
| Group | E-cadherin | N-cadherin | Vimentin | Snail | Slug | Zeb1 |
| Blank control | 1.04±0.06 | 1.04±0.06 | 1.04±0.06 | 1.02±0.07 | 1.02±0.07 | 1.02±0.07 |
| TGF-β1(×10-6g·L-1) | ||||||
| 2.5 | 0.87±0.08* | 1.16±0.09 | 0.79±0.16 | 1.48±0.29 | 1.23±0.08* | 1.01±0.08 |
| 5.0 | 0.79±0.06** | 1.45±0.28 | 0.77±0.15* | 1.75±0.32* | 1.16±0.06* | 1.47±0.16* |
| 10.0 | 0.61±0.04** | 1.57±0.31* | 1.38±0.08** | 1.65±0.19** | 1.44±0.16* | 1.52±0.20* |
| 20.0 | 0.35±0.08** | 1.84±0.29* | 2.20±0.41** | 2.08±0.31** | 2.10±0.21** | 1.64±0.24* |
| *P<0.05, **P<0.01 compared with blank control group. *P<0.05 compared with 0 h;△P<0.05 compared with blank control group (24 h). | ||||||
倒置显微镜下观察可见:空白对照组U87细胞形态较为规则,细胞间连接紧密;与空白对照组比较,10.0× 10-6g·L-1TGF-β1组U87细胞形态发生较为明显的变化,细胞呈拉伸状,变得更为细长,并且出现更为分散的生长模式。见图 2(插页三)。

|
| 图 2 空白对照组(A)和10.0×10-6g·L-1 TGF-β1组(B) U87细胞的形态表现 Figure 2 Morphology of U87 cells in blank control group (A) and 10.0×10-6g·L-1 TGF-β1 group (B) |
|
|
倒置显微镜下观察可见:空白对照组细胞向划痕区有一定的迁移;与空白对照组比较,10.0× 10-6g·L-1 TGF-β1组U87细胞划痕间隙距离明显减小(P < 0.05)。见图 3(插页三)和4。
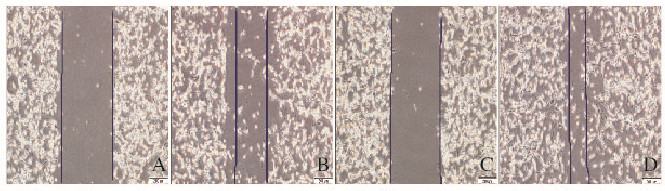
|
| A, B:Blank control group; C, D:10.0 ×10-6g·L-1 TGF-β1 group; A, C:0 h; B, D:24 h. 图 3 划痕愈合实验检测U87细胞的相对迁移距离 Figure 3 Relative migration distance of U87 cells detected by scratch healing assay |
|
|
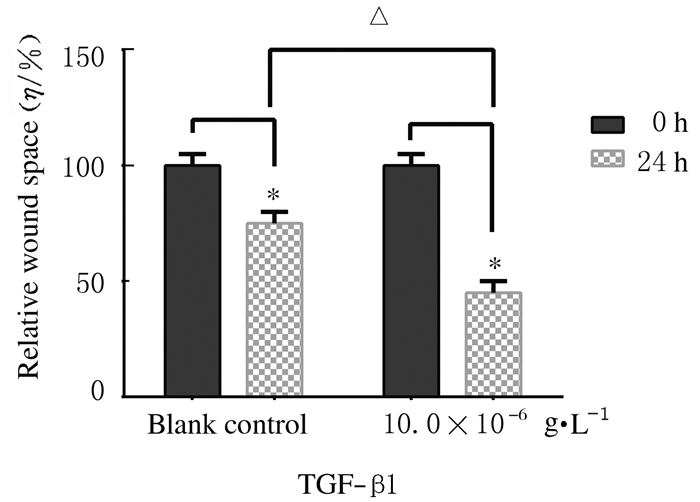
|
| 图 4 U87细胞的相对迁移距离 Figure 4 Relative migration distance of U87 cells |
|
|
目前对胶质瘤侵袭性生长的发生机制和影响因素已进行了诸多方面探索,但极少从胶质瘤EMT的角度进行研究。脑胶质瘤属于神经上皮性肿瘤,研究[5]显示:脑胶质瘤细胞也能发生EMT或EMT样改变,但情况比较复杂,还需更多的证据证明。EMT的重要特点是上皮性标志物上皮钙黏蛋白表达水平降低,这是EMT最重要的标志性改变,并伴有间质标志物神经钙黏蛋白表达水平升高,常将EMT中上皮钙黏蛋白下调和神经钙黏蛋白上调称为“E/N-钙黏蛋白转换”,对确定EMT具有重要价值[6]。本研究中胶质瘤U87细胞暴露于TGF-β1后,上皮钙黏蛋白的表达水平随TGF-β1浓度升高而明显降低,间质标志物神经钙黏蛋白和波形蛋白的表达水平则随着TGF-β1浓度的升高而明显增加,即出现了EMT的“E/N-钙黏蛋白转换”,表明TGF-β1呈浓度依赖性诱导U87细胞发生EMT。当TGF-β1浓度为10.0×10-6 g·L-1时,其抑制上皮钙黏蛋白和上调神经钙黏蛋白表达的作用已很明显,故将10.0×10-6 g·L-1TGF-β1作为诱导U87细胞发生EMT的最适浓度。
许多转录因子能不同程度地促进EMT和调控EMT进程,有些转录因子还可以作为EMT的标志物,用以评价肿瘤的侵袭和转移程度[7-8]。Snail作为重要的锌指蛋白转录因子,通过抑制上皮钙黏蛋白表达而诱导EMT,抑制Snail表达可减少胶质瘤细胞的侵袭[9]。转录因子Slug是抑制上皮钙黏蛋白转录和促进EMT的重要因子之一,在肿瘤细胞EMT调控机制中起关键作用[10-11]。锌指E-盒结合蛋白1(Zeb1)是诱导EMT的重要因子之一,Zeb1本身即是EMT的激活物,通过抑制上皮钙黏蛋白表达,诱导EMT促进肿瘤细胞的转移和侵袭[12]。研究[13-14]表明:Zeb1激活可增强胶质瘤细胞的迁移和侵袭。本研究结果表明:随着暴露TGF-β1浓度的升高,转录因子Snail、Slug和Zeb1蛋白的相对表达水平逐渐升高,TGF-β1浓度为10.0×10-6 g·L-1时该作用已很明显,进一步证明了TGF-β1能诱导胶质瘤U87细胞发生EMT。
肿瘤细胞发生EMT时伴随着形态、迁移和侵袭能力的改变,而肿瘤细胞的迁移与侵袭能力增强是肿瘤转移的关键步骤[15]。本研究结果表明:10.0×10-6g·L-1TGF-β1使U87细胞变成更为狭长的梭形,细胞间黏附减弱,细胞间变得松散。本研究中划痕愈合实验证明:与空白对照组比较,10.0×10-6 g·L-1TGF-β1组U87细胞的迁移能力增强,表明发生EMT的U87细胞表现为易于迁移的间质细胞特征。
有很多方法能诱导肿瘤细胞发生EMT,如TGF-β1、白细胞介素6、缺氧和某些转录因子等,其中使用较多的是TGF-β1。TGF-β1属于TGF-β家族成员,本身是EMT的强诱导因子,通过Smad和非Smad通路诱导EMT过程[7]。研究[16-18]表明:TGF-β1能激活上皮癌的EMT程序,如乳腺癌、前列腺癌和肺癌,导致癌细胞迁移和侵袭能力增加。由于诱导EMT时需排除细胞增殖所带来的影响,因此本研究在诱导过程中使用无血清培养基,同时,诱导之前饥饿细胞12 h,可以使细胞的细胞膜表面的受体增多,对于刺激因素更为敏感,更易诱导成功。使用TGF-β1诱导肿瘤细胞EMT简便、有效,且TGF-β1在恶性胶质瘤组织中呈高表达,TGF-β1可通过调节细胞增殖、血管生成、抑制免疫监视、招募炎症细胞和维持胶质瘤干细胞干性等,进一步促进胶质瘤进展,将TGF-β1信号通路作为靶点已成为胶质瘤治疗策略之一[19-21]。
| [1] | Salgaller ML, Liau LM. Current status of clinical trials for glioblastoma[J]. Rev Recent Clin Trials, 2006, 1(3): 265–281. DOI:10.2174/157488706778250140 |
| [2] | Kalluri R, Weinberg RA. The basics of epithelial-mesenchymal transition[J]. J Clin Invest, 2009, 119(6): 1420–1428. DOI:10.1172/JCI39104 |
| [3] | Lee JK, Joo KM, Lee J, et al. Targeting the epithelial to mesenchymal transition in glioblastoma:the emerging role of MET signaling[J]. Oncol Targets Ther, 2014, 7: 1933–1944. |
| [4] | Kubelt C, Hattermann K, Sebens S, et al. Epithelial-to-mesenchymal transition in paired human primary and recurrent glioblastomas[J]. Int J Oncol, 2015, 46(6): 2515–2525. |
| [5] | Kahlert UD, Nikkhah G, Maciaczyk J. Epithelial-to-mesenchymal (-like) transition as a relevant molecular event in malignant gliomas[J]. Cancer Lett, 2013, 331(2): 131–138. DOI:10.1016/j.canlet.2012.12.010 |
| [6] | Cervantes-Arias A, Pang LY, Argyle DJ. Epithelial-mesenchymal transition as a fundamental mechanism underlying the cancer phenotype[J]. Vet Comp Oncol, 2013, 11(3): 169–184. DOI:10.1111/vco.2013.11.issue-3 |
| [7] | Lamouille S, Xu J, Derynck R. Molecular mechanisms of epithelial-mesenchymal transition[J]. Nat Rev Mol Cell Biol, 2014, 15(3): 178–196. DOI:10.1038/nrm3758 |
| [8] | Jia W, Zhu J, Martin TA, et al. Epithelial-mesenchymal transition (EMT) markers in human pituitary adenomas indicate a clinical course[J]. Anticancer Res, 2015, 35(5): 2635–2643. |
| [9] | Myung JK, Choi SA, Kim SK, et al. Snail plays an oncogenic role in glioblastoma by promoting epithelial mesenchymal transition[J]. Int J Clin Exp Pathol, 2014, 7(5): 1977–1987. |
| [10] | Shih JY, Yang PC. The EMT regulator slug and lung carcinogenesis[J]. Carcinogenesis, 2011, 32(9): 1299–1304. DOI:10.1093/carcin/bgr110 |
| [11] | Yang HW, Menon LG, Black PM, et al. SNAI2/Slug promotes growth and invasion in human gliomas[J]. BMC Cancer, 2010, 10: 301. DOI:10.1186/1471-2407-10-301 |
| [12] | Zhang P, Sun Y, Ma L. ZEB1:at the crossroads of epithelial-mesenchymal transition, metastasis and therapy resistance[J]. Cell Cycle, 2015, 14(4): 481–487. DOI:10.1080/15384101.2015.1006048 |
| [13] | Kahlert UD, Maciaczyk D, Doostkam S, et al. Activation of canonical WNT/β-catenin signaling enhances in vitro motility of glioblastoma cells by activation of ZEB1 and other activators of epithelial-to-mesenchymal transition[J]. Cancer Lett, 2012, 325(1): 42–53. DOI:10.1016/j.canlet.2012.05.024 |
| [14] | Siebzehnrubl FA. The ZEB1 pathway links glioblastoma initiation, invasion and chemoresistance[J]. EMBO Mol Med, 2013, 5(8): 1196–1212. DOI:10.1002/emmm.201302827 |
| [15] | Zhang H, Li Y, Lai M. The microRNA network and tumor metastasis[J]. Oncogene, 2010, 29(7): 937–948. DOI:10.1038/onc.2009.406 |
| [16] | Mani SA, Guo W, Liao MJ, et al. The epithelial-mesenchymal transition generates cells with properties of stem cells[J]. Cell, 2008, 133(4): 704–715. DOI:10.1016/j.cell.2008.03.027 |
| [17] | Hance MW, Dole K, Gopal U, et al. Secreted Hsp90 is a novel regulator of the epithelial to mesenchymal transition (EMT) in prostate cancer[J]. J Biol Chem, 2012, 287(45): 37732–37744. DOI:10.1074/jbc.M112.389015 |
| [18] | Xiao D, He J. Epithelial mesenchymal transition and lung cancer[J]. J Thorac Dis, 2010, 2(3): 154–159. |
| [19] | Han J, Alvarez-Breckenridge CA, Wang QE, et al. TGF-β signaling and its targeting for glioma treatment[J]. Am J Cancer Res, 2015, 5(3): 945–955. |
| [20] | 向伟, 漆松涛, 刘亚伟, 等. 改良酶消化法在人脑胶质瘤细胞快速原代培养中的应用[J]. 解放军医学杂志, 2016, 41(6): 461–465. |
| [21] | 葛光治, 杨艺, 张强. 多模态磁共振技术在胶质瘤复发与放射性脑损伤鉴别诊断中的应用价值[J]. 解放军医学杂志, 2015, 40(11): 921–926. |
 2016, Vol. 42
2016, Vol. 42


