扩展功能
文章信息
- 汪佳琦, 姜文月, 张琳, 王君花, 赵芯, 王雨, 刘忠英
- WANG Jiaqi, JIANG Wenyue, ZHANG Lin, WANG Junhua, ZHAO Xin, WANG Yu, LIU Zhongying
- 胡芦巴中皂苷、黄酮和多糖组分不同配伍对1型糖尿病大鼠的降血糖作用
- Hypoglycemic effects of saponins, flavonoids, and polysaccharides of fenugreek with different component compatibilities on type 1 diabetic rats
- 吉林大学学报(医学版), 2016, 42(06): 1081-1086
- Journal of Jilin University (Medicine Edition), 2016, 42(06): 1081-1086
- 10.13481/j.1671-587x.20160608
-
文章历史
- 收稿日期: 2016-04-26
胡芦巴为豆科蝶形花亚科胡芦巴属一年生草本植物,又名芸香草、香苜蓿。在印度、埃及、中东和南非普遍种植[1]。胡芦巴属药食同源之品,其干燥成熟种子作为常用中药收入中国药典[2]。现代研究[3]显示:胡芦巴对糖尿病、高血脂、肠疾病、痛风和痛经等具有很好的疗效。近年来,很多学者也证实胡芦巴的提取物和发芽制品均有很好的治疗糖尿病和高血脂的效果[4]。胡芦巴中含量最高的3类药效活性组分依次是多糖、皂苷和黄酮,三者均是胡芦巴降血糖活性物质,除有良好的降血糖效果,还具有增加肝糖原含量、抑制α-葡萄糖苷酶活性及改善胰岛素抵抗的作用[5]。但三者的作用途径并不完全相同。多糖还可以通过延缓糖吸收[6]等途径调节血糖水平;皂苷和黄酮通过修复受损胰岛、促进胰岛素分泌途径发挥降血糖作用[5, 7];此外皂苷还具有增加肌糖原水平和调节血脂[8-9]的生物活性作用。本研究通过胡芦巴3种组分配伍,研究各组分治疗糖尿病的协同作用,体现了中药多途径、多环节和多靶点整体作用的特点。首先对胡芦巴中3种组分开展纯化制备,而后对3种组分进行配伍研究,通过观察血糖水平、胰腺和肾脏的组织形态表现以及检测大鼠尿液中尿蛋白含量和血清甘油三酯(TG)、总胆固醇(T-CHO)、晚期糖基化终末产物(AGEs)水平,筛选出3种组分最优配伍比例,并对其作用机制进行研究,为胡芦巴作为降血糖新药的开发提供理论依据。
1 材料与方法 1.1 实验动物、主要试剂和仪器健康SD大鼠61只,雄性,SPF级,体质量(210±20) g,购于吉林大学实验动物中心,动物合格证号:SCXK (辽)2015-0001。胡芦巴种子(产地四川省)购于吉林省长春市医药药材供销公司,DM130大孔吸附树脂、聚酰胺树脂(30-60目)和D101大孔吸附树脂均购于中国医药集团上海化学试剂公司,其他试剂均为分析纯,水为超纯水。链脲佐菌素(STZ)购于美国Sigma公司,柠檬酸和柠檬酸钠购于上海翊圣生物科技有限公司,盐酸二甲双胍购于深圳海王药业有限公司,大鼠尿蛋白定量试剂盒、TG试剂盒、T-CHO试剂盒和AGEs ELISA检测试剂盒购于南京建成生物工程研究所。血糖试纸和血糖仪为北京怡成生物电子技术有限公司产品,Centrifuge 5810R高速离心机(Eppendorf公司,美国),GENios Pro多功能酶标仪(Tecan公司,瑞士),Milli-Q Gradient A10超纯水系统(Millipore公司,美国)。
1.2 胡芦巴皂苷、黄酮和多糖的提取和纯化取胡芦巴粗粉加入10倍量石油醚超声脱脂,而后用10倍量70%乙醇加热回流提取3次,每次1.5 h,提取液减压浓缩,并以水定容至0.2 g生药·mL-1。采用DM130大孔吸附树脂纯化,先后采用H2O与30%乙醇除杂后,采用60%乙醇洗脱,洗脱液减压浓缩,冻干得到胡芦巴皂苷组分。
黄酮脱脂与提取方法同皂苷,首先采用聚酰胺树脂进行纯化,采用水洗脱除杂后,采用70%乙醇洗脱,洗脱液减压浓缩,上样至D101大孔吸附树脂柱,30%乙醇洗脱,洗脱液减压浓缩,冻干得到胡芦巴黄酮组分。胡芦巴多糖提取所用原料为干燥后的胡芦巴黄酮提取所得残渣,以10倍量蒸馏水,10 ℃磁力搅拌条件下提取100 min,离心合并上清液,70%乙醇醇沉,然后用适量蒸馏水使其复溶,冻干得到胡芦巴多糖组分。
1.3 1型糖尿病大鼠模型的建立61只健康SD雄性大鼠中随机选取11只大鼠作为正常对照组,其余50只大鼠进行造模。适应性喂养7 d,禁食不禁水16 h,采用65 mg·kg-1 STZ腹腔注射造模。1周后,大鼠的空腹血糖≥16.7 mmol·L-1即为造模成功,各组大鼠血糖水平差异应小于1 mmol·L-1。共有35只大鼠造模成功。
1.4 分组和给药方式正常对照组大鼠11只,35只造模成功的大鼠随机分为模型组(9只)、阳性药组(7只)、低剂量多糖配伍组(多糖:皂苷:黄酮3:6:1,6只)、中剂量多糖配伍组(多糖:皂苷:黄酮12:8:1,6只)和高剂量多糖配伍组(多糖:皂苷:黄酮=10:4:1,7只)。和正常对照组和模型组大鼠给予10 mL·kg-1·d-1纯净水,阳性药组大鼠给予0.018 g·kg-1·d-1盐酸二甲双胍,各剂量多糖配伍组大鼠按照比例给予0.45 g·kg-1·d-1胡芦巴组分。各组大鼠每日灌胃给药1次,连续给药4周。灌胃前药液以37 ℃水浴20 min。
1.5 大鼠FBG水平测定大鼠灌胃给药后第7、14、21和28天将大鼠禁食不禁水12 h,尾尖采血测定FBG水平。
1.6 大鼠尿液中尿蛋白和血清TG、TC及AGEs水平检测末次给药结束后,大鼠禁食不禁水,收集16 h的尿液,记录尿量,并在4℃条件下离心收集上清液,按试剂盒说明书测定尿蛋白浓度(g · L-1),其浓度乘以16 h尿量即为尿蛋白水平(mg);大鼠处死后,取血,4℃条件下静置2 h,离心收集血清,按试剂盒说明书测定血清TG、TC和AGEs水平。
1.7 大鼠胰腺和肾脏组织形态表现大鼠处死后,取出胰腺和右侧肾脏,置于10 %甲醛中固定,HE染色,光镜下观察大鼠胰腺和肾脏组织形态表现。
1.8 统计学分析采用SPSS19.0统计软件进行统计学分析。各组大鼠FBG、尿蛋白、血清TG、TC和AGEs水平以x±s表示,组间比较采用t检验。以α=0.05为检验水准。
2 结果 2.1 各组大鼠FBG水平在28 d的实验中,模型组大鼠FBG水平一直保持在高水平,并有持续升高趋势;各剂量多糖配伍组和阳性药组大鼠FBG水平随着连续给药治疗而逐步降低。给药14 d时,各剂量多糖配伍组和阳性药组大鼠FBG水平开始下降;给药21 d时,与模型组比较,各剂量多糖配伍组和阳性药组大鼠FBG水平均降低,但组间比较差异无统计学意义(P>0.05);给药28 d时,与模型组比较,阳性药组大鼠FBG水平降低(P < 0.05),各剂量多糖配伍组大鼠FBG水平明显降低(P < 0.01),其中低剂量多糖配伍组大鼠FBG水平下降幅度最大。见表 1。
| [x±s,cB/(mmol·L-1)] | ||||||
| Group | n | FBG | ||||
| (t/d) 0 | 7 | 14 | 21 | 28 | ||
| Normal control | 11 | 3.31±0.62 | 3.50±0.55 | 3.56±0.39 | 3.89±0.45 | 3.69±0.51 |
| Model | 9 | 23.09±2.58* | 23.00±2.25* | 22.26±2.41* | 22.89±2.57* | 22.65±1.93* |
| Positive drug | 7 | 22.55±2.78 | 22.59±2.18 | 21.01±3.16 | 19.79±3.72 | 17.79±4.21△ |
| Polysaccharides compatibility | ||||||
| Low dose | 6 | 23.24±3.07 | 22.98±1.73 | 21.62±3.62 | 19.35±3.30 | 17.70±3.75△△ |
| Middle dose | 6 | 23.28±1.80 | 23.09±1.79 | 21.74±2.01 | 20.10±2.60 | 18.77±2.11△△ |
| High dose | 7 | 23.15±2.34 | 23.01±3.17 | 21.87±3.08 | 20.67±2.40 | 19.47±2.07△△ |
| *P < 0.01 vs normal control group;△P < 0.05,△△P < 0.01 vs model group. | ||||||
与正常对照组比较,模型组大鼠尿液中尿蛋白水平明显升高(P < 0.01);与模型组比较,阳性药组和各剂量多糖配伍组大鼠尿蛋白水平明显降低(P < 0.05或P < 0.01)。见表 2。
| (x±s) | |||||
| Group | n | Urinary protein (m/mg) |
Serum TG [cB/(mmol·L-1)] |
Serum TC [cB/(mmol·L-1)] |
Serum AGEs [ρB/(ng·L-1)] |
| Normal control | 11 | 4.52±1.02 | 1.35±0.27 | 0.59±0.14 | 177.89±12.79 |
| Model | 9 | 10.14±2.57* | 2.77±0.34* | 4.01±1.40* | 313.97±17.41* |
| Positive drug | 7 | 6.95±0.41△△ | 1.48±0.47△△ | 0.70±0.14△△ | 255.68±34.58△△ |
| Polysaccharides compatibility | |||||
| Low dose | 6 | 6.38±0.14△△ | 1.49±0.55△△ | 0.73±0.39△△ | 248.11±32.88△△ |
| Middle dose | 6 | 7.09±0.95△ | 1.49±0.48△△ | 0.91±0.45△△ | 253.67±22.66△△ |
| High dose | 7 | 7.12±0.90△ | 1.55±0.36△△ | 1.62±0.95△△ | 261.51±19.25△△ |
| *P < 0.01 vs normal control group;△P < 0.05,△△P < 0.01 vs model group | |||||
与正常对照组比较,模型组大鼠血清TG、TC和AGEs水平明显升高(P < 0.01)。阳性药组和各剂量多糖配伍组大鼠血清TG、TC和AGEs水平明显低于模型组(P < 0.01),低剂量多糖配伍组大鼠血清TG、TC和AGEs水平明显低于中和高剂量多糖配伍组,且低剂量多糖配伍组大鼠血清TC和AGEs水平低于阳性药组,但组间比较差异无统计学意义(P>0.05)。见表 2。
2.4 各组大鼠胰腺组织形态表现与正常对照组比较,模型组大鼠胰腺组织中胰岛数目减少,胰岛体积缩小,边界不清,胰岛中细胞数目减少,排列不规则,展现出糖尿病胰岛损伤的典型形态。与模型组比较,各剂量多糖配伍组和阳性药组大鼠胰岛损伤程度均有所缓解,胰岛数目增多,胰岛体积增大,胰岛中细胞数目增多,排列趋于规整,其中中、高剂量多糖配伍组与阳性药组的修复作用效果相似,而低剂量多糖配伍组大鼠胰岛损伤的表现最轻微。见图 1(插页二)。
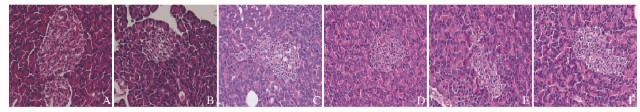
|
| A: Normal control group; B: Model control group; C: Positive drug group; D: High dose of polysaccharides compatibility group; E: Middle dose of polysaccharides compatibility group; F: Low dose of polysaccharides compatibility group. 图 1 各组大鼠胰腺组织的形态表现(HE, ×400) Figure 1 Morphology of pancreas tissue of rats in various groups (HE, ×400) |
|
|
正常对照组大鼠肾脏组织中未见肾小球扩张,肾小管未见肿胀。模型组大鼠肾小球扩张肿胀,毛细血管管腔闭塞,系膜细胞增多,肾小管明显扩张,肾近曲小管上皮细胞肿胀变性,空泡形成。与模型组比较,各剂量多糖配伍组和阳性药物组大鼠肾小球扩张程度减弱、毛细血管管腔闭塞程度降低,近曲小管肿胀减轻,且空泡减少,其中低剂量多糖配伍组大鼠肾脏组织损伤的表现最轻微。见图 2(插页二)。
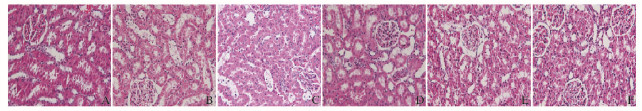
|
| A: Normal control group; B: Model control group; C: Positive drug group; D: High dose of polysaccharides compatibility group; E: Middle dose of polysaccharides compatibility group; F: Low dose of polysaccharides compatibility group. 图 2 各组大鼠肾脏组织的形态表现(HE, ×400) Figure 2 Morphology of kidney tissue of rats in various groups (HE, ×400) |
|
|
糖尿病是体内胰岛素相对或绝对不足或靶细胞对胰岛素敏感性降低、或胰岛素本身存在结构上的缺陷而引起的糖、脂肪和蛋白质代谢紊乱的一种慢性疾病[10]。在生物化学方面,主要改变为血糖升高和血脂异常等;在受累组织器官方面,主要表现为大血管和微血管病变[11]。
近年来,胡芦巴有效成分用于防治糖尿病引起人们的关注,区别于西药的“治标”,中药则为“治本”,并且具有多途径、多环节和多靶点的作用特点。与皮下注射胰岛素快速发挥降糖作用的方式不同,胡芦巴组分配伍的降糖作用较缓慢。这是由于各活性组分间发挥协同作用,通过修复受损胰岛和肾脏组织,改善胰岛素抵抗等途径,参与调节体内组氨酸代谢、色氨酸代谢、苯丙氨酸代谢、脂肪酸代谢、三酸循环、肝脏糖代谢酶活性、鞘脂类代谢和溶血磷脂lysoPEs代谢[5]等过程来发挥降血糖及防治糖尿病并发症的作用。所以胡芦巴组分配伍的降糖作用不会在短时间内见效,而是随着给药时间的延长其作用越加明显。本研究结果显示:胡芦巴组分配伍降糖功效在给药14 d后开始发挥,而给药28 d时出现明显的降糖作用。
由于糖尿病的持续高血糖会引起体内多种蛋白质非酶糖基化,因此形成的AGEs在糖尿病慢性并发症的发病机制中起重要作用。AGEs水平变化可以反映出体内的糖基化水平,AGEs是评价体内糖基化过程的重要指标,其水平升高说明了体内蛋白质糖基化过程的加剧程度[12]。本研究结果显示:配伍给药能够不同程度地缓解糖尿病大鼠症状、降低血糖、抑制AGEs的产生。此外,本研究设立了阳性药组,给予二甲双胍,二甲双胍作为首选抗糖尿病药物[13],具有抑制糖基化反应的作用,已被大量研究[14]所证实。本研究结果显示:低、中和高剂量多糖配伍组和阳性药组大鼠的AGEs水平比较差异无统计学意义,进一步验证了胡芦巴组分配伍具有抑制蛋白非酶糖基化的作用,证实了胡芦巴组分配伍能抑制蛋白非酶糖基化反应的全过程,通过使血液中葡萄糖与蛋白质结合减少,从而在糖基化反应的初始阶段就抑制反应的进行,同时干扰了蛋白非酶糖基化反应的某个中间反应,并在反应末期抑制AGEs产生,使得各剂量多糖配伍对AGEs的抑制作用更加明显。
糖尿病可以通过多种途径损伤肾脏,危害肾脏所有组织结构,最终导致糖尿病肾病(DN)。现代医学已认识到糖尿病的发病机制复杂,其与高血糖及其所导致的脂代谢异常、肾脏和全身血液动力学改变、多元醇通路活性增加、蛋白非酶糖基化、细胞因子激活及遗传及环境等因素密切相关[15]。尿蛋白水平和肾脏组织病理检测是DN评估最主要的指标[16]。糖尿病大鼠产生葡萄糖利用障碍,抗脂解作用降低,FBG、TC和TG水平增加,对机体产生糖毒性和脂毒性作用,引起机体多种功能受损[17]。本研究结果显示:低剂量多糖配伍(多糖:皂苷:黄酮3:6:1)有明显的保护大鼠胰腺、肾脏和降低血脂的功能,使大鼠尿蛋白、血清TG和TC水平下降。这是因为随着胡芦巴组分配伍对受损胰腺、肾脏功能的修复,使糖尿病大鼠糖代谢和脂代谢得以改善,脂肪酶合成增加,血脂水平降低。在高血糖状态下,各种通路促使AGEs水平升高,进一步导致肾脏损伤与功能降低,同时促使内皮细胞功能障碍;最终引起内皮功能受损,引发糖尿病相关血管疾病。血管内皮细胞功能障碍导致的微血管发生过度是DN的主要病因[18-23]。本研究结果提示:胡芦巴组分配伍给药后可减少尿蛋白的排出,减轻肾小球内皮细胞及系膜细胞的损伤,修复细胞功能障碍,减少细胞外基质形成,延缓肾小球硬化,改善肾小球滤过功能,保护肾功能。本研究结果证实:胡芦巴组分配伍对肾脏组织的保护功能可能是通过改善血脂代谢、抑制蛋白非酶糖基化和修复损伤内皮细胞等实现的。
综上所述,胡芦巴成分中多糖:皂苷:黄酮为3:6:1时对糖尿病及其并发症有更好的治疗作用。说明胡芦巴的组分配伍在抑制蛋白非酶糖基化反应和防治糖尿病及其并发症等方面具有良好的应用前景,本研究为深入开展胡芦巴的药效物质基础研究奠定了基础,同时也为胡芦巴组分配伍降血糖新药开发提供了理论依据。
| [1] | 李国梁, 绪扩, 程亚涛, 等.胡芦巴降血糖活性研究进展[C].中华中医药学会中药化学分会第八届学术年会, 北京:2013. |
| [2] | 兰卫, 高晓黎, 毛新民. 胡芦巴药理作用的研究进展[J]. 西北药学杂志, 2008, 23(5): 335–336. |
| [3] | 王伟. 胡芦巴汤治疗痛经80例[J]. 新中医, 2009(2): 85–85. |
| [4] | 隋宏.胡芦巴治疗糖尿病和高血脂的研究进展[C].第一届全国中药商品学术大会, 青岛:2008. |
| [5] | 姜文月.胡芦巴降血糖成分分析及降血糖作用机制研究[D].长春:吉林大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10183-1015587893.htm |
| [6] | 时潇丽, 姚春霞, 林晓, 等. 多糖药物应用及研究进展[J]. 中国新药杂志, 2014, 6(5): 172–179. |
| [7] | 杨梅.胡芦巴有效物质提取工艺研究及其质量标准指标的初步建立[D].广州:广东药学院, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10573-1015803663.htm |
| [8] | 何焱, 王继双, 张鹏, 等. 薯蓣皂苷元药理作用及其机制研究进展[J]. 中草药, 2013, 44(19): 2759–2765. |
| [9] | 曲萌, 崔继春, 董志恒. 胡芦巴总皂苷对心肌成纤维细胞转分化的影响及机制的实验研究[J]. 华北大学学报, 2012, 13(2): 167–172. |
| [10] | Zhao H, Li Z, Tian G, et al. Effects of traditional Chinese medicine on rats with type Ⅱ diabetes induced by high-fat diet and streptozotocin:a urine metabonomic study[J]. African Health Sci, 2013, 13(3): 673–681. |
| [11] | 吴知桂, 周德先, 陈美娟. 参黄胶囊对2型糖尿病大鼠血脂及炎性因子的影响[J]. 中成药, 2014, 36(8): 1747–1750. |
| [12] | 刘洋, 柳春. 苦荞麦对糖尿病大鼠血糖蛋白非酶糖基化反应的影响[J]. 辽宁中医药大学学报, 2009, 11(5): 195–196. |
| [13] | Viollet B, Guigas B, Sanz GN, et al. Cellular and molecular mechanisms of metformin:an overview[J]. Clin Sci (Lond), 2012, 122(6): 253–70. DOI:10.1042/CS20110386 |
| [14] | 乔进, 窦志华, 吴锋, 等. 灵芝多糖联合二甲双胍对2型糖尿病大鼠心肌AGEs及CTGF的影响及其机制[J]. 中国药理学通报, 2014, 30(4): 536–541. |
| [15] | 宋述菊. 糖尿病肾病病因病机及辨证探讨[J]. 山东中医杂志, 1999, 18(4): 147–148. |
| [16] | Sarafidis PA, Riehle J, Bogojevic Z, et al. A comparative evaluation of various methods for microalbuminuria screening[J]. Am J Nephrol, 2008, 28: 324. |
| [17] | 张莹莹, 于捷, 周旋, 等. 复方降糖茶对STZ诱导的糖尿病大鼠的治疗作用及其可能机制[J]. 温州医学院学报, 2011, 41(3): 224–227. |
| [18] | 唐代屹, 郭赛珊, 孙仁宇. 仙贞片对糖尿病大鼠肾皮质终末期糖化终产物及其受体mRNA表达的影响[J]. 中国中西医结合杂志, 2005, 25(1): 60–63. |
| [19] | Hegab Z, Gibbons S, Neyses L, et al. Role of advanced glycation endproducts in cardiovascular disease[J]. World J Cardiol, 2012, 4(4): 90–102. DOI:10.4330/wjc.v4.i4.90 |
| [20] | Kota SK, Meher LK, Jammula S, et al. Aberrant angiogenesis:Thegateway to diabetic complications[J]. Indian J Endocrinol Metab, 2012, 16(6): 918–930. DOI:10.4103/2230-8210.102992 |
| [21] | 杨立勇. 1型糖尿病微血管并发症特点及应对[J]. 中国实用内科杂志, 2016, 36(7): 543–546. |
| [22] | 倪奇, 石勇铨. 糖尿病肾病降糖药物选择[J]. 中国实用内科杂志, 2015, 35(7): 595–598. |
| [23] | 钱莉, 吴晨光, 杨涛. 1型糖尿病预测及预防研究进展[J]. 中国实用内科杂志, 2016, 36(7): 528–532. |
 2016, Vol. 42
2016, Vol. 42


