扩展功能
文章信息
- 袁静, 陈耀宇, 赵艺帆, 刘小博, 刘朋飞, 赵雷
- YUAN Jing, CHEN Yaoyu, ZHAO Yifan, LIU Xiaobo, LIU Pengfei, ZHAO Lei
- SOX2对牙髓干细胞神经分化的促进作用及其意义
- Promotive effect of SOX2 on neural differentiation of dental pulp stem cells and its significance
- 吉林大学学报(医学版), 2016, 42(06): 1076-1080
- Journal of Jilin University (Medicine Edition), 2016, 42(06): 1076-1080
- 10.13481/j.1671-587x.20160607
-
文章历史
- 收稿日期: 2016-04-01
2. 吉林大学药学院再生医学系, 吉林 长春 130021
2. Department of Regenerative Medicine, School of Pharmacy, Jilin University, Changchun 130021, China
干细胞一直是再生医学领域的研究热点。目前,已有多种干细胞的分离和培养技术相继建立,甚至在临床水平上获得了一定的应用[1-2]。与胚胎干细胞比较,成体干细胞在临床应用方面已取得了较多的成果,这主要由于成体干细胞在分化能力方面并不具备胚胎干细胞的全能性,在体内较为容易控制,不易形成畸胎瘤,而且避免了胚胎干细胞的伦理学争议问题[2-3]。牙髓干细胞(dental pulp stem cells,DPSCs)是牙髓组织中存在的一类成体干细胞,该细胞的分离方法简便,且细胞的增殖能力较强,具有多向分化的能力,在口腔牙源组织修复方面已经建立较为成熟的技术方法,此外,在神经分化方面也具有一定的应用前景[4-7]。SOX2(sex determining region Y-box 2)是一种重要的转录因子,对细胞的增殖和分化均具有调控作用,随着诱导多能性干细胞技术的建立,SOX2在体细胞重编程及细胞命运转化中的作用也逐渐受到研究者的重视[8-11]。研究[12]证实:通过SOX2和OCT4等转录因子的诱导,可以将人源DPSCs成功重新编程为诱导多能性干细胞,该技术在再生医学中具有重要的应用价值。此外,SOX2也是一种重要的神经分化调控因子,研究[13-14]表明:通过在成体干细胞中过表达SOX2等转录因子,可以提升细胞的神经分化能力,甚至将某些本身不具有分化能力的体细胞直接转分化为神经细胞,并实现对神经损伤的修复。本课题组的前期研究[15]结果表明:在DPSCs中过表达SOX2后,可以明显提高细胞的增殖能力,同时该方法对DPSCs的迁移和黏附能力也具有一定的促进作用。但是SOX2是否也可以进一步提升DPSCs的神经分化能力目前尚不明确,所以本课题组在前期研究工作的基础上,针对这一问题进行进一步的探讨。
1 材料与方法 1.1 细胞、主要试剂和仪器DPSCs为本课题组前期研究中留存。DMEM/F12培养基和胎牛血清(Gibco公司,美国),NeuroCult ® NS-A神经分化培养基(STEMCELL Technologies公司,美国),EGF、bFGF、PDGF-BB、Accutase消化液和小鼠抗人β3-Tubulin单克隆抗体(Sigma公司,美国),Matrigel和小鼠抗人Nestin-PE、Pax6-FITC单克隆抗体(BD公司,美国)、Trizol RNA提取液、羊抗小鼠IgG-Alexa Fluor® 568和IgG-FITC多克隆抗体(Invitrogen公司,美国),RNA反转录试剂盒和实时定量PCR试剂盒(TaKaRa公司,日本),CCK-8增殖检测试剂盒(Dojindo公司,美国)。IX-70倒置相差显微镜和BX51TF荧光显微镜(Olympus公司,日本),PCR仪(北京东胜创新生物科技有限公司),CFX96实时定量PCR仪和FACSCalibur流式细胞仪(BD公司,美国)。
1.2 DPSCs的分离鉴定和SOX2过表达体系的构建DPSCs的分离培养和鉴定方法同参考文献[15]。收集人第三磨牙牙髓后,将组织剪碎,用PBS清洗2次,再用3 g·L-1Ⅰ型胶原酶于37℃条件下消化1 h,通过70 mm滤膜过滤收集单细胞,细胞经PBS清洗2次后,用含有10%胎牛血清的DMEM/F12培养基培养,此时细胞记为第1代,DPSCs隔日换液1次,培养4~6 d进行传代,传至第3~4代时,细胞用于后续实验检测。采用流式细胞术评价CD29、CD44和CD73等标记分子在DPSCs中的表达程度,通过成脂成骨分化实验评价细胞的分化能力。pMX-SOX2过表达载体由吉林大学药学院生物工程实验中心提供。本课题中采用293T细胞制备逆转录病毒,通过逆转录病毒感染的方法构建过表达SOX2的DPSCs (DPSCs-SOX2组),以感染空载体的DPSCs作为对照组(DPSCs-vector组)进行后续评价,具体鉴定方法可参考本课题组前期研究[15]成果。
1.3 DPSCs向神经前体细胞(neural progenitor cells,NPCs)的分化和鉴定将DPSCs消化为单细胞后分为DPSCs组、DPSCs-vector组和DPSCs-SOX2组,以每孔2×105个细胞的密度接种至低吸附24孔板中,采用NeuroCult® NS-A神经分化培养(含有1 0 μg·L-1 bFGF和10 μg·L-1 EGF)进行分化诱导,培养1周后采用Accutase消化细胞,进行传代,继续分化培养2周后,即成为DPSCs衍生的NPCs。
1.4 培养不同时间后各组NPCs的增殖指数(proliferation index,PI)将NPCs消化为单细胞后,以每孔2×103的密度接种至96板中,采用CCK-8试剂盒检测细胞在接种后第0、1、2和3天细胞的增殖活性,每孔培养基体积为100 μL,在对应检测时间点,每孔加入10 μL CCK-8试剂,于37℃条件下孵育2 h,于450 nm波长下培养不同时间后检测各组NPCs的吸光度(A)值,每组设4个复孔,仅含培养基的孔作为空白组,计算NPCs的PI,PI=实验组A值-空白组A值。
1.5 qPCR法检测NPCs中Nestin和Pax6基因的表达水平采用qPCR法检测DPSCs衍生的NPCs中Nestin和Pax6基因的表达水平,采用Trizol提取细胞总RNA后,通过反转录试剂盒获得细胞基因组cDNA,并以此为模板检测细胞中Nestin和Pax6基因的表达水平,在检测过程中,以β-actin作为内参照,将正常DPSCs衍生的NPCs (DPSCs-NPCs)作为空白对照组,并将基因在空白对照组的表达水平设为“1”,通过等比例比较基因在DPSCs-SOX2衍生的NPCs (DPSCs-SOX2-NPCs组)和DPSCs-vector衍生的NPCs (DPSCs-vector-NPCs组)中表达水平。qPCR法所用引物序列:Nestin上游引物为5′-CTGGAGCAGGAGAAACAGG -3′,Nestin下游引物为5′-TGGGAGCAAAGAT-CCAAGAC -3′;Pax6上游引物为5′-ATGTGTGAGTAAAATTCTGGGCA-3′; Pax6下游引物为5′-GCTTACAACTTCTGGAGTCGCTA-3′;β-actin上游引物为5′-CCCAGAGCAAGAGAGG-3′,β-actin下游引物为5′-GTCCAGACG-CAGGATG-3′。
NPCs消化为单细胞后,经过固定和通透后,将1×106个细胞悬浮于0.1 mL PBS中,小鼠抗人Nestin-PE和Pax6-FITC单克隆抗体均按1:50的稀释比例与细胞混合,于室温孵育0.5 h后,用PBS清洗2次,采用流式细胞术检测细胞中Nestin和Pax6基因的表达水平。
1.6 NPCs的分化能力评价和分化后β3-Tubulin的表达效率将NPCs消化为单细胞,接种于Matrigel包被的培养板中,用NeuroCult® NS-A神经分化培养(含有10 μg·L-1 PDGF-BB)进行分化诱导,持续诱导2~3周后,采用免疫荧光和流式细胞术检测NPCs向神经元的分化效果。免疫荧光检测方法:对细胞进行固定、通透和封闭后,用小鼠抗人β3-Tubulin单克隆抗体(1:100稀释比例)孵育细胞,于4℃条件下孵育过夜,PBS清洗后,再用羊抗小鼠IgG-Alexa Fluor® 568多克隆抗体室温孵育2 h,DAPI复染后封片观察;流式细胞术检测方法:对细胞进行固定、通透后,采用小鼠抗人β3-Tubulin单克隆抗体(1:50稀释比例)孵育细胞,于室温条件下继续孵育30 min,PBS清洗后,再用羊抗小鼠IgG-FITC多克隆抗体室温孵育30 min,PBS清洗后上机检测。
1.7 统计学分析采用SPSS 17.0统计软件进行统计学分析。DPSCs-NPCs、DPSCs-vector-NPCs和DPSCs-SOX2-NPCs的PI及Nestin-PE、Pax6基因表达水平均以x±s表示,组间均数比较采用t检验。以α=0.05为检验水准。
2 结果 2.1 DPSCs的分离鉴定及SOX2过表达体系的构建DPSCs表达CD29、CD44和CD73等间充质细胞特异标记,具有正常的间充质细胞表型;而且DPSCs具有向成骨和成脂方向分化的潜能;与正常DPSCs比较,DPSCs-SOX2中SOX2的表达水平明显升高。
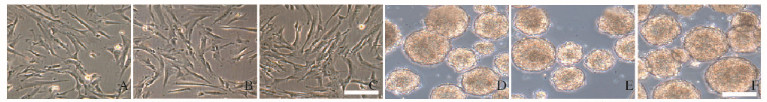
2.2 各组DPSCs向NPCs的分化和形态表现3组细胞均呈长梭形贴壁生长,未见明显区别。通过神经分化培养基的诱导,3种DPSCs均可被成功诱导为NPCs,即DPSCs-NPCs、DPSCs-vector-NPCs和DPSCs-SOX2-NPCs,3种NPCs均呈球形悬浮生长,形态表现未见明显区别。见图 1(插页二)。
|
| A-C: DPSCs; D-F:DPSCs derived DPPSCs; A, D: DPSCs group; B, E: DPSCs -vector group; C, F:DPSCs-SOX2 group. 图 1 各组DPSCs及其衍生NPCs的形态表观(bar=200 μm) Figure 1 Morphology of DPSCs and DPSCs derived NPCs in various groups (bar=200 μm) |
|
|
在接种后第1天,各组NPCs的增殖能力相近,未见明显区别;随着培养时间的延长(第2和3天),DPSCs-SOX2-NPCs组NPCs的PI高于DPSCs-NPCs和DPSCs-vector-NPCs组(P < 0.05)。见表 1。
| (n=5, x±s) | ||||
| Group | PI | |||
| (t/d) 0 | 1 | 2 | 3 | |
| DPSCs | 0.195±0.008 | 0.342±0.012 | 0.449±0.020 | 0.523±0.012 |
| DPSCs-vector | 0.193±0.013 | 0.353±0.005 | 0.439±0.009 | 0.510±0.005 |
| DPSCs-SOX2 | 0.201±0.007 | 0.361±0.014 | 0.495±0.010*△ | 0.567±0.007*△ |
| *P < 0.05 vs DPSCs group; △P < 0.05 DPSCs-vector group. | ||||
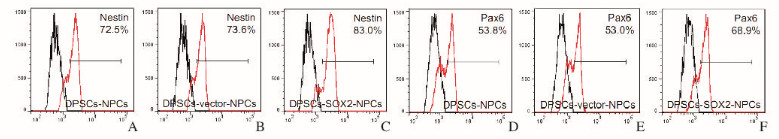
DPSCs和DPSCs-vector组中Nestin和Pax6基因的表达水平较为接近,并无明显区别,但DPSCs-SOX2组NPCs中Nestin和Pax6基因的表达水平明显高于DPSCs组和DPSCs-vector组(P < 0.05) (表 2)。流式细胞术检测:DPSCs-SOX2组NPCs中Nestin和Pax6基因的表达效率分别为83.0%和68.9%,明显高于DPSCs组(72.5%和53.8%)和DPSCs-vector组(73.6%和53.0%)。见图 2(插页二)。
|
| A-C: Nestin; D-F:Pax6; A, D: DPSCs group; B, E: DPSCs-vector group; C, F: DPSCs-SOX2 group. 图 2 流式细胞术检测各组NPCs中Nestin和Pax6基因的表达情况 Figure 2 Expressions of Nestin and Pax6 genes in NPCs in various groups detected by FACS |
|
|
| (n=5, x±s) | ||
| Group | Nestin | Pax6 |
| DPSCs | 1.00±0.01 | 1.00±0.05 |
| DPSCs-vector | 1.02±0.06 | 1.07±0.11 |
| DPSCs-SOX2 | 1.43±0.12*△ | 1.32±0.07*△ |
| *P < 0.05 vs DPSCs group; △P < 0.05 DPSCs-vector group. | ||
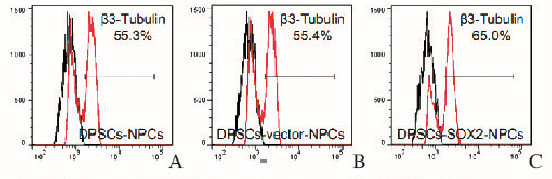
通过分化培养的诱导,3种NPCs均可分化形成β3-Tubulin阳性的神经元,免疫荧光检测可见典型的神经纤维样结构(图 3, 见插页二)。流式细胞术检测:DPSCs-SOX2组NPCs分化后的β3-Tubulin表达效率(65.0%)略高于DPSCs组(55.3%)和DPSCs-vector组(55.4%) (P < 0.05)。见图 4(插页二)。

|
| A: DPSCs group; B: DPSCs-vector group; C: DPSCs-SOX2 group. 图 3 NPCs分化神经元的形态表观(免疫荧光,bar=100 μm) Figure 3 Morphology of neuron differentiated from NPCs in various groups (Immunofluorescence, bar=100 μm) |
|
|
|
| A: DPSCs group; B: DPSCs-vector group; C: DPSCs-SOX2 group. 图 4 流式细胞术检测各组NPCs分化后β3-Tubulin的表达效率 Figure 4 Expression efficiency of β3-Tubulin after NPCs differentiation in various groups detected by FACS |
|
|
作为一种重要的转录因子,SOX2在神经分化方面的功能已在多个细胞模型中被证实,但是,该因子在DPSCs中的生物功能尚不明确,特别是SOX2是否可以促进DPSCs的神经分化潜能,目前尚未见相关的报道。本课题组的前期研究[15]结果表明:SOX2对DPSCs的增殖、迁移和黏附均有一定的促进作用。本课题组通过神经分化诱导的方法将DPSCs、DPSCs-vector和DPSCs-SOX2分别诱导为NPCs,并进一步将各组NPCs分化为神经元,对比分析SOX2对DPSCs神经分化的影响。本实验结果的整体趋势较为一致,在各种检测评价过程中,DPSCs组NPCs和DPSCs-vector组NPCs之间未见明显的区别,而DPSCs-SOX2组NPCs在细胞PI、NPCs表面特异标记表达以及向神经元分化方面均更具优势,由此体现了SOX2对DPSCs神经分化的促进作用。本研究结果显示:与DPSCs组和DPSCs-vector组比较,DPSCs-SOX2组NPCs中Nestin和Pax6基因的表达水平升高,即在DPSCs-SOX2组NPCs中具有NPCs特征的细胞纯度更高,这在很大程度上促进了DPSCs-SOX2组NPCs向神经元的分化效率,由此可见,SOX2对DPSCs-SOX2组NPCs向神经元分化效率的优化可能是一种间接的作用。在NPCs纯度相同的情况下,DPSCs-SOX2组NPCs是否仍具有更好的神经分化效率需要继续探索。此外,本研究仅对细胞的特异基因表达进行了初步评价,通过逆转录病毒感染的方法构建过表达SOX2的DPSCs (DPSCs-SOX2),各组NPCs分化的神经元在动作电位传导和神经损伤修复等方面是否具有差别仍需进一步分析。
| [1] | Lewis S. Stem cells:Sending cells back in time[J]. Nat Rev Neurosci, 2013, 14(2): 78. |
| [2] | Trounson A, Thakar RG, Lomax G, et al. Clinical trials for stem cell therapiesv[J]. BMC Med, 2011, 9: 52. DOI:10.1186/1741-7015-9-52 |
| [3] | Hendriks S, Dancet EAF, van Pelt AMM, et al. Artificial gametes:A systematic review of biological progress towards clinical application[J]. Hum Reprod Update, 2015, 21(3): 285–296. DOI:10.1093/humupd/dmv001 |
| [4] | Gronthos S, Mankani M, Brahim J, et al. Postnatal human dental pulp stem cells (dpscs) in vitro and in vivo[J]. PNAS, 2000, 97(25): 13625–13630. DOI:10.1073/pnas.240309797 |
| [5] | Tatullo M, Marrelli M, Shakesheff KM, et al. Dental pulp stem cells:Function, isolation and applications in regenerative medicine[J]. Tissue Engineering Regenerat Med, 2015, 9(11): 1205–1216. DOI:10.1002/term.v9.11 |
| [6] | Paino F, La Noce M, Tirino V, et al. Histone deacetylase inhibition with valproic acid downregulates osteocalcin gene expression in human dental pulp stem cells and osteoblasts:Evidence for hdac2 involvement[J]. Stem Cells, 2014, 32(1): 279–289. DOI:10.1002/stem.v32.1 |
| [7] | Chang CC, Chang KC, Tsai SJ, et al. Neurogenic differentiation of dental pulp stem cells to neuron-like cells in dopaminergic and motor neuronal inductive media[J]. Formosan Med Assoc, 2014, 113(12): 956–965. DOI:10.1016/j.jfma.2014.09.003 |
| [8] | Takahashi K, Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors[J]. Cell, 2006, 126(4): 663–676. DOI:10.1016/j.cell.2006.07.024 |
| [9] | Takahashi K, Tanabe K, Ohnuki M, et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors[J]. Cell, 2007, 131(5): 861–872. DOI:10.1016/j.cell.2007.11.019 |
| [10] | Cai J, Li W, Su H, et al. Generation of human induced pluripotent stem cells from umbilical cord matrix and amniotic membrane mesenchymal cells[J]. Biol Chem, 2010, 285(15): 11227–11234. DOI:10.1074/jbc.M109.086389 |
| [11] | Esteban MA, Wang T, Qin B, et al. Vitamin C enhances the generation of mouse and human induced pluripotent stem cells[J]. Cell Stem Cell, 2010, 6(1): 71–79. DOI:10.1016/j.stem.2009.12.001 |
| [12] | Tamaoki N, Takahashi K, Tanaka T, et al. Dental pulp cells for induced pluripotent stem cell banking[J]. J Dent Res, 2010, 89(8): 773–778. DOI:10.1177/0022034510366846 |
| [13] | Feng RP, Wen JH. Overview of the roles of sox2 in stem cell and development[J]. Biol Chem, 2015, 396(8): 883–891. |
| [14] | Thier M, Worsdorfer P, Lakes YB, et al. Direct conversion of fibroblasts into stably expandable neural stem cells[J]. Cell Stem Cell, 2012, 10(4): 473–479. DOI:10.1016/j.stem.2012.03.003 |
| [15] | Liu P, Cai J, Dong D, et al. Effects of sox2 on proliferation, migration and adhesion of human dental pulp stem cells[J]. PLoS One, 2015, 10(10): e0141346. DOI:10.1371/journal.pone.0141346 |
 2016, Vol. 42
2016, Vol. 42


