扩展功能
文章信息
- 辛桂杰, 朱海超, 李昊, 温剑平
- XIN Guijie, ZHU Haichao, LI Hao, WEN Jianping
- 最低限度免疫定义基因表达的HCV多表位DNA疫苗对小鼠细胞免疫的诱导作用
- Induction of cellular immunity by HCV multi-epitope DNA vaccine prepared with minimalistic immunologically defined gene expression method in mice
- 吉林大学学报(医学版), 2016, 42(06): 1071-1075
- Journal of Jilin University (Medicine Edition), 2016, 42(06): 1071-1075
- 10.13481/j.1671-587x.20160606
-
文章历史
- 收稿日期: 2016-05-09
2. 吉林大学基础医学院法医学系, 吉林 长春 130021;
3. 吉林大学基础医学院遗传学系, 吉林 长春 130021
2. Department of Forensic, School of Basic Medical Sciences, Jilin University, Changchun 130021, China;
3. Department of Genetic, School of Basic Medical Sciences, Jilin University, Changchun 130021, China
质粒载体和病毒载体在应用于基因治疗、DNA疫苗等领域时,因其含有大量人体所不需要基因,如抗生素抗性基因和病毒蛋白基因,可产生不必要的蛋白或免疫负面作用[1-2]。一些载体整合到宿主基因组中还具有潜在的激活原癌基因的危险[3]。最低限度免疫定义基因表达(minimalistic immunologically defined gene expression, MIDGE)技术是主要致力于DNA分子药物研究的德国MOLOGEN公司的两大核心专利之一,其基本理念是只采用真核启动子和mRNA稳定序列等少数几个真核表达必需原件来表达目的基因,从而克服了质粒及病毒载体的上述缺陷[4-7]。丙型肝炎病毒(hepatitis C virus, HCV)为单股正链RNA病毒,基因全长9 600 bp。经宿主及病毒的信号肽酶剪切为3个结构蛋白(即核心蛋白、E1和E2)和7个非结构蛋白(即NS1、NS2、NS3、NS4A、NS5A和NS5B)。其中,编码核心蛋白的基因在HCV基因组中较保守。在非结构蛋白质中,NS5B序列高度保守。目前我国HCV基因分型以1b和2a型多见,以1b型为主, 1b型对干扰素联合利巴韦林的应答率较低[8]。因此,本研究所设计的表位主要针对1b型HCV较保守的核心区和高度保守的NS5B区。
本课题组制备了含有巨细胞病毒(cytomegalovirus, CMV)快速早期启动子、HCV多表位和牛生长激素(bovine growth hormone, BGH)多聚腺苷酸序列的DNA疫苗,观察其体外转染情况及小鼠免疫效果。
1 材料与方法 1.1 实验动物、主要试剂和仪器6~8周龄雄性ICR小鼠12只,体质量22~25g,由吉林大学基础医学院动物室提供,动物合格证号:吉SCXK2003-0001。PCR产物纯化试剂盒购自上海超研生物科技有限公司,荧光定量检测试剂盒购自杭州博日科技有限公司,小鼠干扰素γ(interferon-γ, IFN-γ) ELISA kit试剂盒购自美国IBL公司。JY600E型电泳仪购自北京君意东方电泳设备有限公司,荧光PCR仪FQD48a购自杭州博日科技有限公司。
1.2 HCV T细胞表位选取和人工合成HCV核心蛋白和NS5B的编码基因分别位于HCV基因组的342-914nt区段和7602-9371nt区段。通过免疫表位数据库和分析资源(IMMUNE EPITOPE DATEBASE AND ANALYSIS RESOURCE, 网址:www.iedb.org)确定T表位, 选取4个表位,在HCV蛋白中的氨基酸序号分别为aa35-44、aa129-137、aa177-185及aa2843-2851。这些表位是该网站提供的已被证实的有效表位。将选取的4个表位重复串联为HCV多表位串联序列并委托苏州金唯智公司合成如下DNA串联序列,依次为kozak序列、起始密码、HCV多表位串联序列、CpG免疫刺激序列、Myc标签序列和终止密码,同时合成带有EcoRⅠ及HindⅢ酶切位点的引物用于亚克隆,PCR产物长度为414 bp。引物命名为Primer1,引物序列见表 1。委托苏州金唯智公司合成基因及引物,用该引物行PCR鉴定。
| Primer | Sequence of primer (5′-3′) | Size of PCR product (bp) |
| Primer 1 | GCACAAGCTTGCCACCATGCT GGGCAAGTGGAATTCTTAT TACTTGTTGTGGGCGG |
414 |
| Primer 2s | GTTCCCATAGTAACGCCAATA GGAAGAAAGCGAAAGGAGC |
1 346 |
| Primer 2c | GTTCCCATAGTAACGCCAATA GGAAAGGACAGTGGGAGTG |
1 346 |
| β-actin | GATCATGTTTGAGACCTT TGTAGCCACGCTCGGTCAG |
233 |
| IFN-γ | CAAGGATGGTGACATGAA GTGATTCAATGACGCTTAT |
118 |
将上述PCR产物用EcoRⅠ及HindⅢ酶切,同时酶切pcDNA3.1+质粒载体,连接并转化DH5α大肠杆菌,制备含有HCV多表位串联序列的重组质粒,命名为HCV-pcDNA3.1。pcDNA3.1上的CMV启动子基因位于232-819 nt,长度为587 bp。BGH多聚腺苷酸序列为基因位于1028-1252nt, 长度为224 bp。以HCV-pcDNA3.1为模板设计5′端双碱基硫代修饰引物,扩增含有CMV启动子、HCV多表位串联序列和BCG多聚腺苷酸序列。引物命名为Primer 2s, PCR产物长度为1 364 bp,即为本研究所用的MIDGE HCV多表位DNA疫苗,命名为M-HCV-epi。大量制备该PCR产物,并用PCR产物纯化试剂盒纯化,紫外分光光度计测定DNA含量。设计对照DNA片段的5′端双碱基硫代修饰引物,命名为Primer2c, 序列见表 1。以pcDNA3.1为模板,制备相同长度的PCR产物DNA片段作为阴性对照,命名为V-pcDNA3.1(图 2)。
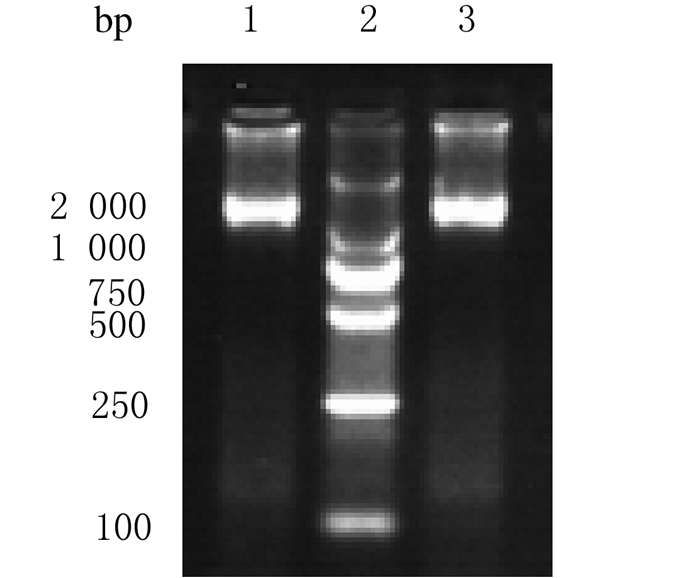
|
| Lane 1: PCR product of MIDGE HCV multi-epitope DNA vaccine; Lane 2: DNA marker DL 2 000;Lane 3:PCR product of control DNA fragment. 图 2 MIDGE HCV多表位DNA疫苗和对照DNA片段电泳图 Figure 2 Electrophoregram of MIDGE HCV multi-epitope DNA vaccine and control DNA fragment |
|
|
12只ICR小鼠随机分为2组,每组6只。实验组小鼠给予M-HCV-epi,每只20 μg;对照组小鼠给予V-pcDNA3.1,每只20 μg。采用LipofectamineTM 2000为佐剂,以PBS稀释25倍,放置5 min后加入DNA,比例为1 μg DNA加入2 μL LipofectamineTM 2000稀释液。室温下静置20 min后,采用PBS调终体积,使DNA浓度为40 mg·L-1。在实验组和对照组小鼠背部皮下多点注射,每只注射500 μL,之后每2周注射1次,共免疫3次。
1.5 QRT-PCR法检测免疫小鼠脾细胞中IFN-γ mRNA表达水平于最后一次免疫7 d后处死小鼠,制备小鼠脾细胞。提取细胞总RNA, 逆转录,以小鼠β-actin为内参对照,IFN-γ特异性引物行QPCR,采用2-ΔΔCt法计算IFN-γmRNA表达水平。引物序列见表 1。采用公式计算ΔΔCt值,ΔΔCt=(实验组目的基因Ct值-实验组内参基因Ct值)-(对照组目的基因Ct值-对照组内参基因Ct值),2-ΔΔCt值即实验组相对于对照组ΔΔCt值的倍数,代表IFN-γmRNA表达水平。
1.6 HCV表位多肽的合成在M-HCV-epi DNA疫苗中有4个表位多肽,选取其中3个表位,委托上海闪晶分子生物科技公司合成3个表位多肽aa35-44(YLLPRRGPRL)、aa129-137(GFADLMGYI)、aa177-185(FLLALLSCL)和阴性对照多肽HIV gp41 aa770-780(RLRDLLLIVTR),用于免疫小鼠的脾细胞刺激实验。
1.7 夹心ELISA法检测小鼠脾细胞培养上清中IFN-γ水平于最后一次免疫7d后处死小鼠,制备小鼠脾细胞。以5×106 mL-1加入96孔板,每孔100 μL。实验组小鼠脾细胞分别加入合成的表位多肽aa35-44、aa129-137和aa177-185,并设立阴性对照多肽组,每孔10 μL,终浓度为50 mg·L-1;阳性对照多肽组小鼠脾细胞加入的合成多肽同实验组。各组每只小鼠设3复孔。CO2孵箱培养24 h后,采用ELISA试剂盒检测小鼠脾细胞培养上清中IFN-γ水平。
1.8 统计学分析采用SPSS 11.5统计软件对数据进行统计学分析。小鼠脾细胞中IFN-γmRNA和培养上清中IFN-γ水平以x±s表示,组间比较均采用t检验。以α=0.05为检验水准。
2 结果 2.1 人工合成基因片段和MIDGE HCV多表位DNA疫苗PCR电泳鉴定人工合成基因片段PCR产物长度约为414 bp,MIDGE HCV多表位DNA疫苗和对照DNA片段的PCR产物长度为1 346 bp。见图 1和2。
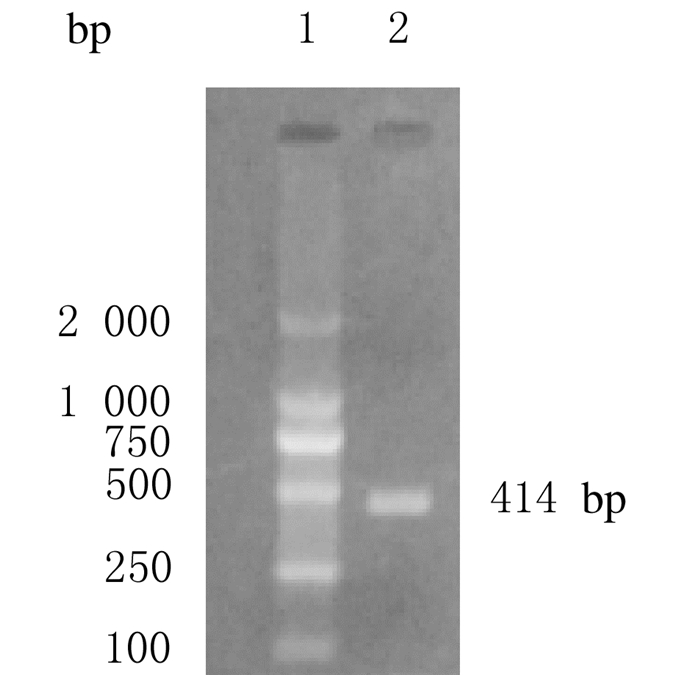
|
| Lane 1:DNA marker DL 2000; Lane 2: PCR product of synthetic DNA fragment. 图 1 人工合成DNA片段PCR产物电泳图 Figure 1 Electrophoregram of PCR products of synthetic DNAfragment |
|
|
与对照组比较,实验组小鼠脾细胞中IFN-γ mRNA表达水平升高(1.50±0.18)倍(P<0.05)。
2.3 小鼠脾细胞培养上清中IFN-γ水平加入aa35-44多肽的实验组小鼠脾细胞培养上清中IFN-γ水平明显高于阴性对照多肽组(P<0.05),加入aa129-137和aa177-185多肽的实验组小鼠脾细胞培养上清中IFN-γ水平与阴性对照多肽组比较差异无统计学意义(P<0.05)。见表 2。
| [n=6, x±s, ρB/(ng·L-1)] | ||||
| Group | Expression level of IFN-γ | |||
| aa35-44 | aa129-137 | aa177-185 | Control peptide | |
| M-HCV-epi | 198.43±20.12* | 154.58±11.41 | 172.23±18.98 | 152.66±12.85 |
| V-pcDNA3.1 | 144.09±18.22 | 135.46±13.79 | 148.47±17.63 | 138.72±10.36 |
| *P < 0.05 compared with V-pcDNA3.1 group. | ||||
MIDGE法由于只带有目的基因的真核表达元件而不含原核复制和筛选元件, 因此具有自身独特的优势。一方面可避免表达大量不必要的蛋白,规避了这些蛋白带来的免疫应答反应;另一方面,由于DNA片段长度较小从而减少了产生抗DNA抗体的概率,进而利于DNA疫苗在体内的长期表达[9]。因此该项技术在基因治疗领域和DNA疫苗领域具有广泛的应用前景。2006年德国柏林生物科技公司MOLOGEN的MIDGE技术获得了世界著名咨询调查公司弗若斯特沙利文公司颁发的“Frost & Sullivan”技术创新奖,以表彰该项技术对基因治疗领域的贡献。
MIDGE一般包含启动子、目的基因和RNA稳定序列的线性分子,两侧带有人工合成的可形成短发夹结构的单链寡核苷酸序列。其中,可形成短发夹结构的单链寡核苷酸可自身退火,在线性双链DNA的两个末端形成闭合的发夹结构,其目的是防止DNA片段进入胞质内吞小泡及溶酶体后被DNA酶系降解。
在双链DNA两侧添加可形成短发夹结构的单链寡核苷酸具有自身的缺陷。首先制备方法成本高。在双链DNA的每个单链的5′端添加20多个核苷酸的单链无法用PCR法实现,只能人工合成导致成本很高。其次,末端可形成发夹结构的单链除自身退火形成发夹结构外,这些DNA片段彼此之间的单链也可以退火,形成交联形式,失去了对溶酶体内DNA酶降解作用的抵抗作用。
本研究采用MIDGE法表达HCV表位疫苗,并对该方法进行了适当改进。即不采用MIDGE法双链线性DNA末端的发卡结构,而采用硫代修饰引物5′端的方法抵抗DNA片段的细胞内降解。细胞免疫在抗病毒免疫方面起主要作用,IFN-γ水平是反映细胞免疫的重要指标。本研究结果表明:应用MIDGE法制备的HCV多表位DNA疫苗可以升高免疫小鼠脾细胞中IFN-γmRNA表达水平;免疫小鼠的脾细胞在特异性表位多肽的刺激下,其IFN-γ分泌水平升高。本文作者选取了3个特异性的表位多肽用于刺激MIDGE HCV多表位DNA疫苗免疫的小鼠脾细胞,其中只有1个多肽aa35-44具有促进小鼠脾细胞分泌IFN-γ的效果,具体原因有待进一步分析。
MIDGE技术自问世以来,多应用于基因治疗领域[10-14],目前在DNA疫苗领域的研究较少。本研究结果提示:MIDGE技术在DNA疫苗领域具有潜在应用价值,值得深入研究。
| [1] | Ward P, Walsh CE. Current and future prospects for hemophilia gene therapy[J]. Expert Rev Hematol, 2016, 4(6): 335–341. |
| [2] | Perez Ruiz, Garibay A. Endocytosis in gene therapy with non-viral vectors[J]. Wien Med Wochenschr, 2016, 2(3): 556–562. |
| [3] | Pergament E. The promise of gene therapy[J]. Curr Opin Obstet Gynecol, 2016, 28(2): 132–135. DOI:10.1097/GCO.0000000000000255 |
| [4] | Machelska H, Schroff M, Oswald D, et al. Peripheral non-viral MIDGE vector-driven delivery of β-endorphin in inflammatory pain[J]. Mol Pain, 2009, 5(6): 72–85. |
| [5] | López-Fuertes L, Pérez-Jiménez E, Vila-Coro AJ, et al. DNA vaccination with linear minimalistic (MIDGE) vectors confers protection against Leishmania major infection in mice[J]. Vaccine, 2002, 21(4): 247–257. |
| [6] | Zheng C, Juhls C, Oswald D, et al. Effect of different nuclear localization sequences on theimmune responses induced by a MIDGE vector encoding bovine herpesvirus-1 glycoprotein D[J]. Vaccine, 2006, 24(21): 4625–4629. DOI:10.1016/j.vaccine.2005.08.046 |
| [7] | Chen ZY, He CY, Ehrhardt A, et al. Minicircle DNA vectors devoid of bacterial DNA result in persistent and high-level transgene expression in vivo[J]. Mol Ther, 2004, 8(3): 495–500. |
| [8] | Wei L, Han T, Yang D, et al. Simeprevir plus peginterferon/ribavirin for HCV genotype 1-infected treatment-naïve patients in China and South Korea[J]. J Gastroenterol Hepatol, 2016, 31(5): 912–920. DOI:10.1111/jgh.2016.31.issue-5 |
| [9] | Christiane L, Schnabel P, Steinig M, et al. Immune response of healthy horses to DNA constructs formulated with a cationic lipid transfection reagent[J]. BMC Vet Res, 2015, 11(10): 140–144. |
| [10] | Agarwal A, Ingham SA, Harkins KA. The role of pharmacogenetics and advances in gene therapy in the treatment of diabetic retinopathy[J]. Pharmacogenomics, 2016, 17(3): 309–320. DOI:10.2217/pgs.15.173 |
| [11] | Pahle J, Walther W. Vectors and strategies for nonviral cancer gene therapy[J]. Expert Opin Biol Ther, 2016, 16(4): 443–461. DOI:10.1517/14712598.2016.1134480 |
| [12] | Campbell JP, McFarland TJ, Stout JT. Ocular gene therapy[J]. Dev Ophthalmol, 2016, 55(3): 317–321. |
| [13] | 韩笑, 麻树人, 王大全, 等. 早期骨癌外周血细胞免疫功能状况变化研究[J]. 中国实用内科杂志, 2015, 35(9): 759–761. |
| [14] | 李修明. 基于DC-CIK细胞免疫治疗联合化疗治疗晚期消化道肿瘤的临床疗效分析[J]. 中国实用内科杂志, 2015, 35(增1): 119–121. |
 2016, Vol. 42
2016, Vol. 42


