扩展功能
文章信息
- 费倩怡, 刘书会, 朱振威, 邹永巍, 郑明, 刘春丽, 刘志辉
- FEI Qianyi, LIU Shuhui, ZHU Zhenwei, ZOU Yongwei, ZHENG Ming, LIU Chunli, LIU Zhihui
- 转染leptin的胎盘间充质干细胞对放射损伤复合创伤愈合的促进作用
- Promotive effect of HPMSCs transfected with leptin on healing of combined radiation-wound injury
- 吉林大学学报(医学版), 2016, 42(06): 1066-1070
- Journal of Jilin University (Medicine Edition), 2016, 42(06): 1066-1070
- 10.13481/j.1671-587x.20160605
-
文章历史
- 收稿日期: 2014-10-14
2. 吉林省长春市口腔医院, 吉林 长春 130022;
3. 吉林大学口腔医院口腔修复科, 吉林 长春 130021
2. Changchun Stomatology Hospital, Jilin Province, Changchun 130022, China;
3. Department of Prosthodontics, Stomatology Hospital, Jilin University, Changchun 130021, China
近年来,由于各种因素导致口腔颌面部恶性肿瘤的发病率呈逐年上升趋势,对于恶性肿瘤术后所造成的组织缺损,临床上往往采用皮肤移植的方法加以整复,术后相继进行化学药物治疗或放射治疗,这样不仅引起皮肤组织的严重损害,同时使皮瓣或皮片愈合过程延迟甚至导致皮瓣坏死,这就是一种典型的放射损伤复合创伤(放创复合伤),也是目前较难治愈的难愈性创伤之一。人胎盘间充质干细胞(human placenta-derived mesenchymal stem cells, HPMSCs)是来源于胎盘实质组织的一类具有自我更新能力的间充质细胞[1],作为一种新的干细胞来源近年来逐渐受到人们的关注。研究[2-3]表明:HPMSCs在创伤修复领域具有重要的应用价值,但是将其应用于放创复合伤从而促进其愈合目前国内外尚未见相关报道。瘦素(leptin)亦称为消脂素,是一种白色脂肪组织特异性分泌的蛋白活性因子[4],能够促进上皮再生和新生血管形成,在创伤愈合的过程中发挥重要作用。但由于其半衰期只有(9.4±3.0) min,因此单纯局部应用leptin很难发挥其长效作用。本研究将转染leptin的HPMSCs通过局部注射移植至背部放创复合伤模型Wistar大鼠,探讨leptin和HPMSCs可否协同促进放疗后皮瓣成活率的升高,为临床放创复合伤的治疗奠定实验基础。
1 材料与方法 1.1 实验动物、细胞和主要试剂Wistar大鼠30只,雄性, 体质量(200±20) g,由吉林大学实验动物中心提供,许可证号:SCXK (吉)20130001。HPMSCs和转染leptin的HPMSCs为本实验组前期实验保存。兔抗大鼠leptin多克隆抗体和羊抗大鼠血管性血友病因子(vWF)多克隆抗体(北京博奥森生物技术有限公司),PV-9001免疫组织化学检测试剂盒(中杉金桥有限公司)。
1.2 动物模型的建立、分组和细胞移植大鼠麻醉生效后俯卧位固定于手术台上,硫化钠脱毛剂去除背部毛发,常规消毒,用龙胆紫于大鼠背部设计3 cm×5 cm大小矩形皮瓣,切开至肌筋膜上方,锐性分离皮下筋膜层,原位缝合。术后第1天采用电子线对大鼠进行局部照射,总剂量为5 Gy。将上述大鼠随机分成转染leptin的HPMSCs组、转染空载体的HPMSCs组和空白对照组,每组10只。放疗后24 h,于皮瓣筋膜层5个位点分别注射转染leptin的HPMSCs、转染空载体的HPMSCs和同等剂量的生理盐水,细胞总量为2×106个,体积为0.3 mL。
1.3 各组大鼠术后大体形态表现观察术后每天观察实验动物精神状态及是否出现弓背、腹泻和皮肤溃疡等表现;观察皮瓣颜色、皮纹、质地、温度、毛发生长、渗出、坏死范围及针刺出血情况。
1.4 各组大鼠皮瓣成活率测定皮瓣坏死标准:皮瓣的颜色呈黑色,质地坚硬。给药后第7天,采用数码照相机拍摄大鼠背部皮瓣,图像输入计算机,应用Image-Pro Plus5.1图像分析系统计算出皮瓣的成活率,皮瓣的成活率=(皮瓣总面积-皮瓣坏死面积)/皮瓣总面积×100%。
1.5 HE染色观察放疗后各组大鼠皮瓣组织形态表现给药后第14天取大鼠皮瓣远蒂端坏死组织和正常组织交界处正常组织的皮瓣全层,常规脱水包埋、切片,HE染色,光镜下观察组织形态表现。
1.6 SP免疫组织化学染色观察大鼠皮瓣组织中Leptin和vWF的表达给药后第14天取大鼠皮瓣远蒂端坏死组织和正常组织交界处的正常组织的皮瓣全层,常规脱水包埋、切片,采用SP免疫组织化学染色法对组织切片进行染色,观察皮瓣中leptin和内皮细胞特异性vWF的表达情况。
1.7 统计学分析采用SPSS16.0统计软件进行统计学分析。各组大鼠皮瓣的成活率以x±s表示,多组间样本均数比较采用单因素方差分析。以α=0.05为检验水准。
2 结果 2.1 各组大鼠术后大体形态表现实验过程中,各组大鼠均未出现死亡和感染症状,所有实验动物无腹泻、弓背、翘毛及精神萎靡等表现。给药后第7天,各组大鼠皮瓣成活与坏死界限基本清楚,坏死区域面积基本稳定,坏死区域皮瓣质地坚硬,成活区域皮瓣颜色红润,皮纹模糊,质地中等。转染leptin的HPMSCs组和转染空载体的HPMSCs组大鼠皮瓣坏死面积均小于空白对照组。见图 1(插页一)。至给药后第14天,皮瓣成活面积的观察结果与给药后第7天无明显差异。

|
| 图 1 细胞移植后第7天各组大鼠放疗后皮瓣的坏死面积 Figure 1 Necrosis area of flap of rats in various groups after radiotherapy at 7 d after cell transplantation |
|
|
与空白对照组(55.40%±4.34%)比较,转染leptin的HPMSCs组(93.60%±9.36%)和转染空载体HPMSCs组(70.70%±6.28%)大鼠皮瓣成活率均升高(P<0.05),转染leptin的HPMSCs组大鼠皮瓣成活率明显高于转染空载体的HPMSCs组(P<0.05)。
2.3 放疗后各组大鼠皮瓣组织的形态表现转染leptin的HPMSCs组大鼠皮瓣远蒂端坏死组织和正常组织交界处的正常组织的皮瓣全层中肉芽组织最为丰富,可见大量的新生毛细血管和成纤维细胞,血管周围炎细胞浸润较少。转染空载体的HPMSCs组大鼠肉芽组织较为丰富,可见较多的新生毛细血管和成纤维细胞,血管周围炎细胞浸润较多。空白对照组大鼠新生肉芽组织较少,新生血管较少,细胞成分少见,可见大量炎细胞浸润和纤维结缔组织发生玻璃样变。见图 2(插页一)。
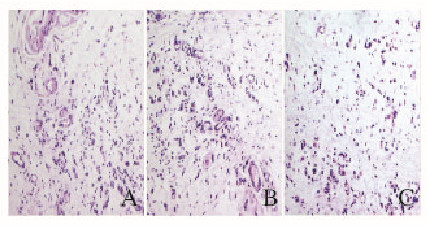
|
| A:HPMSCs transfected with leptin group; B:HPMSCs group; C:Control group. 图 2 各组大鼠皮瓣组织的形态表现 Figure 2 Morphology of flap tissue of rats in various groups |
|
|
给药后14天,采用vWF多克隆抗体进行免疫组织化学染色的结果显示:转染leptin的HPMSCs组和转染空载体HPMSCs组大鼠皮瓣真皮下方可见大量的黄染颗粒,说明转染leptin的HPMSCs组和转染空载体的HPMSCs组大鼠皮瓣真皮下方有大量内皮细胞及新生血管;而空白对照组中黄染颗粒细胞少见,说明新生血管不活跃,见图 3(插页一)。术后第14天,采用leptin多克隆抗体进行免疫组化染色的结果显示:转染leptin的HPMSCs组大鼠胞浆中着染棕黄色-黄色呈阳性表达的leptin细胞最多。见图 4(插页一)。
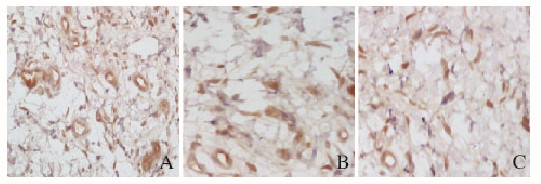
|
| A:HPMSCs transfected with leptin group; B:HPMSCs group; C:Control group. 图 3 免疫组织化学法检测放疗后各组大鼠皮瓣组织中vWF因子表达 Figure 3 Expressions of vWF in flap tissue of rats in various groups after radiotheraphy detected by immunohistochemical method |
|
|
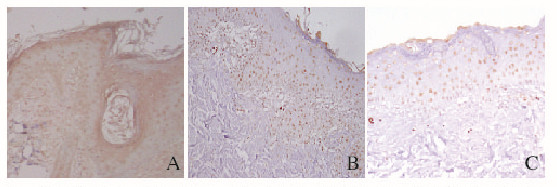
|
| A:HPMSCs transfected with leptin group; B:HPMSCs group; C:Control group. 图 4 免疫组织化学法检测放疗后大鼠各组皮瓣组织中leptin表达 Figure 4 Expressions of leptin in flap tissue of rats in various groups after radiotheraphy detected by immunohistochemical method |
|
|
间充质干细胞(mesenchymal stem cells, MSCs)属于未分化的前体干细胞,其表型分化尚不成熟,具有与角膜移植类似的免疫豁免特性,主要表现为免疫原性低和免疫耐受特性[5]。研究[6]表明:MSCs同种异体或异种异体移植后无免疫排斥反应。无论采用何种方式进行细胞移植,例如静脉注射、皮下注射和复合骨诱导等[7-8],MSCs的这种特性均不会受到影响。研究者[9]将HPMSCs经尾静脉注射入正常大鼠体内1个月后发现:标记PKH26的HPMSCs分布于大鼠的肺脏、肝脏和肾脏等组织,组织学观察显示大鼠脑、肾脏、膀胱和肝脏等脏器未见明显的纤维组织增生和淋巴细胞浸润现象,表明HPMSCs的移植未对大鼠的相关脏器产生免疫排斥反应。本实验将培养的第5代HPMSCs及转染leptin的HPMSCs用于动物实验,在整个动物实验过程中大鼠均未出现腹泻、弓背、精神萎靡、翘毛和皮肤溃疡等移植物抗宿主病表现,说明HPMSCs具有低免疫原性的特性以及免疫抑制效应,跨物种应用不会引起免疫排斥反应。
近年来,口腔颌面部恶性肿瘤的发病率呈逐年上升趋势,目前颌面部恶性肿瘤的临床治疗多采用皮肤移植的方法整复恶性肿瘤切除后所造成的组织缺损,术后相继进行放化疗,这样不仅可引起皮肤组织的严重损害,同时会使皮瓣或皮片愈合过程延迟,甚至导致皮瓣坏死,是一种典型的放创复合伤,也是目前较难治愈的难愈性创伤之一。因此,如何促进放创复合伤难愈性创面愈合是创伤医学修复领域亟待解决的问题。目前促进难愈性创面愈合的主要措施有药物促愈、生物敷料覆盖、细胞因子局部应用和皮肤移植等,但已有的措施及方法在应用上存在一定的局限性,如手术植皮中皮瓣的成活率难以保证,细胞因子局部应用时其疗效受到药物半衰期短的影响。因此,这就迫切要求人们为促进放创复合难愈性创面愈合开辟新的治疗途径。
国内外研究学者[10-11]发现:电离辐射之所以延缓创口愈合,其主要原因是创口局部造血细胞和创伤修复细胞的细胞数量与功能的损害;而MSCs在局部微环境的刺激下,可以向创口局部趋化,并诱导MSCs向所需的细胞或组织分化,从而弥补其修复细胞的不足,促进创伤组织修复。MSCs能够向多种细胞分化,但目前MSCs分化为其他不同类型细胞的机制尚不明确。研究者[12]认为:MSCs的分化与微环境“壁龛(niche)”密切相关,其分化方向主要受微环境调控。有学者[13]将HPMSCs移植至糖尿病小鼠皮肤缺损模型的缺损部位周围后观察到HPMSCs对创面的愈合及上皮的形成具有明显的促进作用,免疫组织化学结果显示:上皮内角化细胞特异性蛋白和细胞角蛋白的阳性表达率较高,说明MSCs可以分化为皮肤的上皮细胞。Mahmood等[14]将标记5-BrdU的MSCs经尾静脉注射入大鼠创伤性脑损伤模型体内,发现标记5-BrdU的MSCs可以扩充归巢到损伤脑组织周围,而且还可以向远处迁移,表明在体内一定条件下MSCs可以分化为星形胶质细胞和神经元。另外,研究[15]显示:将MSCs注射到心肌梗死模型大鼠体内以后,创伤区域毛细血管的密度大幅增加,同时心脏的收缩力也有所增强,表明MSCs可以分化为血管内皮细胞,促进新生血管的形成。
本研究将HPMSCs应用于放疗后随意性皮瓣中,通过临床观察、组织病理学及免疫组织化学方法观察放疗后皮瓣远端的血管新生情况和微血管密度,以确定HPMSCs提高放疗后皮瓣成活率的有效性。本研究结果显示:给药后第7天,皮瓣坏死区域与成活区域界限基本清楚,转染空载体的HPMSCs组皮瓣成活率高于空白对照组。光镜下观察发现转染空载体的HPMSCs组肉芽组织较为丰富,可见较多的新生毛细血管及成纤维细胞,血管周围炎细胞浸润较多。免疫组织化学检测微血管密度的结果显示:转染空载体的HPMSCs组新生血管密度高于空白对照组。上述实验结果表明:放疗后局部应用HPMSCs能够有效提高皮瓣成活率,促进放创复合伤的愈合。本实验将HPMSCs直接注射到创面局部,可见大量的新生血管和成纤维细胞,说明应用于放创复合伤的HPMSCs可以分化为成纤维细胞和血管内皮细胞,促进放疗后皮瓣血运循环和组织修复。
研究[15-17]表明:leptin和HPMSCs能够促进皮肤创伤的愈合,对皮肤创伤愈合的有效性较为明确。但是关于HPMSCs在放创复合伤修复过程中是否能发挥重要作用尚不明确。HPMSCs能否作为leptin的载体细胞将携带的leptin运送至放创复合伤局部,与leptin协同作用,共同发挥促愈作用,目前国内外尚无相关报道。leptin是近年来发现的很活跃的创伤修复细胞因子,在创伤修复过程中发挥不可替代的作用,MSCs在创伤修复的全过程中也发挥重要作用。本实验将转染leptin的HPMSCs应用于放疗后动物模型的皮瓣中,探讨二者对放创复合伤的协同促愈作用。
本研究将转染leptin的HPMSCs局部注射于放疗后皮瓣的局部,免疫组织化学法检测可见转染leptin的HPMSCs组和转染空载体的HPMSCs组皮瓣筋膜层有大量棕黄色颗粒,说明皮瓣筋膜层形成大量新生血管及内皮细胞,但转染leptin的HPMSCs组棕黄色颗粒数量多于转染空载体的HPMSCs组,说明leptin与HPMSCs联合应用促进新血管形成作用大于单纯HPMSCs的作用;免疫组织化学检测结果显示:转染leptin的HPMSCs组和转染空载体的HPMSCs组皮瓣上皮内角化细胞和血管内皮细胞可见大量棕黄色颗粒,转染leptin的HPMSCs组棕黄色颗粒数量多于转染空载体的HPMSCs组,说明leptin同时还可以促进上皮再生及血管生成,与HPMSCs有协同促进作用。
| [1] | Abumaree MH, Al Jumah MA, Kalionis B, et al. Phenotypic and functional characterization of mesenchymal sten cells from chorionic villi of human term placenta[J]. Stem Cell Rev, 2012, 9(1): 16–31. |
| [2] | Banerjee A, Nürnberger S, Hennerbichler S, et al. In toto differentiation of human amniotic membrane towards the Schwann cell lineage[J]. Cell Tissue Bank, 2014, 15(2): 227–239. DOI:10.1007/s10561-013-9401-1 |
| [3] | Lee Y, Junq J, Cho KJ, et al. Increased SCF/c-kit by hypoxia promotes autophagy of human placental chorionic plate-derived mesenchymal stem cells via regulating the phosphorylation of mTOR[J]. J Cell Biochem, 2013, 114(1): 79–88. DOI:10.1002/jcb.v114.1 |
| [4] | Zhang Y, Proenca R, Maffei M, et al. Positional cloning of the mouse obese gene and its human homologue[J]. Nature, 1994, 372(6605): 425–432. |
| [5] | Schu S, Nosov M, O'Flynn L, et al. Immunogenicity of allogeneic mesenchymal stem cells[J]. J Cell Mol Med, 2012, 16(9): 2094–2103. DOI:10.1111/jcmm.2012.16.issue-9 |
| [6] | Lee H, Lim S, Chung I, et al. Preclinical efficacy and mechanisms of mesenchymal stem cells in animal models of autoimmune diseases[J]. Immune Netw, 2014, 14(2): 81–88. DOI:10.4110/in.2014.14.2.81 |
| [7] | Linares GR, Chiu CT, Scheuing L, et al. Preconditioning mesenchymal stem cells with the mood stabilizers lithium and valproic acid enhances therapeutic efficacy in a mouse model of huntington's disease[J]. Exp Neutol, 2016, 281(4): 81–92. |
| [8] | Wang Y, Li YG, Song L, et al. The transplantation of Akt-overexpressing amniotic fluid-derived mesenchymal stem cells protects the heart against ischemia-reperfusion injury in rabbits[J]. Mol Med Rep, 2016, 14(1): 234–242. |
| [9] | Bailo M, Soncini M, Vertua E, et al. Engraftment potential of human amnion and chorion cells derived from term placenta[J]. Transplantation, 2004, 78(10): 1439–1448. DOI:10.1097/01.TP.0000144606.84234.49 |
| [10] | 史春梦, 程天民. 放射损伤对创面愈合的影响[J]. 国外医学:放射医学核医学分册, 2005, 29(1): 30–32. |
| [11] | Stavely R, Robinson AM, Miller S, et al. Allogeneic guinea pig mesenchymal stem cells ameliorate neurological changes in experimental colitis[J]. Srem Cell Res Ther, 2015, 6: 263. DOI:10.1186/s13287-015-0254-3 |
| [12] | Spradling A, Drummodn Barrosa D, Kai T. Stem cells find their niche[J]. Nature, 2001, 414(6859): 98–104. DOI:10.1038/35102160 |
| [13] | Kim SW, Zhang HZ, Kim CK, et al. Amniotic mesenchymal stem cells with robust chemotactic properties are effective in the treatment of a myocardial infarction model[J]. Int J Cardiol, 2013, 168(2): 1062–9. DOI:10.1016/j.ijcard.2012.11.003 |
| [14] | Mahmood A, Lu D, Wang L, et al. Intracerebral transplantation of marrow stromal cells cultured with neurotrophic factors promotes functional recovery in adult rats subjected to traumatic brain injury[J]. Neurotrauma, 2002, 19(12): 1609–1617. DOI:10.1089/089771502762300265 |
| [15] | Tang YL, Zhao Q, Qin X, et al. Paracrine action enhances the effects of autologous mesenchymal stem cell transplantation on vascular regeneration in rat model of myocardial infarction[J]. Ann Thorac Surg, 2005, 80(1): 229–236. DOI:10.1016/j.athoracsur.2005.02.072 |
| [16] | 何珊, 赵俪月, 巴晓晔, 等. 苯妥英钠对人鼠骨髓间充质干细胞与血管内皮细胞VEGF和SCF分泌的影响[J]. 西安交通大学学报:医学版, 2016, 37(2): 204–208. |
| [17] | 王皓, 李湛, 郜玉忠. 突变型低氨诱导因子1α加速骨缺损部位新血管生成的实验观察[J]. 西安交通大学学报:医学版, 2015, 36(4): 455–461. |
 2016, Vol. 42
2016, Vol. 42


