扩展功能
文章信息
- 包书茵, 韩淑英, 王胡格吉乐图, 包文山, 奥·乌力吉
- BAO Shuyin, HAN Shuying, WANG Hugejiletu, BAO Wenshan, AO Wuliji
- 沙蓬粗寡糖对糖尿病GK大鼠一般表征和糖脂代谢的改善作用
- Improvement effects of agiophyllum oligosaccharides on general characterization and glucose and lipid metabolism of diabetic GK rats
- 吉林大学学报(医学版), 2016, 42(06): 1059-1065
- Journal of Jilin University (Medicine Edition), 2016, 42(06): 1059-1065
- 10.13481/j.1671-587x.20160604
-
文章历史
- 收稿日期: 2015-10-02
2. 华北理工大学基础医学院药理学系河北省慢性疾病重点实验室, 河北 唐山 063000;
3. 内蒙古民族大学蒙医药学院制剂实验室, 内蒙古 通辽 028000;
4. 内蒙古民族大学蒙医药学院蒙医内科教研室, 内蒙古 通辽 028000
2. Department of Pharmacology, School of Basic Medical Sciences, North China University of Science and Technology, Key Laboratory of Chronic Diseases, Hebei Province, Tangshan 063000, China;
3. Preparation Laboratory, School of Mongolian Medicine, Inner Mongolia University for Nationalities, Tongliao 028300, China;
4. Department of Mongolian Internal Medicine, School of Mongolian Medicine, Inner Mongolia University for Nationalities, Tongliao 028300, China
2型糖尿病常并发脂代谢异常,糖脂代谢改变是糖尿病患者发生心脑血管等并发症的重要危险因素[1-2]。目前,临床应用的较为理想的降糖和降脂药物不多。沙蓬为藜科植物沙蓬(Agriophyllum squarrosum L.Moq.)干燥的地上部分,是中国蒙医常用的传统药材,具有祛疫、清热、解毒和利尿功能,亦用于治疗消渴病[3-5]。查阅近几十年的国内外相关药学文献后,本文作者发现目前国内外医药学领域对沙蓬的研究甚少,除一些化学成分的研究及少数几篇生药学方面的研究报道外,尚未见有关沙蓬药理学及更多药学研究方面的文献。本研究采用沙蓬粗寡糖(Agiophyllum oligosaccharides,AOS)干预自发性2型糖尿病GK大鼠,观察其对糖脂代谢的影响,为沙蓬的进一步开发应用提供依据。
1 材料与方法 1.1 实验动物雄性SPF级自发性2型糖尿病GK大鼠80只,体质量210~240 g,10~13周龄,购自上海斯莱克斯实验动物责任有限公司,许可证号:SCXK (沪)2012-0002;雄性SPF级Wistar大鼠10只,体质量230~240 g,12~13周龄,购自北京华阜康生物科技股份有限公司,许可证号:SCXK (京)2014-0002;大鼠饲料购自中国解放军军事医学科学院,许可证号:SCXK (军)2014-0001。高脂饲料由北京华阜康生物科技股份有限公司提供,合格证号:SCXK (京)2009-0008。所有大鼠均于华北理工大学动物实验中心SPF级屏障实验室饲养,每笼5只。
1.2 主要药品、试剂和仪器AOS由内蒙古自治区蒙医药工程技术研究院提供,其为沙蓬稀醇提取、大孔树脂纯化、脱色而得粗寡糖,AOS成品粗寡糖含量达72.6%。
盐酸二甲双胍(metformin,ME)购于天津亚宝药业科技有限公司,批号:140628;格列苯脲(glen benzene urea, GLB)购于天津太平洋制药有限公司,批号:1301120;葡萄糖氧化酶试剂盒购于长春汇力生物技术有限公司,批号:20140505;总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)和低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)试剂盒购于北京瑞正善达生物工程技术有限公司,批号:20140330;糖化血红蛋白(blood hematoglobin ALC,HbAlc)检测试剂盒购于Axis-shield Poc AS公司,批号:20141204;空腹血浆胰岛素(fasting plasma insulin,FINS)试剂盒购于美国拜力生物科技有限公司,批号:20150505;糖化血清蛋白(glycosylated serum protein, GSP)试剂盒购于北京凯诺春天生物科技有限公司,批号:20150301A。
电子天平(FA2104N,上海菁海仪器有限公司),高速低温离心机(5180R,德国Eppendorf公司),全自动生化分析仪(Chemray 420,深圳雷杜生命科学股份有限公司),实验室超纯水制备系统(RODI-P,上海和泰仪器有限公司),生物安全柜(BSC-1300IIA2,中国上海博讯实业有限公司),HbAlC检测仪(NycoCard READER2,挪威安迅时特有限公司),多功能酶标仪(Infinite 200PRO,瑞士帝肯有限责任公司),γ放射免疫计数器(GC-1200,安徽中科中佳科学仪器有限公司),罗氏血糖仪和试纸(德国罗氏诊断有限公司)。
1.3 受试药物的给药剂量和给药途径沙蓬原药材临床用法与用量为65 g·d-1,相当于1.083 g生药·kg-1(成人体质量按60 kg计算)。每克AOS相当14.4 g生药,成人AOS用量为0.075 g·kg-1。大鼠与人的等效剂量比为6.3:1,故大鼠治疗的等效剂量为0.475 g·kg-1(0.48),相当6.83 g生药·kg-1。大鼠实验时采用3个剂量,分别相当于人临床用量的2倍、1倍(等倍)和0.5倍。给药量分别为药粉0.96、0.48和0.24 g·kg-1(相当于生药量13.66、6.83和3.42 g·kg-1·d-1)。给药途径为口服(灌胃),容量为5 mL·kg-1,每天1次,均为上午8.00~10.00点给药。二甲双胍给药剂量为0.1 g·kg-1(为人用量的6.3倍,相当于人等效量),灌胃给药容积为5 mL·kg-1。格列苯脲给药剂量为1.2 mg·kg-1(为人用量的6.3倍,相当于人等效量),给药容积为5 mL·kg-1。
1.4 2型糖尿病模型的确定标准大鼠随机血糖和糖负荷2h血糖水平均高于11.1 mol·L-1即成功建立2型糖尿病模型。由于GK大鼠空腹血糖水平升高不明显(4~8 mol·L-1),随机血糖水平有1/2大鼠在11.1 mol·L-1以下,糖负荷2 h有3/4大鼠血糖水平在11.1 mol·L-1以上,因此随机血糖水平在11.1 mol·L-1以下大鼠给予高脂饲料诱导4~5周。80只GK大鼠经5周的高脂饲料诱导,有65只(81.25%)大鼠随机血糖水平及糖负荷2h血糖水平均高于11.1 mol·L-1,即符合2型糖尿病模型建立标准。
1.5 大鼠分组和给药将符合成模标准的65只大鼠剔除体质量较低或较高及血糖水平过高的5只,余下的60只按随机数字表法分为6组,每组10只,即模型对照组(MC组)、GLB组、ME组、低剂量AOS组(AOS-L组)、中剂量AOS组(AOS-M组)和高剂量AOS组(AOS-H组)。将10只Wistar大鼠作为正常对照组。大鼠分组后,按设计方案灌胃给予相应药物,MC组和NC组大鼠每天灌胃同容积蒸馏水。各组大鼠均在上午8:00~10:00点灌胃给药,每天1次,连续8周。
1.6 观察和检测指标一般表征:给药期间观察各组大鼠精神状态、活动、毛色、饮食、饮水、体质量和大小便等一般状态,每周测定体质量、进食量、饮水量1次;随机血糖:分别于给药第0、2、4、6和8周测定随机血糖(上午给药后30 min);糖耐量:给药前和给药结束时进行口服葡萄糖耐量试验(oral glucose tolerance test,OGTT),即前1天晚上断食不断水,更换垫料,断食16 h后,采用罗氏血糖仪检测0点血糖水平及灌胃葡萄糖(2.5 g·kg-1)后30、60、120 min血糖水平,根据血糖水平和梯形面积求和法计算曲线下面积(AUC),其中G0、G30、G60和G120为各点血糖水平。AUC=15(G0+G30)+15(G30+ G60)+30(G60+G120);HbA1c:处死前尾静脉取5 μL全血,采用HbA1c检测试剂盒(微粒色谱法)测定HbAlc水平;血糖、血脂、GSP和FINS:给药8周后,禁食12 h,采用10%水合氯醛3 mL·kg-1腹腔注射麻醉大鼠,经腹主动脉取血,采用葡萄糖氧化酶法测定空腹血糖(fasting serum glucose,FPG),采用全自动生化分析仪测定大鼠血清中TC、TG、HDL-C和LDL-C水平,放射免疫法测定大鼠FINS水平;ELISA法检测GSP水平,均按试剂盒说明书操作。计算胰岛素敏感指数(insulin sensitivity index,IAI),IAI=-In (FPG× FINS)。
1.7 统计学分析采用SPSS17.0统计软件对数据进行统计学分析。各组大鼠的随机血糖、糖耐量、HbAlc、GSP、FPG和FINS水平、IAI及TC、TG、HDL-C、LDL-C水平均以x±s表示,组间差异比较采用单因素方差分析。以α=0.05为检验水准。
2 结果 2.1 各组大鼠一般表征NC组大鼠活动自如,反应机敏,毛色白而有光泽,大便成形,色泽正常;MC组大鼠活动自如,但反应迟钝,毛色发黄无光泽,随着时间推移,毛色枯黄和反应迟钝更明显,个别大鼠有稀便现象;与MC组比较,各用药组大鼠反应迟钝现象减轻,毛色也较MC组有光泽,大便成形,色泽正常,未见其他异常现象。
2.2 各组大鼠体质量、摄食量和饮水量在给药前3周,各组GK大鼠体质量增长趋势与NC组大鼠一致,但给药4周后各组GK大鼠体质量增加延缓;随着周龄增加,体质量增加缓慢,明显低于NC组;与MC组比较,各给药组大鼠体质量增加趋势无明显变化,与MC组呈完全平行的增加曲线。见图 1。
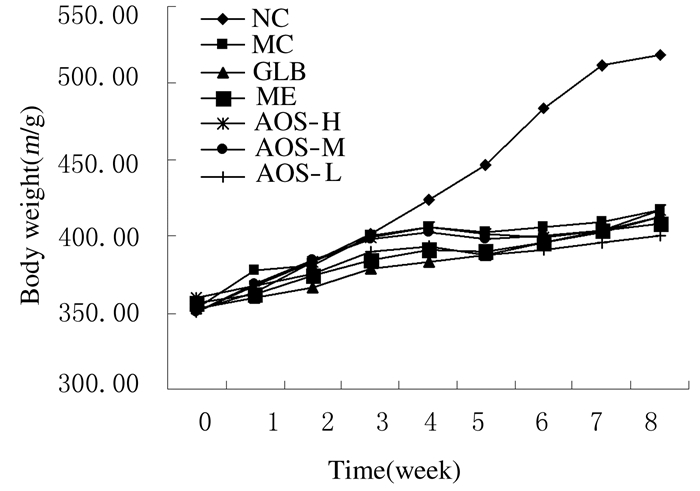
|
| 图 1 各组大鼠不同时间的体质量 Figure 1 Body weights of rats in various groups |
|
|
在观察期间(8周),NC组大鼠摄食量在前4周有增加趋势,但从第4周开始随着周龄的增加,其摄食量呈降低趋势;MC组大鼠摄食量明显高于NC组;与MC组比较,各给药组大鼠摄食量有一定程度降低,其中AOS-M和AOS-H组大鼠摄食量与GLB组和ME组相近,AOS-L组大鼠摄食量波动较大。见图 2。
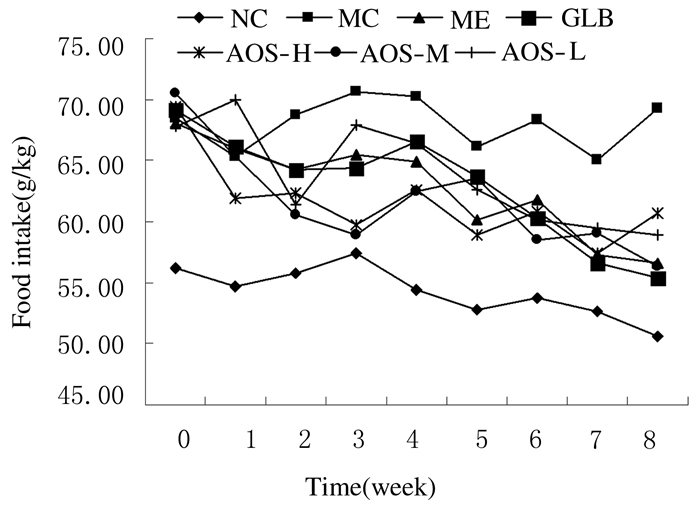
|
| 图 2 各组大鼠不同时间的摄食量 Figure 2 Food intakes of rats in various groups at different time |
|
|
在观察期间(8周),NC组大鼠饮水量为77~84 mL·kg-1,无明显变化;ME组大鼠饮水量明显多于NC组;随着时间推移,其饮水量也增加,观察4周时,大鼠饮水量达高峰。与MC组比较,各给药组大鼠饮水量不同程度降低,其中ME组和GLB组大鼠饮水量降低最明显,给药1周明显减少,并始终保持较低水平;AOS-M组和AOS-H组大鼠饮水量自给药1周起就明显降低,随着时间推移,其饮水量有所增加,但仍明显低于MC组,AOS-L组大鼠饮水量也降低,但不明显。见图 3。

|
| 图 3 各组大鼠不同时间的饮水量 Figure 3 Water intakes of rats in various groups at different time |
|
|
给药前所有GK大鼠随机血糖水平均明显高于NC组,给药期间NC组大鼠随机血糖水平比较平稳,基本无变化;给药8周期间,MC组大鼠随机血糖水平随着时间推移逐渐升高;各给药组大鼠随机血糖水平均有不同程度降低,与MC组比较,GLB组和ME组大鼠随机血糖水平降低最明显(P < 0.05或P < 0.01);各剂量AOS组大鼠随机血糖水平也明显降低,其中在给药4周时降低效果最好,随机血糖水平与GLB组及ME组接近,但在6~8周随机血糖水平又有所升高,但明显低于MC组(P < 0.05或P < 0.01);各剂量AOS组大鼠随机血糖水平比较差异无统计学意义(P>0.05),但AOS-M组大鼠随机血糖降低效果更好。见表 1。
| [n=10, x±s, cB/(mmol·L-1)] | |||||
| Group | Level of random blood glucose | ||||
| (week) 0 | 2 | 4 | 6 | 8 | |
| NC | 5.25±0.49 | 5.37±0.48 | 5.58±0.5 | 5.77±0.53 | 5.60±0.54 |
| MC | 13.45±1.57** | 14.39±2.33** | 14.84±1.88** | 16.09±2.28** | 17.49±2.88** |
| GLB | 13.57±1.52** | 11.31±2.11**△ | 9.76±1.88*△ | 9.41±1.64**△△ | 9.07±1.07**△△ |
| ME | 13.31±2.95** | 10.95±3.43**△ | 10.32±2.88**△△ | 10.65±2.79**△△ | 9.81±1.67**△△ |
| AOS-L | 13.87±2.55** | 12.39±3.28** | 11.65±4.63**△ | 13.87±2.23**△ | 12.39±1.97**△△ |
| AOS-M | 13.97±2.70** | 11.44±4.46** | 9.26±2.94**△△ | 11.76±4.45**△△ | 11.1±3.85**△△ |
| AOS-H | 13.65±2.48** | 12.01±3.81** | 10.43±3.56**△△ | 12.93±3.98**△ | 11.58±3.02**△△ |
| *P < 0.05, **P < 0.01 compared with NC group; △P < 0.05, △△P < 0.01 compared with MC group | |||||
MC组大鼠HbAlc和GSP水平均明显高于NC组(P < 0.01);与MC组比较,ME组和GLB组大鼠血清HbAlc和GSP水平明显降低(P < 0.01),特别是GSP水平降低更明显,接近于NC组;各剂量AOS组大鼠血清HbAlc和GSP水平明显低于MC组,AOS-M和AOS-H组降低效果更明显(P < 0.05或P < 0.01),但各剂量AOS组大鼠HbAlc和GSP水平比较差异无统计学意义(P>0.05)。见表 2。
| (n=10, x±s) | ||
| Group | HbAlc (η/%) | GSP[cB/(mol·L-1)] |
| NC | 3.65±0.18 | 26.872±9.029 |
| MC | 6.02±0.69* | 53.075±11.568* |
| GLB | 4.92±0.57*△△ | 33.278±12.546△△ |
| ME | 4.82±0.49*△△ | 31.873±9.595△△ |
| AOS-L | 5.63±0.52* | 45.150±11.783*△ |
| AOS-M | 5.22±0.58*△ | 37.688±10.602*△△ |
| AOS-H | 5.09±0.68*△ | 41.014±16.532*△△ |
| *P < 0.01 compared with NC group; △P < 0.05, △△P < 0.01 compared with MC group. | ||
糖负荷30 min时,与MC组比较,AOS-M组大鼠糖耐量水平降低幅度最大(P < 0.05),其次是AOS-L和AOS-H组和ME组(P < 0.05),之后为GLB组(P < 0.05);糖负荷60 min时,各给药组大鼠糖耐量水平明显低于ME组(P < 0.05或P < 0.01),降低幅度由高到低依次为AOS-M组、AOS-L组、AOS-H组、GLB组和ME组;糖负荷120 min时,各给药组大鼠糖耐量水平均明显低于MC组(P < 0.05),降低幅度由高到低依次为AOS-M组、GLB组、AOS-L组、AOS-H组和ME组。各剂量AOS组大鼠糖耐量水平比较差异无统计学意义(P>0.05)。与NC组比较,其余各组大鼠AUC均升高(P < 0.01);与MC组比较, 各给药组大鼠AUC均降低(P < 0.05或P < 0.01);AUC由低到高依次为AOS-M组、AOS-L组、AOS-H组、GLB组和ME组。见表 3。
| [n=10, x±s, cB/(mmol·L-1] | |||||
| Group | Level of OGTT | AUC | |||
| (t/min) 0 | 30 | 60 | 120 | ||
| NC | 4.62±0.53 | 6.59±0.61 | 6.91±0.70 | 5.48±0.74 | 742.35±82.90 |
| MC | 5.64±0.29* | 16.10±1.73* | 15.84±1.59* | 15.31±1.50* | 1 827.30±185.36* |
| GLB | 5.84±0.97* | 14.47±1.33*△ | 13.71±1.79*△△ | 9.11±2.05*△△ | 1 407.96±186.38*△△ |
| ME | 5.98±0.42* | 13.15±1.84*△△ | 13.89±1.32*△△ | 10.35±1.03*△△ | 1 420.05±160.50*△△ |
| AOS-L | 5.67±0.64* | 12.43±3.00*△△ | 10.81±1.71*△△ | 9.30±1.83*△△ | 1 222.95±231.33*△△ |
| AOS-M | 5.63±0.50* | 11.05±2.74*△△ | 10.02±2.36*△△ | 8.12±1.13*△△ | 1 110.45±229.23*△△ |
| AOS-H | 5.71±0.43* | 12.81±2.14*△△ | 11.56±2.08*△△ | 10.19±1.90*△△ | 1 295.77±221.38*△△ |
| *P < 0.01 compared with NC group; △P < 0.05, △△P < 0.01 compared with MC group | |||||
给药8周后禁食12 h,各给药组大鼠FPG水平明显高于NC组(P < 0.01);与MC组比较,GLB组、ME组和AOS-M组大鼠FPG水平明显降低(P < 0.05),AOS-L和AOS-H组大鼠FPG水平也较低,但与MC组比较差异无统计学意义(P>0.05)。NC组大鼠FINS水平最高,明显高于其他各组(P < 0.05或P < 0.01);各给药组大鼠FINS水平与MC组比较差异无统计学意义(P>0.05)。各给药组大鼠IAI均高于MC组(P < 0.05),其中以AOS-M组和AOS-H组更高,但各给药组大鼠FPG和FINS水平及IAI组间比较差异无统计学意义(P>0.05)。见表 4。
| (n=10, x±s) | |||
| Group | FPG [cB/(mmol·L-1)] |
FINS [ρB/(ng·L-1)] |
IAI |
| NC | 4.91±0.52 | 752.05±158.40 | -8.21±0.22 |
| MC | 6.87±0.60** | 593.56±163.45* | -8.31±0.26* |
| GLB | 6.21±0.49**△ | 618.75±171.48* | -8.25±0.28△ |
| ME | 6.09±0.61**△ | 608.23±170.73* | -8.21±0.24△ |
| AOS-L | 6.28±0.67** | 583.88±165.37* | -8.20±0.20△ |
| AOS-M | 6.16±0.62**△ | 559.85±104.60** | -8.14±0.27△ |
| AOS-H | 6.29±0.57** | 568.13±154.76** | -8.18±0.21△ |
| *P < 0.05,**P < 0.01 compared with NC group; △P < 0.05 compared with MC group. | |||
MC组大鼠血清TC和HDL-C水平明显高于NC组(P<0.01),而TG低于NC组(P<0.05),LDL-C与NC组比较差异无统计学意义;各给药组大鼠血脂指标均有不同程度的降低,以GLB组降低最明显;AOS-L组大鼠血清TC、TG、和HDL-C水平与GLB组相近,低于MC组(P<0.05或P<0.01);AOS-L组大鼠血清LDL-C水平与MC组比较差异无统计学意义(P>0.05),AOS-M组大鼠TG和HDL-C水平低于MC组(P<0.05)。见表 5。
| [n=10, x±s, cB/(mmol·L-1] | ||||
| Group | TG | TC | LDL-C | HDL-C |
| NC | 0.62±0.19 | 1.74±0.27 | 0.24±0.05 | 1.08±0.19 |
| MC | 0.52±0.14* | 2.34±0.17** | 0.22±0.05 | 1.64±0.22** |
| GLB | 0.37±0.09**△△ | 2.00±0.27**△△ | 0.14±0.05**△ | 1.53±0.20**△ |
| ME | 0.49±0.13* | 2.19±0.17** | 0.19±0.03* | 1.51±0.13**△ |
| AOS-L | 0.36±0.07**△△ | 2.07±0.11**△△ | 0.20±0.03* | 1.47±0.12*△ |
| AOS-M | 0.42±0.08**△ | 2.26±0.25** | 0.26±0.07 | 1.54±0.16**△ |
| AOS-H | 0.53±0.11* | 2.23±0.13** | 0.25±0.05 | 1.53±0.12**△ |
| *P < 0.05, **P < 0.01 compared with NC group; △P < 0.05, △△P < 0.01 compared with MC group | ||||
GK大鼠是国际公认的研究2型糖尿病较为理想的自发性非肥胖型模型大鼠[6],与人类2型糖尿病发病因素和病程特点尤为相似,在新药研究与开发中具有重要价值[7]。目前对多糖类的降血糖作用研究主要集中在多糖成分,而对寡糖的降血糖作用研究较少[8]。
糖尿病精神状态、皮肤外观(动物)、摄食量和饮水量等一般表征能反映糖尿病的症状和严重程度及药物改善程度。本研究结果表明:GK大鼠一般表征和糖脂代谢特点与文献报道[9-10]一致;中、高剂量AOS能改善GK大鼠的一般状态,降低大鼠摄食量和饮水量,与GLB和ME作用相近,说明AOS对糖尿病病情、症状具有改善作用。目前,有关AOS对GK大鼠一般表征的影响未见文献报道。
测定血液中的HbAlc和GSP水平是目前国内外学者较为公认的一种中长期监控糖尿病的“黄金指标”,是了解糖尿病近期治疗效果好坏的一把“金钥匙”。HbAlc水平反映的是机体近期(6~8周)平均血糖水平,而GSP水平反映的是近2~3周的平均血糖水平[11],因此测定血液中HbAlc和GSP水平可用于临床追溯近1~2个月血糖平均水平、用药效果判断及指导用药[12]。长期高血糖状态下,机体内HbAlc和GSP水平明显增加,会导致血管内皮损伤及血管功能失调,是糖尿病血管并发症的基础。AOS对HbAlc和GSP的产生有明显抑制作用,提示AOS对糖尿病血糖有良好的控制作用。
2型糖尿病以胰岛素抵抗(IR)为主要特征,IR主要表现为机体对胰岛素的敏感性和反应性降低,使葡萄糖摄取及利用减少,以及胰岛素对外周脂肪分解的抑制作用降低,导致糖脂代谢紊乱。糖脂代谢紊乱是心血管疾病和多种慢性并发症产生的主要原因。目前临床上OGTT和IAI是评估胰岛素抵抗的良好指标[13],血脂检测的主要指标为TC、TG、HDL-C和LDL-C。血液中的HDL与TC结合后变为HDL-C,具有清洁血管的功能;而LDL与TC结合后成为LDL-C,其水平过高可损害动脉,所以一般被认为是心血管疾病的主要原因之一。本研究结果显示:随着时间推移,GK大鼠血糖水平逐渐升高,伴有IR;TC和HDL-C水平明显高于NC组,而TG水平低于NC组,与文献报道[14]一致,这也是GK大鼠的特征之一。AOS对GK大鼠的FINS水平无明显影响,但能明显降低随机血糖和葡萄糖负荷后的血糖水平升高,使糖耐量各点血糖值、血糖升高速度和幅度及AUC均明显低于MC组,以AOS-M和AOS-H组作用更明显。AOS在降糖幅度上与GLB相近,但降糖速度快于GLB,改善糖耐量的效果优于ME。近年相关研究[15]结果提示:寡糖降血糖的作用机制多表现在增加胰岛β细胞分泌,提高机体胰岛素水平;保护、修复胰岛β细胞而增加血液中胰岛素的水平;抑制α-葡萄糖苷酶活性;抑制糖异生,促进外周组织对糖的利用;抑制醛糖还原酶;调节葡糖激酶和葡糖-6-磷酸酶活性等方面。
综上所述,AOS对自发性2型糖尿病GK大鼠有明显降低随机血糖、改善糖耐量和调节血脂水平等作用。在本研究剂量范围内,各剂量AOS组无明显量效关系,在降血糖方面以AOS-M组效果更好,在调血脂方面以AOS-L组效果更好。由于沙蓬应用于糖尿病研究报道很少,特别是AOS对糖尿病作用的研究尚未见报道,因此其作用机制尚不明确,有待进一步深入研究。
| [1] | 黄伟煌, 张丽菊, 井立鹏, 等. 2型糖尿病大血管病变风险及其交互作用分析[J]. 中华疾病控制杂志, 2015, 19(1): 13–16. |
| [2] | 孟馨, 贾楠, 金智一, 等. 2型糖尿病患者血清CA-125水平与代谢控制指标的相关性研究[J]. 中国医科大学学报, 2014, 43(11): 996–1002. |
| [3] | 柳白乙拉, 武绍新. 中华本草:蒙药卷[M]. 上海: 上海科学技术出版社,2004: 236. |
| [4] | 朱亚民. 内蒙古植物药志:第1卷[M]. 呼和浩特: 内蒙古人民出版社,2000: 299. |
| [5] | 占布拉道尔吉. 无误蒙药鉴[M]. 呼和浩特: 内蒙古人民出版社,1988: 144-145. |
| [6] | Janssen U, Phillips AO, Floege J. Rodent models of nephropathy associated with type Ⅱ diabetes[J]. J Nephrol, 1999, 12(3): 159–172. |
| [7] | Portha B. Programmed disorders of beta-cell development and function as one cause for type 2 diabetes? The GK rat paradigm[J]. Diabetes Metab Res Rev, 2005, 21(6): 495–504. DOI:10.1002/(ISSN)1520-7560 |
| [8] | 郭丽民, 张汝学, 贾正平. 寡糖的药理作用和机制研究进展[J]. 中成药, 2006, 28(9): 1353–1356. |
| [9] | 徐倍, 吴国亭, 韩玉麒, 等. 2型糖尿病GK大鼠病程进展与组织形态学改变[J]. 同济大学学报:医学版, 2007, 28(5): 17–21. |
| [10] | 顾迁, 高鑫, 徐平, 等. GK糖尿病大鼠生物学特性观察[J]. 中国比较医学杂志, 2007, 17(12): 688–692. |
| [11] | 鞠海兵, 舒子正, 李丽凤, 等. 2型糖尿病患者不同时间血糖与糖化血红蛋白的相关性及其贡献[J]. 中华糖尿病杂志, 2014, 6(1): 32–36. |
| [12] | Huang BK, Mo L, Chen AY, et al. Detection of glycated albumin on the evaluation of short term glycemic control for patients with type 2 diabetes[J]. Progress Modern Biomed, 2014, 14(26): 5139–5142. |
| [13] | 李光伟. 个体胰岛素敏感性的临床评估出路在何方[J]. 中华糖尿病杂志, 2005, 13(4): 243–244. |
| [14] | Desrois M, Sidell RJ, Gauguier D, et al. Gender differences in hypertrophy, insulin resistance and ischemic injury in the aging type 2 diabetic rat heart[J]. J Mol Cell Cardiol, 2004, 37(2): 547–555. DOI:10.1016/j.yjmcc.2004.05.014 |
| [15] | 董权锋, 于荣敏. 寡糖研究新进展[J]. 食品与药品, 2009, 11(7): 63–66. |
 2016, Vol. 42
2016, Vol. 42


