扩展功能
文章信息
- 徐路, 曾林川, 于洋, 窦茗瀚, 刘师兵, 李松岩, 徐冶
- XU Lu, ZENG Linchuan, YU Yang, DOU Minghan, LU Shibing, LI Songyan, XU Ye
- 钙离子在顺铂诱导宫颈癌HeLa细胞自噬反应中的作用
- Role of Ca2+ in cisplatin-induced autophagy of cervical cancer HeLa cells
- 吉林大学学报(医学版), 2016, 42(06): 1045-1048
- Journal of Jilin University (Medicine Edition), 2016, 42(06): 1045-1048
- 10.13481/j.1671-587x.20160601
-
文章历史
- 收稿日期: 2016-04-11
2. 吉林医药学院公共卫生学院, 吉林 吉林 132013
2. School of Public Health, Jilin Medical University, Jilin 132013, China
宫颈癌是一种常见的妇科恶性肿瘤,严重危害妇女的健康[1]。顺铂作为临床普遍使用的化疗药物,其在宫颈癌的化疗中具有重要的地位[2]。尽管宫颈癌的治疗药物和方法不断更新,但治疗效果并不明显。肿瘤细胞自噬的研究已成为肿瘤治疗的重要方向,但自噬究竟是阻碍肿瘤发生的屏障还是肿瘤的适应性应答一直存在争议。大多数研究者[3]认为:诱导肿瘤细胞自噬是一种潜在的肿瘤治疗途径。自噬发生过程中钙离子(Ca2+)发挥重要作用[4-5],本研究以Ca2+为切入点,采用一种新型膜通透性的肌醇-1,4,5-三磷酸受体(IP3R)拮抗剂2-氨基乙氧基二苯基硼酸盐(2-aminoethoxydiphenyl borate,2-APB)干预Ca2+传递,通过顺铂和2-APB联合用药作用于人宫颈癌HeLa细胞,探讨Ca2+在顺铂诱导HeLa细胞自噬过程中的作用。
1 材料与方法 1.1 细胞、主要试剂和仪器本研究所用的人宫颈癌HeLa细胞由吉林大学基础医学院病理生理学系惠赠。IMDM培养基和胎牛血清购自美国Hyclone公司,2-APB、胞浆钙离子探针Fluo-4/AM、噻唑蓝(MTT)和顺铂均购自美国Sigma公司,线粒体钙离子探针Rhod-2/AM购自美国AAT Bioquest公司,LC3B抗体和P62抗体均购自于自美国Santa Cruz公司,其他试剂均为进口或国产分析纯。pH测定仪购自美国OHAUS公司,超纯水仪购自美国Millipore公司,Model-680型酶标仪购自美国Bio-rad公司,共聚焦激光扫描显微镜购自日本Olympus公司。
1.2 HeLa细胞株的培养HeLa细胞采用含10%胎牛血清、青霉素和链霉素各100 U·mL-1的IMDM培养液,置于温度为37℃、5% CO2、饱和湿度的培养箱中培养。每天换液1次,待细胞生长至对数生长期时,用0.25%胰酶进行消化,按1:4的比例进行传代,待细胞传至第3代后进行实验, 每一实验重复3次。
1.3 MTT法检测HeLa细胞生存率取对数生长期的HeLa细胞,胰酶消化后800 r·min-1离心,按每孔1×104个细胞接种于96孔板,置于37℃、5% CO2培养箱中培养过夜。首先确定给药条件,设立对照组和不同浓度顺铂组,每个浓度5个复孔,培养箱中培养12和24 h;每孔加入20 μL MTT,CO2培养箱中继续孵育4 h,吸掉96孔板中的培养液,加入150 μL二甲基亚砜(DMSO),振荡器振荡10 min,采用酶标仪检测HeLa细胞的半数致死浓度(IC50)值。HeLa细胞分为对照组、顺铂组、2-APB组和顺铂联合2-APB组(联合组),按照上述方法测定每孔吸光度(A)值。设对照组细胞生存率为100%,计算其他各组细胞生存率,细胞生存率=(各组A值/对照组A值)×100%。每一实验重复3次。
1.4 钙离子荧光探针法检测HeLa细胞胞浆和线粒体中游离Ca2+水平将HeLa细胞用不含EDTA的胰蛋白酶消化、收集总细胞。计数后,按每孔2.5×104个细胞接种于24孔板内,置于恒温培养箱中过夜。次日细胞长至80%密度,分为对照组、顺铂组、2-APB组和顺铂联合2-APB组(联合组)。吸出每孔药物,并加入D-hank’ s液洗3次,然后各加入稀释后的Fluo-4 (5μmol·L-1)和Rhod-2(5μmol·L-1)(用于分别检测胞浆和线粒体中游离Ca2+水平[6])。30 min后用D-Hank’ s液洗涤3次,随后在Olympus FV1000共聚焦激光显微镜激发波长488/546 nm处收集Fluo-4/Rhod-2标记的荧光图像(以荧光强度代表Ca2+水平)。
1.5 间接免疫荧光法检测HeLa细胞中自噬标志蛋白LC3和P62共定位情况检测自噬标志性蛋白LC3和P62共定位。高压消毒后无菌盖玻片置于24孔板中,设定细胞密度为1×105mL-1,每孔500μL接种过夜,次日细胞长至80%密度,分为对照组、顺铂组、2-APB组和顺铂联合2-APB组(联合组)。弃去培养基,加入200 μL固定液(4%多聚甲醛)作用10 min,吸去固定液加入0.01 mol·L-1磷酸盐缓冲液(PBS)溶液洗涤后,爬片固定后经0.1%TritonPBS作用5 min,0.01 mol·L-1 PBS溶液洗涤,非免疫山羊血清封闭30 min,加入预混的一抗4 ℃过夜,0.01 mol·L-1 PBS溶液洗涤,加入预混的荧光二抗作用30 min,0.01 mol·L-1 PBS溶液洗涤,抗荧光淬灭剂封片,激光共聚焦显微镜观察并分析。
1.6 统计学分析采用SPSS11.5统计软件进行统计学分析。HeLa细胞生存率以x±s表示,多组间比较采用单因素方差分析,多组间两两比较采用t检验。以α=0.05为检验水准。
2 结果 2.1 各组HeLa细胞生存率顺铂对HeLa细胞的生长抑制具有时间和剂量依赖性,顺铂作用24 h时HeLa细胞的IC50值为6.27 mg·L-1。与对照组(80.8%±0.9%)比较,顺铂组(48.0%±0.7%)和联合组(65.0%±1.0%) HeLa细胞生存率明显降低(P < 0.05), 2-APB组(80.3%±0.5%) HeLa细胞生存率无明显变化(P>0.05);而与顺铂组比较,联合组HeLa细胞生存率明显升高(P < 0.05)。见图 1。
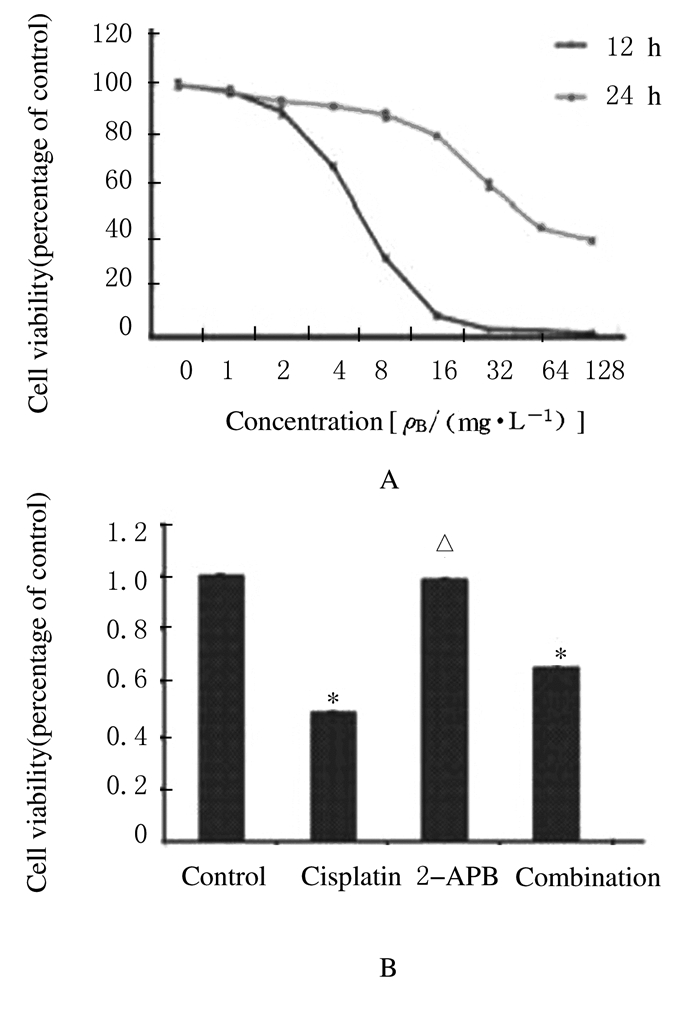
|
| *P < 0.05 vs control group; △P < 0.05 vs cisplatin group. 图 1 MTT法检测各组HeLa细胞生存率曲线图(A)和直条图(B) Figure 1 Curve graph (A) and histogram (B) of survival rates of HeLa cells deteted by MTT method |
|
|
共聚焦显微镜下观察胞浆和线粒体中游离Ca2+水平, 与对照组比较,顺铂组HeLa细胞胞浆和线粒体中Ca2+荧光强度增加(即Ca2+水平升高),2-APB组HeLa细胞胞浆和线粒体中Ca2+荧光强度无明显变化,联合组HeLa细胞胞浆和线粒体中Ca2+荧光强度明显低于顺铂组。见图 2(插页一)。

|
| A-D: Cytoplasm; E-H: Mitochondria; A, E: Control group; B, F: Cisplatin group; C, G: 2-APB group; D, H: Combination group. 图 2 共聚焦显微镜下观察各组HeLa细胞株胞浆和线粒体中Ca2+荧光强度 Figure 2 Fluorescence intensity of Ca2+ in cytoplasm and mitochondria of HeLa cells in various groups observed by confocal microscope |
|
|
共聚焦显微镜下观察P62与LC3蛋白共定位情况,与对照组比较,顺铂组和联合组HeLa细胞中LC3和P62蛋白发生点状聚集,共定位明显;2-APB组细胞中P62与LC3蛋白共定位无明显变化。与顺铂组比较,联合组细胞中LC3和P62蛋白荧光强度明显减弱,共定位不明显。见图 3(插页一)。
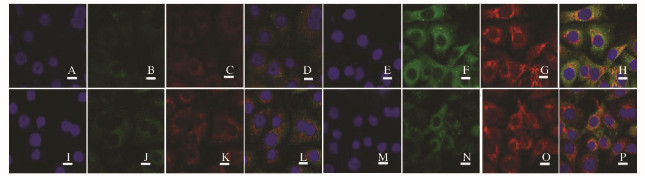
|
| A-D: Control group; E-H: Cisplatin group; I-L: 2-APB group; M-P: Combination group; A, E, I, M: Hoechst staining; B, F, G, N: P62; C, G, K, O: LC3; D, H, L, P: Merged image. 图 3 共聚焦显微镜下观察各组HeLa细胞中P62和LC3共定位情况 Figure 3 Colocalization status of P62 and LC3 in HeLa cells in various grops observed by confocal microscope |
|
|
荧光显微镜下观察可见顺铂作用HeLa细胞过程中会导致胞浆和线粒体中Ca2+水平升高,而细胞中Ca2+的储存、释放和摄取均受内质网调节[7]。IP3R和RyR通道是内质网Ca2+释放通道,参与了线粒体与内质网之间相互串话和胞浆中Ca2+水平稳态的调节[8-10]。IP3R抑制剂2-APB可阻断内质网Ca2+释放通道,抑制顺铂诱导的胞浆和线粒体内Ca2+水平升高。Ca2+在维持细胞生物活性中发挥着重要作用,Ca2+在线粒体聚集至一定程度时,会促发线粒体通透转换孔道(mPTP)开放,引起细胞电子传递与氧化磷酸化解偶联、超氧阴离子(ROS)增多、线粒体肿胀,细胞色素C释放导致凋亡蛋白酶活化,最终引起细胞凋亡[11-12]。阻止内质网中Ca2+转运到线粒体会诱导抗凋亡蛋白BCL-2和BCL-XL的过表达,形成促生存的信号[13]。本研究结果显示:2-APB和顺铂联合用药能够降低顺铂对HeLa细胞的生长抑制作用,说明2-APB能增强HeLa细胞对顺铂的耐受性。
LC3和P62是常用的自噬标志蛋白,LC3是检测自噬的标志性蛋白,其在自噬时由LC3Ⅰ转化为活化的LC3Ⅱ;P62是一种多功能蛋白,可与LC3相互作用,并结合泛素化蛋白经自噬途径降解,可被作为自噬泡更替更有效的标志[14-15]。共聚焦显微镜下观察发现顺铂能够诱导HeLa细胞发生自噬。自噬是重要的降解代谢过程,对细胞自我更新、维持内环境稳态、细胞生长和分化等有重要意义[16]。自噬参与抗肿瘤药物对肿瘤细胞的杀伤作用以及与凋亡关系的具体机制尚不明确,需要进一步探讨。本研究结果显示:当阻断内质网Ca2+释放时,肿瘤细胞自噬水平降低,因此本文作者推测Ca2+水平影响肿瘤细胞自噬的发生。研究[17]显示:胞浆中Ca2+可激活自噬,如毒胡萝卜素内酯(TG)作为内质网膜Ca2+-ATP酶抑制剂,诱导胞浆Ca2+释放增加来激活钙调蛋白依赖性激酶β,进而激活腺苷酸活化蛋白激酶(AMPK)诱导自噬的活化。此外,线粒体中的Ca2+对自噬活化也起重要的调控作用,钙离子通过IP3R受体通道进入线粒体,激活三羧酸循环(TCA)的酶,以增加ATP的产生从而抑制AMPK对自噬的活化[18]。但Ca2+在肿瘤细胞中激活自噬的分子机制尚未明确。
综上所述,顺铂作用于HeLa细胞可引起Ca2+水平升高,这可能是诱导HeLa细胞发生自噬的新机制。联合钙释放抑制剂给药可以降低肿瘤细胞自噬水平,提高肿瘤细胞对化疗药物的敏感性。本研究结果将为辅助肿瘤治疗和药物的研发提供参考依据。
| [1] | Chakraborty P, Roy SS, Bhattacharya S. Molecular mechanism behind the synergistic activity of diphenylmethyl selenocyanate and cisplatin against murine tumor model[J]. Anticancer Agents Med Chem, 2015, 15(4): 501–510. DOI:10.2174/1871520615666150113123401 |
| [2] | Muggia F. Platinum compounds 30 years after the introduction of cisplatin:implications for the treatment of ovarian cancer[J]. Gynecol Oncol, 2009, 112(1): 275–281. DOI:10.1016/j.ygyno.2008.09.034 |
| [3] | Chen N, Debnath J. Autophagy and tumorigenesis[J]. FEBS Lett, 2010, 584(7): 1427–1435. DOI:10.1016/j.febslet.2009.12.034 |
| [4] | Vicencio JM, Lavandero S, Szabadkai G. Ca2+, autophagy and protein degradation:thrown off balance in neurodegenerative disease[J]. Cell Calcium, 2010, 47(2): 112–121. DOI:10.1016/j.ceca.2009.12.013 |
| [5] | Medina DL, Di Paola S, Peluso I, et al. Lysosomal calcium signalling regulates autophagy through calcineurin and TFEB[J]. Nat Cell Biol, 2015, 17(3): 288–299. DOI:10.1038/ncb3114 |
| [6] | Fonteriz RI, de la Fuente S, Moreno A, et al. Monitoring mitochondrial[J]. Cell Calcium, 2010, 48(1): 61–69. DOI:10.1016/j.ceca.2010.07.001 |
| [7] | Danial NN, Korsmeyer SJ. Cell death:critical control points[J]. Cell, 2004, 116(2): 205–219. DOI:10.1016/S0092-8674(04)00046-7 |
| [8] | Szado T, Vanderheyden V, Parys JB, et al. Phosphorylation of inositol 1, 4, 5-trisphosphate receptors by protein kinase B/Akt inhibits Ca2+ release and apoptosis[J]. Proc Natl Acad Sci USA, 2008, 105(7): 2427–2432. DOI:10.1073/pnas.0711324105 |
| [9] | Smedler E, Uhlén P. Frequency decoding of calcium oscillations[J]. Biochim Biophys Acta, 2014, 1840(3): 964–969. DOI:10.1016/j.bbagen.2013.11.015 |
| [10] | Torres M, Encina G, Soto C, et al. Abnormal calcium homeostasis and protein folding stress at the ER:A common factor in familial and infectious prion disorders[J]. Commun Integr Biol, 2011, 4(3): 258–261. DOI:10.4161/cib.4.3.15019 |
| [11] | Cárdenas C, Foskett JK. Mitochondrial Ca2+ signals in autophagy[J]. Cell Calcium, 2012, 52(1): 44–51. DOI:10.1016/j.ceca.2012.03.001 |
| [12] | Hajnóczky G, Davies E, Madesh M. Calcium signaling and apoptosis[J]. Biochem Biophys Res Commun, 2003, 304(3): 445–454. DOI:10.1016/S0006-291X(03)00616-8 |
| [13] | Høyer-Hansen M, Bastholm L, Szyniarowski P, et al. Control of macroautophagy by calcium, almodulin-dependent kinase kinase-beta, and Bcl-2[J]. Mol Cell, 2007, 25(2): 193–205. DOI:10.1016/j.molcel.2006.12.009 |
| [14] | Bjørkøy G, Lamark T, Brech A, et al. p62/SQSTM1 forms protein aggregates degraded by autophagy and has a protective effect on huntingtin-induced cell death[J]. J Cell Biol, 2005, 171(4): 603–614. DOI:10.1083/jcb.200507002 |
| [15] | Lamark T, Kirkin V, Dikic I, et al. NBR1 and p62 as cargo receptors for selective autophagy of ubiquitinated targets[J]. Cell Cycle, 2009, 8(13): 1986–1990. DOI:10.4161/cc.8.13.8892 |
| [16] | Klionsky DJ, Abdalla FC, Abeliovich H, et al. Guidelines for the use and interpretation of assays for monitoring autophagy[J]. Autophagy, 2012, 8(4): 445–544. DOI:10.4161/auto.19496 |
| [17] | Huang JK, Chou CT, Chang HT, et al. Effect of thapsigargin on Ca2+ fluxes and viability in human prostate cancer cells[J]. J Recept Signal Transduct Res, 2011, 31(3): 247–255. DOI:10.3109/10799893.2011.563311 |
| [18] | Rizzuto R, De Stefani D, Raffaello A, et al. Mitochondria as sensors and regulators of calcium signaling[J]. Nat Rev Mol Cell Biol, 2012, 13(9): 566–578. DOI:10.1038/nrm3412 |
 2016, Vol. 42
2016, Vol. 42


