扩展功能
文章信息
- 李忱, 邹运, 王晓楠, 赵洪宇, 韩青, 王金成
- LI Chen, ZOU Yun, WANG Xiaonan, ZHAO Hongyu, HAN Qing, WANG Jincheng
- 3D打印技术在复杂肿瘤膝关节股骨假体周围骨折翻修术中的应用
- Application of 3D printing technology in reconstruction of an complex periprosthetic femoral fracture of tumor knee joint
- 吉林大学学报(医学版), 2016, 42(05): 980-984
- Journal of Jilin University (Medicine Edition), 2016, 42(05): 980-984
- 10.13481/j.1671-587x.20160527
-
文章历史
- 收稿日期: 2016-02-18
对于胫骨近端或股骨远端有骨肿瘤的患者,在常规肿瘤膝关节置换术后,会存在诸如感染、无菌性松动和假体周围骨折等并发症。股骨端假体周围骨折的患者往往涉及到有大范围的骨缺损、可支撑的骨较少和周围软组织破坏等问题,大多需行二次翻修手术,且手术难度较高,患者远期生存率较低,5年生存率为57%~93%[1],而10年生存率为60%~88%[2]。因此,如何在术前做到精准地规划手术成为保证手术精准可靠的前提,而3D打印技术的发展为医生提供了保障。近年来,3D打印技术在骨科的应用越来越广泛[3],从术前设计手术模拟,到手术导板的个体定制,再到最终的个体化植入物的定制均有所报道[4-9]。该技术的最大优势在于能够真实地重现骨折部位的形态和位置关系,能够让骨科医生直观地进行测量、术前设计甚至手术模拟[10-11]。本研究创新点主要是膝关节肿瘤假体周围骨折的病例首次采用更换股骨侧假体组配柄的方式进行手术,国内外均无类似病例;其次是成功地应用了3D打印技术进行辅助设计和精准的术前模拟,从而确保了手术的成功,这也是3D打印技术首次在该类手术中的应用。本研究通过探讨1例复杂的膝关节肿瘤假体股骨周围骨折,阐明利用3D打印技术对该病例进行术前设计、模拟以及假体组件和导航器的个体化定制的过程和优越性,为3D打印技术在该类手术中的应用提供参考。
1 临床资料 1.1 一般资料患者,32岁,女性。首次手术: 4年前因左大腿疼痛就诊,诊断为“左股骨软骨瘤”,行左股骨肿物切除术,术后疼痛和肿胀未缓解。第二次手术:3年前疼痛加重伴左下肢胀痛,就诊于当地医院,以 “左膝股骨远端肿瘤术后”收入院,行扩大肿物切除、人工肿瘤膝关节置换术,术后病理回报:左股骨骨肉瘤,术后患者功能康复良好。10个月前无明显诱因出现左大腿疼痛,活动时加重,休息后缓解。行X线检查提示:左膝关节置换术后股骨假体松动(图 1)。患者左下肢肿胀,外旋畸形,左大腿及膝关节较健侧明显肿胀,左膝关节前见长约25 cm的术后瘢痕,切口未见明显皮损,未见皮下瘀斑。左大腿中段压痛明显,可触及不规则肿物,质硬,活动度差。左膝关节因疼痛查体欠配合,屈伸活动明显受限,髋关节活动度尚可。左下肢间接长度较右下肢短缩约1 cm,左大腿围40 cm,右髋膝关节活动度正常,双侧足背动脉搏动良好,踝关节及各脚趾背伸良好,病理反射未引出。血常规和血沉检查结果均显示无感染征象。患者长期活动受限,行双下肢动静脉彩超,双侧下肢动静脉未见明显异常。
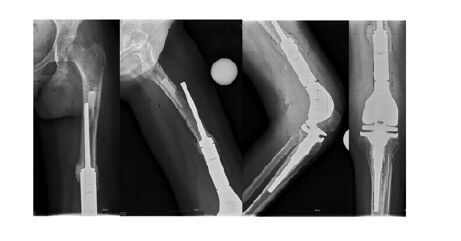
|
| 图 1 患者左膝关节正侧位X线片 Figure 1 Images of ateroposterior and lateral X-ray of left knee joint of patient |
|
|
取患者双下肢CT平扫数据,导入MIMICS 17.0软件(比利时Materialise 公司) 中,调整阈值,选取兴趣区域,为保证精度,对双侧股骨、胫腓骨和组配式的假体分别进行手工分离,而后将其三维重建(图 2,见插页四)。
1.2.2 测量方法测量患者双侧股骨长度和峡部髓腔粗细。重点测量患侧骨折位置的长度和残余股骨长度、股骨假体近端顶点的位置、组配式假体髁、股骨侧柄、延长杆等部分长度和直径。同时在软件中将患侧股骨剖开,测量患侧股骨髓腔在各个位置的粗细,注意区分假体近端的骨水泥,同时记录骨水泥的起止点,以便进行术中清除。
1.2.3 测量具体位置和结果股骨假体可拆卸的上段部分为119.9 mm,骨水泥顶部距离小转子下方为8.0 mm,到小转子顶点垂直距离为25.0 mm,骨水泥长度为65.0 mm。从小转子顶点到下端可用的骨质约为140.0 mm。残存髓腔最细部位为15.5 mm。假体近端凸出来的部分到顶端的直线距离为95.0 mm,残存完整骨质环的长度为31.5 mm,有骨折部位保留残存骨约为105.0 mm。正常侧的股骨峡部为13 mm,峡部到小转子下方约为10.0 cm,峡部到股骨髁远端中点约为200.0 mm(图 3,见插页四)。
1.2.4 设计方案针对患者组配式假体中其他部分仍能牢固固定,假体不易通过常规翻修方法取出,且本例患者为非感染病例,仅对骨折部位的组件部分进行替换。替换的柄在连接位置将按照原有的卡槽进行定制化设计(原厂家负责),其组配方式与现有短柄组配方式相同。材质与原假体部件一致,为钛金属。根据上述测量数据,将残余骨导入到UG NX 9.0软件中,根据残余骨上述解剖参数设计一根直径14.0 mm、长度190.0 mm的股骨侧假体柄毛坯,使得柄顶端距离梨状窝位置约1.0 cm。以20.0和28.0 mm处为中心位置设计与假体柄分别成90°和30°的6.0 mm钉孔。在所设计的钉孔位置和固定组件的螺钉位置基础上继续设计用于盲锁的导航器,便于术中进行安装。设计三维图定稿后作为进行假体组件定制的参考,由肿瘤膝关节假体原厂家按照参数完善工业设计。根据测量的骨皮质缺损大小进行同种异体骨的订购,确保同种异体骨骨板与该缺损的最佳匹配(图 4,见插页四)。
1.3 3D打印模型和术前匹配 1.3.1 3D打印模型打印方法将患者患侧股骨模型在mimics中与假体进行分割和去除噪点等处理后,导出STL文件。将STL文件导入到Magics RP中进行三角修复,调整角度,进行一个最佳角度的纵向剖开后,将剖开的2个骨片分别进行刻字标注和修复等操作,在2个骨片合适位置分别添加立柱和凹槽,使其能够完全拼接安装。添加支撑,进行打印。打印完成后对模型进行后处理。
1.3.2 模型与假体术前对比模拟将模型与定制好的假体进行匹配,假体可顺利插入模型中,钉道位置正常(图 5,见插页四)。
1.4 手术过程患者取股骨外侧切口,长约35cm,起自小粗隆水平,下至膝关节外侧,切开皮肤、皮下、阔筋膜,钝性分离股外侧肌纤维,向前后拉开,显露股骨,见股骨侧假体柄向前侧穿出股骨,见大量血性液体流出,留取细菌培养和病理标本。取下假体柄,清除瘢痕和增生骨性纤维组织。确认原肿瘤假体其余部分无松动后进行冲洗,其余部位不必进行替换重装。安装定制股骨侧髓内固定装置,导向器导向下植入股骨近端2枚锁钉,术中X线下确认匹配成功。将同种异体骨皮质骨板用3根钢丝固定于股骨前侧骨缺损处,固定确实后使用载有抗生素骨水泥覆盖假体表面,待骨水泥固化后,常规冲洗缝合创口。见图 6(插页四)和7。
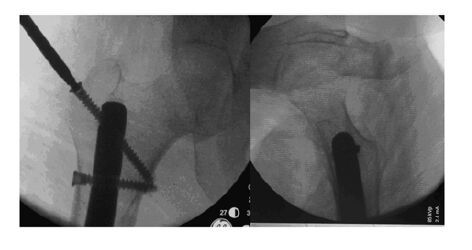
|
| 图 7 术中透视下用导航成功打钉 Figure 7 Successful nailing by navigator under intraoperative perspective |
|
|
送检假体周围增生纤维组织内可见大量急慢性炎细胞浸润,有出血、坏死及含铁血黄素沉着,有少量死骨形成,部分区域血管丰富,有肉芽组织形成。另一块假体外侧增生组织中可见骨组织及钙化(图 8A和B,见插页四),送检假体周围骨折部位组织液可见较多中性粒细胞、巨噬细胞及少量淋巴细胞,未见恶性肿瘤细胞(图 9,见插页四)。
1.6 随访结果患者术后X线正位片示:患侧下肢对位对线良好(图 10),双侧下肢长度基本相等,术后1个月随访时已能完成独立的下蹲动作,下蹲时膝关节弯曲角度约为80°,可借助双拐自行下地(图 11),患者MSTS93 评分从术前0分提高到术后1个月14分。
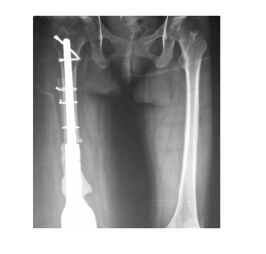
|
| 图 10 患者术后X线片 Figure 10 Postoperative X-ray imageof patient |
|
|

|
| 图 11 术后1个月随访外相 Figure 11 1months follow-up after operation |
|
|
肿瘤型膝关节股骨侧假体周围骨折的病例在国内外的报道较少,与较为常见的髋关节置换术后假体周围骨折比较,尤其是在涉及到股骨远端进行大范围切除后,其治疗难度更高。其常见原因包括肿瘤复发、感染、无菌性松动、假体周围骨折、假体柄折断和铰链结构失败等[12-13],除感染需先取出假体进行抗感染治疗而后二期翻修外,其他原因引起的翻修均可在一期完成。现有文献[14]也表明:股骨前弓可能会造成股骨髁上骨折,有10%~46%骨折发生在股骨前弓处,而3 mm 的前皮层缺损就会导致抗扭转骨的强度降低30%。在本病例中,首次手术的方案的失败主要是诊断不正确,从而导致手术切除的方式和范围有误。而第2次手术进行假体置换,术前术中检查均无感染征象,假体从股骨前侧凸出,其股骨假体周围骨折原因为机械作用,因股骨前弓角度与肿瘤假体股骨侧位置及弯曲角度匹配差造成的应力集中到顶端,造成股骨皮质慢慢被破坏。另外,根据术中病理检查,如有条件,应检测患者血清中金属离子水平等参数,以探究旋转铰链膝所造成的残渣是否引起了机体的反应[14]。
传统方式的手术是拍摄X线片后进行假体定制,定制的过程由器械公司的工程师进行单方面完成,没有与医生相互沟通的过程,其翻修时骨缺损后造成的残存骨段质量与预估不能完全符合,需准备套环以补偿长度,但牢固程度受影响,术者在术中半盲目操作。同时,导航器的制作也不能进行预先演练和模拟,忽略了肌肉等造成的影响。而在本次病例中,术者在电脑端即可完成初步的设计与装配审核,随后可以利用3D打印的模型和定制成功的假体进行模拟手术,模拟过程中可以验证定制假体柄的长度、直径、钉道位置、导航器的设计及同种异体骨形状的选择是否精准合理,术前即能明确整个手术流程和截骨范围,术中直接实施。
对于该例患者,国外有进行全股骨假体定制后置换的类似病例,以保证患者患侧股骨能够有足够强度的支撑[15]。但本例患者年纪较轻且股骨近端保留完整,肿瘤假体为组配式结构,故在此考虑将患者股骨侧假体进行替换,同时按照经验进行骨折部位的同种异体骨进行修复[16-18]。在以往的类似手术中,因为无法达到精准和个性化的设计,导致手术的方式方法受到限制,不能最大程度地完成医生保留患者股骨的需求,应用3D打印技术进行术前设计和手术模拟后,手术的精准性和可靠性都得到了提升,术后X线片可见患侧下肢对位对线良好,术后随访1个月患者下蹲也达到了比较满意的角度。该方案使手术过程及术后结果的水平较以往传统手术有了较大提升,该方法体现了其优越性的同时,也在高难手术中展现了其必要的一面。
综上所述,由于该患者的随访时间较短成为了该方法应用的局限,股骨残留的骨质能否提供有效的支撑与把持力,所选取同种异体骨能否弥补缺损部位并最终达到愈合效果,其长期结果疗效也有待验证。对于比较复杂的肿瘤膝关节股骨假体周围骨折的患者,可以采用计算机术前设计及手术模拟,自行设计假体组件,同时利用3D打印技术将患侧模型进行打印,术前与假体和导航器进行匹配,从而为获得一个精准可靠的手术结果提供保证。
| [1] | Barut N, Anract P, Babinet A, et al. Peri-prosthetic fractures around tumor endoprostheses:a retrospective analysis of eighteen cases[J]. Int Orthop , 2015, 39 (9) : 1851–1856. DOI:10.1007/s00264-015-2915-3 |
| [2] | Kolb K, Koller H, Lorenz I, et al. Operative treatment of distal femoral fractures above total knee arthroplasty with the indirect reduction technique:a long-term follow-up study[J]. Injury , 2009, 40 (4) : 433–439. DOI:10.1016/j.injury.2008.10.020 |
| [3] | Bagaria V, Deshpande S, Rasalkar DD, et al. Use of rapid prototyping and three-dimensional reconstruction modeling in the management of complex fractures[J]. Eur J Radiol , 2011, 80 (3) : 814–820. DOI:10.1016/j.ejrad.2010.10.007 |
| [4] | Hughes A, Soden P, Abdulkarim A, et al. The use of rapid prototyping and 3D printing in revision hip arthroplasty[J]. Bone Joint J Orthop Proceed Supplement , 2014, 96 : 2. |
| [5] | Buller L, Smith T, Bryan J, et al. The use of patient-specific instrumentation improves the accuracy of acetabular component placement[J]. JArthroplasty , 2013, 28 (4) : 631–636. DOI:10.1016/j.arth.2012.12.001 |
| [6] | Li Z, Li Z, Xu R, et al. Three-dimensional printing models improve understanding of spinal fracture-A randomized controlled study in China[J]. Sci Rep , 2015, 5 : 11570. DOI:10.1038/srep11570 |
| [7] | Walch G, Vezeridis PS, Boileau P, et al. Three-dimensional planning and use of patient-specific guides improve glenoid component position:an in vitro study[J]. JShoulder Elbow Surg , 2015, 24 (2) : 302–305. DOI:10.1016/j.jse.2014.05.029 |
| [8] | Saji H, Kato Y, Shimada Y, et al. Three-dimensional multidetector computed tomography may aid preoperative planning of the transmanubrial osteomuscular-sparing approach to completely resect superior sulcus tumor[J]. Gen Thorac Cardiovasc Surg , 2015, 63 (11) : 627–631. DOI:10.1007/s11748-013-0368-4 |
| [9] | Kawasaki Y, Takahashi M, Yasui N. Three-dimensional computed tomography assessment and planning for severe lower limb deformities:a case report of bilateral fibular hemimelia[J]. Open J Orthop , 2013, 3 : 167–171. DOI:10.4236/ojo.2013.33030 |
| [10] | Blakeney WG, Day R, Cusick L, et al. Custom osteotomy guides for resection of a pelvic chondrosarcoma[J]. Acta Orthop , 2014, 85 (4) : 438–441. DOI:10.3109/17453674.2014.920988 |
| [11] | Cartiaux O, Paul L, Francq BG, et al. Improved accuracy with 3D planning and patient-specific instruments during simulated pelvic bone tumor surgery[J]. Ann Biomed Eng , 2014, 42 (1) : 205–213. DOI:10.1007/s10439-013-0890-7 |
| [12] | Choy WS, Kim KJ, Lee SK, et al. Surgical treatment of pathological fractures occurring at the proximal femur[J]. Yonsei Med J , 2015, 56 (2) : 460–465. DOI:10.3349/ymj.2015.56.2.460 |
| [13] | Pala E, Trovarelli G, Calabro T, et al. Survival of modern knee tumor megaprostheses:failures, functional results, and a comparative statistical analysis[J]. Clin Orthop Relat Res , 2015, 473 (3) : 891–899. DOI:10.1007/s11999-014-3699-2 |
| [14] | Friesenbichler J, Sadoghi P, Maurer-Ertl W, et al. Serum metal ion concentrations in paediatric patients following total knee arthroplasty using megaprostheses[J]. BioMed Res Inter , 2014, 2014 : 817257. |
| [15] | Sevelda F, Schuh R, Hofstaetter JG, et al. Total femur replacement after tumor resection:limb salvage usually aachieved but complications and failures are common[J]. Clin Orthop Relat Res , 2015, 473 (6) : 2079–2087. DOI:10.1007/s11999-015-4282-1 |
| [16] | Maimaitiyiming A, Amat A, Rehei A, et al. Treatment of the femoral shaft nonunion with double plate fixation and bone grafting:A case series of 14 patients[J]. Injury , 2015, 46 (6) : 1102–1107. DOI:10.1016/j.injury.2015.01.009 |
| [17] | Dargan D, Jenkinson MJ, Acton JD. A retrospective review of the Dall-Miles plate for periprosthetic femoral fractures:twenty-seven cases and a review of the literature[J]. Injury , 2014, 45 (12) : 1958–1963. DOI:10.1016/j.injury.2014.08.034 |
| [18] | Parvizi J, Mortazavi SMJ. Massive femoral bone loss:solutions of last resort[J]. Semin Arthroplasty , 2010, 21 (1) : 51–56. DOI:10.1053/j.sart.2009.12.022 |
 2016, Vol. 42
2016, Vol. 42


