扩展功能
文章信息
- 田佳怡, 朱彤, 王健, 房明丽, 严超英
- TIAN Jiayi, ZHU Tong, WANG Jian, FANG Mingli, YAN Chaoying
- CD14和IL-8基因多态性与新生儿坏死性小肠结肠炎易感性的关联性分析
- Analysis on association between polymorphism of CD14 and IL-8 gene and susceptibilityof necrotizing enterocolitis
- 吉林大学学报(医学版), 2016, 42(05): 958-962
- Journal of Jilin University (Medicine Edition), 2016, 42(05): 958-962
- 10.13481/j.1671-587x.20160523
-
文章历史
- 收稿日期: 2016-04-08
2. 吉林大学第一医院儿科研究所, 吉林 长春 130021
2. Pediatrics Research Institute, First Hospital, Jilin University, Changchun 130021, China
新生儿坏死性小肠结肠炎(necrotizing enterocolitis ,NEC)是新生儿重症监护室中常见的急性肠道炎症性疾病,尤以早产儿多见。随着新生儿诊治技术的不断改进,早产儿存活率逐年提高,因此NEC的发生率也逐渐上升。在新生儿中NEC的发生率为1‰~3‰,而极低出生体质量儿(出生体质量≤1500 g)中NEC的发生率约为12%,40%的严重病例需手术治疗,其中50%的术后患儿面临肠粘连和短肠综合征等手术后遗症,30%的手术后遗症患者可导致死亡 [1-2] 。NEC起病隐匿,进展急骤,预后差,治疗时间长,主要表现为腹胀、呕吐及血便,严重时可出现肠穿孔、脓毒血症、全身休克及弥漫性血管内凝血等[3]。目前,NEC的发病机制尚未明确。研究 [4-5]表明:细菌定植等高危因素引发的肠道局部炎症级联反应是促使NEC发生和发展的重要因素之一。但是,临床工作发现: 不同的患者即使暴露于相同的条件下,仅有一部分新生儿发生NEC,且病情进展速度、严重程度及对治疗的反应也有很大差异,说明遗传背景对NEC的发病和进展起到重要作用。
白细胞分化抗原14(cluster of differentiation antigen 14,CD14)参与介导革兰阴性菌细胞壁脂多糖(LPS)引起的炎症细胞活化,使效应细胞产生白细胞介素(IL-1、IL-6和IL-8)和肿瘤坏死因子(TNF-α)等促炎因子,从而导致炎症级联反应 [6] 。研究[7-8]发现:CD14-159C/T基因多态性与败血症和炎症性肠病等疾病易感性有关。IL-8是中性粒细胞和淋巴细胞的主要趋化因子,参与调节各类炎症反应。研究[9-10]表明:IL-8的浓度在炎症性肠病 和NEC患者组织样本中明显升高,且与炎症性肠病患者肠道炎症的分级呈密切相关。研究[11] 证明:IL-8基因在其转录起始点-251处存在A/T基因多态性,该多态性位点与溃疡性结肠炎等疾病的发生风险存在关联性 。
目前,国内外对炎症因子基因多态性和NEC关系的研究较多,有学者认为髓样分化蛋白2(MD-2)与NEC发病的严重程度相关,神经节苷脂GM2激活物(GM2A)与NEC的易感性相关 [12] ,Szebeni等 [13] 研究显示CD14-159C/T与NEC易感性可能无关联。然而国内尚无CD14-159C/T和IL-8-251A/T基因多态性与NEC是否存在关联的相关研究报道。本研究通过检测NEC组和对照组新生儿CD14-159C/T和IL-8-251A/T基因多态性,探讨二者与NEC的关系,并从基因水平探讨NEC的易感因素,为研究NEC的遗传学发病机制提供理论基础。
1 资料与方法 1.1 研究对象所有研究对象均来源于2015年4—12月吉林大学第一医院新生儿科住院患儿。病例组纳入标准:临床诊断符合NEC,且Bell分级 [14] 在Ⅱ级以上。排除标准:①患儿存在以下胃肠道疾病。胃肠道畸形如先天性肠闭锁、先天性巨结肠、过敏性肠炎、感染性腹泻和中毒性肠麻痹;②败血症患儿;③严重贫血及DIC患儿;④呼吸道、心、脑和肾脏畸形等先天性畸形患儿。对照组选取同期住院患儿,且住院期间未患有NEC,排除胃肠道炎症畸形、败血症、严重贫血、弥漫性血管内凝血(DIC)及呼吸道、心、脑、肾脏等先天性畸形患儿。
1.2 主要试剂和仪器高压灭菌锅(南京荣华科学器材有限公司),PCR仪(上海德沃斯科技仪器有限公司),Tanon凝胶成像系统(上海企伟实业有限公司),引物和2×EasyTag PCR SuperMix(上海生物工程有限公司),血液基因组柱式小量提取试剂盒(0.1~1.0mL)(北京康为世纪公司)。
1.3 样本采集与保存采取各组研究对象静脉血1 mL,置于EDTAK2抗凝管中,暂存于4℃冰箱中,若长时间保存则放于-80℃冰箱。
1.4 基因组DNA提取研究对象的外周血基因组DNA的提取应用BloodGen Mini Kit血液基因组柱式小量提取试剂盒。实验步骤:向血液样本中加入缓冲液和蛋白酶,震荡后56℃孵育10 min后加入无水乙醇并转移到收集管的吸附柱中,经缓冲液洗涤离心后,溶解获得吸附柱中的DNA(具体操作步骤见BloodGen Mini Kit血液基因组柱式小量提取试剂盒说明书)。
1.5 引物设计与合成查阅PubMed-SNP数据库中CD14-159C/T和IL-8-251A/T基因位点两侧的基因序列,应用Primer Premier 5.0软件设计引物如下,CD14引物:上游引物,5′-GGTGCCAACAGATGAGGTTCAC-3′,下游引物,5′-TTCT-TTCCTACACAGCGGCAC-3′;IL8基因引物:上游引物,5′-TTCTAACACCTGCCACTC-3′,下游引物,5′-TTGTGTGCTCTGCTGTC-3′。引物由上海生工生物工程有限公司合成。
1.6 聚合酶链式反应(PCR)扩增目的基因片段PCR反应体系:DNA模板100 ng,上游引物1μL,下游引物1μL,2×Easy Tag PCR mix 25μL,将体系体积用蒸馏水补足至50μL。PCR反应条件:95℃预变性5 min,94℃变性45 s,58℃退火1 min,72℃延伸1 min,循环数为30,最终延伸72℃,10 min。
1.7 Sanger法检测CD14/-159、IL-8/-251基因多态性位点将扩增后的DNA片段送至上海生物工程有限公司,应用Sanger法进行测序,检测基因序列观察位点的突变情况。
1.8 统计学分析采用SPSS 19.0统计软件对数据进行分析处理。采用拟合优度χ2检验分析研究对象2种基因位点的基因型频数分布是否符合Hardy-Weinberg平衡定律。出生体质量和胎龄等计量资料以 x±s 表示,两两比较采用t检验; 性别、基因型和等位基因频数等计数资料以百分率表示,采用χ2检验。以P<0.05 表示差异有统计学意义。
2 结 果 2.1 研究对象的基本情况本研究纳入的研究对象共69例,其中对照组新生儿共41例,男性24例,女性17例,胎龄(32.41±1.79)周,体质量(1.86±0.41)kg;NEC组患者28例,男性18例,女性10例,胎龄(32.30±2.10)周,体质量(1.71±0.34)kg,无死亡病例。所有研究对象均符合纳入和排除标准。2组研究对象基本情况比较差异无统计学意义(P>0.05),具有可比性。见表 1。
| (x±s) | ||||
| Group | Sex[n/(η/%)] | Gestational age (x±s,week) | Birth weight (x±s,m/kg) | |
| Male | Female | |||
| Control | 24(58.5) | 17(41.5) | 32.41±1.79 | 1.86±0.41 |
| NEC | 18(64.2) | 10(35.8) | 32.30±2.10 | 1.71±0.34 |
应用拟合优度χ2检验,在病例组和对照组中基因型频数分布比较差异无统计学意义(P>0.05),表明研究对象符合Hardy-Weinberg平衡定律,本研究资料具有群体代表性(表 2)。
| Group | n | CD14-159C/T | χ2 | P | IL-8-251A/T | χ2 | P | ||||||||||||
| Observed | Expected | Observed | Expected | ||||||||||||||||
| C/C | C/T | T/T | C/C | C/T | T/T | A/A | A/T | T/T | A/A | A/T | T/T | ||||||||
| Control | 41 | 12 | 16 | 13 | 9.8 | 20.5 | 10.8 | 2.0 | 0.4 | 8 | 20 | 13 | 7.9 | 20.2 | 12.9 | 0.004 | 1 | ||
| NEC | 28 | 5 | 10 | 13 | 3.6 | 12.9 | 11.6 | 1.4 | 0.5 | 2.0 | 11.0 | 15.0 | 2.0 | 11.0 | 15.0 | 7.40E-05 | 1 | ||
以提取的基因组为模板,通过PCR法分别扩增CD14/-159区域与IL-8/-251区域的DNA片段。将扩增的CD14/-159区域的DNA片段与IL-8/-251区域的DNA片段分别进Sanger法测序,结果显示:人类基因组CD14-159 位点3种基因型分别为CD14-159 C/C、 CD14-159 C/T和CD14-159 T/T,人类基因组IL-8-251位点有3种基因型分别为IL-8-251A/A、 IL-8-251A/T和IL-8-251T/T。
2.4 2组研究对象CD14/-159基因等位基因和基因型频数分布2组研究对象基因型和等位基因频数分布比较差异无统计学意义(χ2=2.31,P=0.13)。见表 3。
| [n(η/%)] | |||||||
| Group | n | Allelic frequency | Genotypic frequency | ||||
| C | T | C/C | C/T | T/T | |||
| Control | 41 | 40 (46.5) | 42 (53.5) | 12(29.3) | 16(39.0) | 13(31.7) | |
| NEC | 28 | 20 (35.7) | 36 (64.3) | 5(17.9) | 10(35.7) | 13(46.4) | |
| χ2 | 2.31 | 1.89 | |||||
| P | 0.13 | 0.39 | |||||
2组研究对象基因型频数分布比较差异无统计学意义(P>0.05)。NEC组IL-8-251A/T位点的T等位基因频数分布高于对照组(χ2=4.18,P=0.04,OR=2.14,95%CI:1.03~4.46)。见表 4。
| [n(η/%)] | |||||||
| Group | Allelic frequency | Genotypic frequency | |||||
| A | T | A/A | A/T | T/T | |||
| Control | 41 | 36 (43.9) | 46 (56.1) | 8(19.5) | 20(48.8) | 13(31.7) | |
| NEC | 28 | 15 (26.8) | 41 (73.2) | 2(7.1) | 11(39.3) | 15(53.6) | |
| χ2 | 4.18 | 4.05 | |||||
| P | 0.04 | 0.13 | |||||
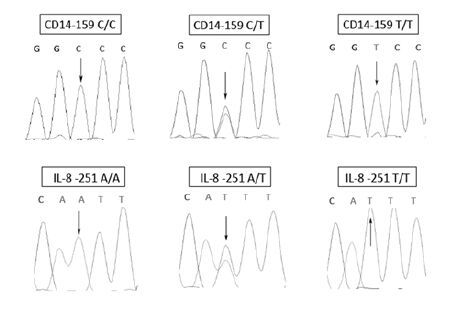
|
| 图 1 CD14-159 C/T区域和IL-8 -251A/T区域的测序峰图 Figure 1 Part of sequencing figure of CD14-159 C/T and IL-8 -251A/T site |
|
|
NEC是新生儿重症监护室中常见的肠道疾病,尤其在低出生体质量和极低出生体质量的早产儿中具有较高发病率和致死率,但是NEC的发病机制尚不明确。目前认为早产、缺氧、肠道喂养和细菌感染等是NEC的高危因素,最终通过产生炎症级联反应造成肠道损伤。正常母乳喂养的足月新生儿在生后1周后即有双歧杆菌和乳酸菌在肠道定植。然而,住院患儿或极低出生体质量儿正常肠道菌群建立较晚,且易发生菌群失调,促使了肠道致病菌群的增殖和移位,减少了抗炎效应和黏膜的防御能力,易造成NEC的发生。
CD14可以与革兰阴性菌细胞壁成分脂多糖(LPS)结合,通过激活LPS在免疫细胞上的受体TLR4最终激活NFκB,促使包括IL-1、IL-6、IL-8和TNF-α等细胞因子的转录,释放大量细胞因子,是炎症反应的关键分子。CD14基因位于5号常染色体的长臂端5q23-31,约含有1338个核苷酸残基,在CD14基因启动子区域上游的-159位点存在C/T多态性,可能影响CD14的表达水平,从而参与相关疾病的发生发展。本研究在28例NEC新生儿和41例对照组新生儿中均检测到CD14-159C/T突变位点,发现NEC组CD14-159C/T位点的T等位基因和T/T基因型频数分布高于对照组,这与Szebeni等 [13] 研究结果相似,说明CD14-159C/T单核苷酸多态性可能与NEC的易感性无关。
IL-8是多功能的细胞因子,在炎症中起到重要的调控作用。IL-8可由单核细胞、巨噬细胞、中性粒细胞、纤维细胞和角质细胞等多种细胞分泌,对中性粒细胞有较强的趋化作用,并能诱导T细胞迁移。研究[15-17] 表明:在NEC患者外周血中IL-8水平明显升高。IL-8基因位于人染色体4q13-21,位于转录起始位点的-251A/T单核苷酸多态性可影响IL-8的转录和表达。本研究结果发现:2组研究对象IL-8-251A/T位点基因型频数分布比较差异无统计学意义,而NEC组患儿IL-8-251A/T位点的等位基因频数分布高于对照组,说明IL-8-251 T等位基因与NEC易感性有关。提示在NEC的发生中,携带有IL-8-251 T等位基因个体,在受到外界各种因素刺激下,产生的炎症反应较强,从而增加了NEC的易感性。该研究结果可为进一步了解NEC发病机制提供新的思路,在早产儿NEC的预防方面起到指导作用。
综上所述,CD14-159C/T位点的单核苷酸多态性与NEC易感性可能无关,而可能与IL-8基因的-251 T位点关联,但是本研究纳入的病例数较少,仍需扩大样本量进一步研究证实。
| [1] | Meng D, Zhu W, Shi HN, et al. Toll-like receptor-4 in human and mouse colonic epithelium is developmentally regulated:a possible role in necrotizing enterocolitis[J]. Pediatr Res , 2015, 77 (3) : 416–424. DOI:10.1038/pr.2014.207 |
| [2] | Neu J, Mshvildadze M, Mai V. A roadmap for understanding and preventing necrotizing enterocolitis[J]. Curr Gastroenterol Rep , 2008, 10 (5) : 450–457. DOI:10.1007/s11894-008-0084-x |
| [3] | Tian JY, Yang ZG, Peng LP, et al. Toll-like receptors, crucial role in the progress of Necrotizing Enterocolitis[J]. Eur J BioMed Res , 2015, 1 (1) : 8–16. DOI:10.18088/ejbmr.1.1.2015.pp8-16 |
| [4] | 刘素佳, 杨长仪, 陈涵强. 新生儿坏死性小肠结肠炎相关炎性标志物研究进展[J]. 中国新生儿科杂志 , 2015, 30 (6) : 468–471. |
| [5] | Terrin G, Scipione A, De Curtis M. Update in pathogenesis and prospective in treatment of necrotizing enterocolitis[J]. Biomed Res Int , 2014, 2014 : 543765. |
| [6] | Hooper LV. Epithelial cell contributions to intestinal immunity[J]. Adv Immunol , 2015, 126 : 129–172. DOI:10.1016/bs.ai.2014.11.003 |
| [7] | De Aguiar BB, Girardi I, Paskulin DD, et al. CD14 expression in the first 24h of sepsis:effect of-260C>T CD14 SNP[J]. Immunol Invest , 2008, 37 (8) : 752–769. DOI:10.1080/08820130802403242 |
| [8] | Wang Z, Hu J, Fan R, et al. Association between CD14 gene C-260T polymorphism and inflammatory bowel disease:a meta-analysis[J]. PLoS One , 2012, 7 (9) : e45144. DOI:10.1371/journal.pone.0045144 |
| [9] | Mazzucchelli L, Hauser C, Zgraggen K, et al. Expression of interleukin-8 gene in inflammatory bowel disease is related to the histological grade of active inflammation[J]. Am J Pathol , 1994, 144 (5) : 997–1007. |
| [10] | Benkoe T, Reck C, Gleiss A, et al. Interleukin 8 correlates with intestinal involvement in surgically treated infants with necrotizing enterocolitis[J]. J Pediatr Surg , 2012, 47 (8) : 1548–1554. DOI:10.1016/j.jpedsurg.2011.11.049 |
| [11] | 梁万东, 李劲松, 李克深, 等. IL-8基因多态性与中国人群炎症性肠病风险的相关性[J]. 中华医学杂志 , 2011, 91 (26) : 1825–1829. |
| [12] | 袁媛, 周伟, 袁伟明, 等. MD-2和GM2A基因多态性与新生儿坏死性小肠结肠炎的关系[J]. 中国新生儿科杂志 , 2015, 30 (1) : 3–8. |
| [13] | Szebeni B, Szekeres R, Rusai K, et al. Genetic polymorphisms of CD14, toll-like receptor 4, and caspase-recruitment domain 15 are not associated with necrotizing enterocolitis in very low birth weight infants[J]. J Pediatr Gastroenterol Nutr , 2006, 42 (1) : 27–31. DOI:10.1097/01.mpg.0000192246.47959.b2 |
| [14] | 邵肖梅, 叶鸿瑁, 丘小汕. 实用新生儿学[M]. 4版. 北京: 人民卫生出版社 ,2012 : 477 -483. |
| [15] | Benkoe T, Reck C, Gleiss A, et al. Interleukin 8 correlates with intestinal involvement in surgically treated infants with necrotizing enterocolitis[J]. J Pediatr Surg , 2012, 47 (8) : 1548–1554. DOI:10.1016/j.jpedsurg.2011.11.049 |
| [16] | Hu Y, Zhou J, Ye F, et al. BRD4 inhibitor inhibits colorectal cancer growth and metastasis[J]. Int J Mol Sci , 2015, 16 (1) : 1928–1948. DOI:10.3390/ijms16011928 |
| [17] | Qiu Y, Hu Y, Zhang ZY, et al. Genetic association of osteopontin(OPN) and its receptor CD44 genes with susceptibility to Chinese gastric cancer patients[J]. J Cancer Res Clin Oncol , 2014, 140 (12) : 2143–1256. DOI:10.1007/s00432-014-1761-9 |
 2016, Vol. 42
2016, Vol. 42


