扩展功能
文章信息
- 曹让娟, 李凯, 邢琬莹, 王悦书, 于维, 吴广智, 崔树森, 李强
- CAO Rangjuan, LI Kai, XING Wanying, WANG Yueshu, YU Wei, WU Guangzhi, CUI Shusen, LI Qiang
- Disabled-1在人乳腺癌细胞中的表达及其对细胞周期的影响
- Expression of Disabled-1 in human breast cancer cells and its role in cell cycle
- 吉林大学学报(医学版), 2016, 42(05): 932-936
- Journal of Jilin University (Medicine Edition), 2016, 42(05): 932-936
- 10.13481/j.1671-587x.20160518
-
文章历史
- 收稿日期: 2016-04-12
2. 吉林大学中日联谊医院麻醉科, 吉林 长春 130033;
3. 吉林大学中日联谊医院乳腺外科, 吉林 长春 130033
2. Department of Anesthesiology, China-Japan Union Hospital, Jilin University, Changchun 130033;
3. Department of Breast Surgery, China-Japan Union Hospital, Jilin University, Changchun 130033, China
Dab1(Disabled-1,Dab1)基因编码含有555个氨基酸的细胞内重要的衔接蛋白,其N端具有磷酸酪氨酸结合/蛋白相互作用结构域(PTB/PI domain),该结构域可与多个含有NPxY的跨膜蛋白结合[1]。现有的关于Dab1的功能研究主要集中在神经系统发育中,其在肿瘤中作用的研究较少。人类的Dab1基因位于1p32.2染色体环的不稳定区域(普通型脆性位点,common fragile sites,CFS),即基因缺失和修饰活跃区域,其在脑胶质瘤和子宫内膜癌中表达下调[2],但关于Dab1在乳腺癌进程中的作用并不十分清楚,尚未见相关文献报道。本研究检测Dab1基因在乳腺癌细胞中的表达情况及在乳腺癌BT-549细胞中外源过表达Dab1后其对细胞周期的影响,探讨Dab1与乳腺癌发生发展的关系。
1 材料与方法 1.1 细胞、主要试剂和仪器人正常乳腺上皮细胞MCF-10A,乳腺癌细胞系MCF-7、BT-549和MDA-MB-231购自上海细胞库。胎牛血清、马血清、MEM培养基、DMEM/F12培养基、RPMI-1640培养基和EDTA-胰酶购于美国Gibco公司;L15培养基、细胞因子EGF、糖皮质激素、霍乱毒素、胰岛素、鼠源Actin单克隆抗体、青霉素和链霉素等购于美国Sigma公司;兔源Dab1抗体购于Millipore公司;Lipofectamine 2000和PI染色试剂盒购于美国Invitrogen公司;M-MLV逆转录试剂盒购于美国Promega公司;SYBR染料法荧光定量试剂盒购于日本TaKaRa公司;pKH3和pKH3-Dab1质粒由Peggy教授惠赠。StepOne PlusTM(美国ABI公司),Bio-Rad垂直电泳槽(ZY057912)和转印槽(ZY057909)(美国Bio-Rad公司),流式细胞仪(FACSCalibur,美国BD公司)。
1.2 细胞培养和转染MCF-10A培养基为DMEM/F12,同时添加5%马血清、20 μg·L -1细胞因子 EGF、0.5 mg·L-1糖皮质激素,100 μg·L-1 霍乱毒素,10 mg·L-1胰岛素及青霉素和链霉素;MCF-7和BT-549细胞用含有10%胎牛血清的MEM及RPMI-1640培养基,在37℃、5% CO2的培养箱中培养。MDA-MB-231细胞用含有10%L15的培养基在37℃、无CO2的培养箱中培养[3]。当细胞贴壁生长达到板底的80%~90%时进行胰酶消化,吹散为单细胞,1 000 r·min-1离心,培养基重悬后传代培养。对数生长期的细胞,按照每孔1×105个细胞接种到6孔板,12~16 h后进行Lipofectamine 2000转染。250 μLopti-MEM中加入4 μg pKH3或pKH3-Dab1质粒,轻轻混匀;再取250 μL opti-MEM,加入10 μL Lipofectamine 2000,轻轻混匀,室温静止5 min。轻轻混匀Lipofectamine 2000和稀释的质粒,室温静止15 min,轻轻滴加到细胞培养板中,37℃、5% CO2的培养箱中培养[4]。4~6 h后更换新鲜培养基,36 h后进行流式细胞术检测。
1.3 Real-timePCR检测Dab1mRNA表达 ① RNA提取:细胞长满到80%~90%时,Trizol试剂盒提取细胞中总RNA,纯化后溶解在DEPC水中,分光光度计测量RNA的浓度及其纯度[A(260/280)值介于1.8~2.0]。② cDNA合成:采用M-MLV逆转录试剂盒,取1 μg提取的总RNA到DEPC处理过的PCR小管,置于70℃的热水浴中孵育10 min后分别加入反转录5×缓冲液、dNTP混合物、核苷酸酶抑制剂、M-MLV反转录酶和随机引物,42℃孵育30 min,95℃ 、5 min,4℃、5 min,反转录的cDNA可以直接用于PCR或于-20℃保存。③Real-time PCR反应:选用SYBR染料法荧光定量试剂盒,引物序列:Dab1基因正向引物,5′-AACCAGCGCCAAGAAAGACT-3′,反向引物,5′-GCAACAACGCCCTTGAGTTT-3′;Actin基因正向引物,5′-AGCCTCGCCTTTGCCGA-3′,反向引物,5′-CTGGTGCCTGGGGCG-3′;20 μL反应体系:SYBR Premiex 10 μL,正向、反向引物各0.4 μL,ROX Dye Ⅱ 0.4 μL,DNA模板1.0 μL (50~100 ng),蒸馏水7.8 μL。反应条件:95℃、30 s,95℃、5 s,60℃、 35 s,95℃、 15 s,60℃、60 s,95℃、15 s,40个循环。获得Ct值后,按照2-ΔΔCt法计算Dab1mRNA相对表达水平,将MCF-10A细胞中Dab1表达水平标准化为1。
1.4 Westernblotting检测Dab1蛋白表达水平 收集融合度为80%~90%的细胞,PBS洗2次,预冷的RIPA蛋白裂解液提取细胞总蛋白,离心取上清,测定蛋白浓度,加入5×loading buffer,沸水中煮5 min。配制10%分离胶,5%浓缩胶,每孔上样量60 μg。5% BSA封闭结束后,一抗Dab1(1∶1 000)和Actin(1∶3 000)于4℃过夜,TBST洗3次,加入相应二抗,室温1 h,TBST洗3次,ECL发光底物进行曝光检测目的条带。 Gel-pro analyzer对条带进行积分光密度(IA)分析,以Actin为对照,获得MCF-10A、MCF-7、BT-549和MDA-MB-231的比值(IADab1/IAActin)。
1.5 流式细胞术检测细胞周期收集细胞,预冷PBS洗2次,预冷70%乙醇4℃固定过夜,离心收集细胞,预冷PBS洗1次,加入500 μL含50 mg·L-1溴化乙锭(PI)的PBS缓冲液,加入100 mg·L-1RNase A和0.2% Triton X-100,4℃避光孵育30 min,流式细胞术检测分析细胞周期分布。
1.6 统计学分析采用SPSS 17.0统计软件进行统计学分析。各组细胞中Dab1 mRNA和蛋白相对表达水平以x±s表示,多组间样本均数比较采用单因素方差分析。以P<0.05表示差异有统计学意义。
2 结 果 2.1 Dab1在乳腺癌细胞中的表达水平Real-time PCR法检测结果显示:将正常乳腺上皮细胞MCF-10A中Dab1mRNA表达水平标准化为1,MCF-7、BT-549和MDA-MB-231中Dab1mRNA相对表达水平分别为0.504±0.037、0.302±0.027和0.33±0.031(图 1A);与MCF-10A细胞比较,MCF-7、BT-549和MDA-MB-231细胞中Dab1 mRNA表达水平明显下调(P<0.05)。Western blotting法检测结果显示:MCF-10A细胞中有较丰富的Dab1表达,而MCF-7、BT-549和MDA-MB-231细胞中Dab1表达水平较低(图 1B)。Gel-Pro analyzer对条带进行光密度分析,以Actin为对照,MCF-10A、MCF-7、BT-549和MDA-MB-231的IA比值分别为0.227±0.021、0.134±0.014、0.076±0.010和0.074±0.005;与MCF-10A细胞 比较,MCF-7、BT-549和MDA-MB-231细胞中Dab1蛋白表达水平明显降低(P<0.05)(图 1C)。
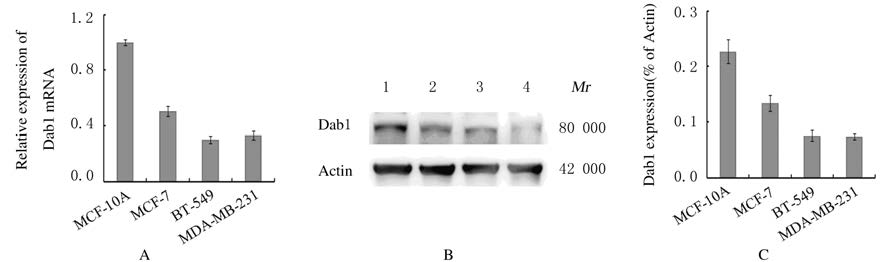
|
| 图 1 Dab1在乳腺癌细胞中的表达 Figure 1 Expressions of Dab1 in human breast cancer cells |
|
|
Western blotting 法检测结果表明:BT-549细胞转染pKH3-Dab1后,Dab1蛋白表达水平升高(图 2A)。将未处理的对照组、转染pKH3组及转染pKH3-Dab1组BT-549细胞进行流式细胞术检测,结果显示:与对照组(29.29%)和转染pKH3组(37.12%)比较,转染pKH3-Dab1组BT-549细胞G1期百分比(56.58%)增加,出现G1期阻滞(图 2B)。

|
| 图 2 各组细胞中Dab1蛋白表达和细胞周期改变 Figure 2 Expressions of Dab1 in cells and changes of cell cycle in various groups |
|
|
目前,关于Dab1功能的研究主要集中在大脑皮层发育过程中神经元的迁移和定位上。Dab1在发育的中枢神经系统中高表达,是Reelin信号通路中的关键成员[5],可维持微管稳定性、促进皮层神经元的迁移[6]。然而,Dab1在肿瘤中的作用研究较少。已有研究[7-10]表明:一些与微管稳定性相关的蛋白,如MAP-2、LC3、Tau 和CDK5等在肿瘤的生长或转移中发挥着重要的作用。因此,推测Dab1可能与肿瘤的发生发展相关。
McAvoy等[2]报道:Dab1基因定位于一个大的基因组不稳定区域,该区域为基因缺失和修饰活跃区,相似基因如FHIT (1.5 Mb)、WWOX (1.0 Mb)、 GRID2 (1.36 Mb)、PARK2 (1.3 Mb)和RORA (730 kb)等,这些基因在许多肿瘤中呈失活状态,其中FHIT和WWOX已经被证明为抑癌基因。因此,定位于染色体环1p32.2CFS区域的Dab1基因是否也有抑癌基因的作用值得深入探究。已有文献[2]初步报道了Dab1在脑胶质瘤和子宫内膜癌中表达下调,但至今为止,关于Dab1在乳腺癌细胞中的表达情况及其对乳腺癌进程的作用并不十分清楚。
本研究利用Real-time PCR和Western blotting法,分别在mRNA和蛋白水平对Dab1的表达进行检测,所选用细胞系分别为正常的乳腺上皮细胞系MCF-10A[11]、恶性度较低的MCF-7[12]、恶性度高的BT-549和MDA-MB-231细胞[13-14],结果显示:正常乳腺上皮细胞中Dab1表达丰富,恶性度较低的MCF-7中表达下调,恶性度高的BT-549和MDA-MB-231中下调幅度更大。本研究结果表明:Dab1在乳腺癌细胞中表达 下调,且初步提示Dab1的表达与乳腺癌恶性度密切相关,目前尚未有关于Dab1与肿瘤恶性程度存在相关性的报道,这一创新性发现将在后期大量的临床乳腺癌组织样本中进行验证。
在细胞中过表达Dab1可抑制肿瘤细胞的生长[2]。因此,本文作者进一步对Dab1的作用机制进行深入研究: 将外源Dab1基因转入BT-549细胞,在确定BT-549细胞中外源Dab1表达后,采用流式细胞术检测细胞周期的变化。本研究结果显示:转染pKH3空载体的细胞与未处理细胞周期分布相似,而转染pKH3-Dab1的细胞出现G1期阻滞,说明Dab1在正常细胞中的表达对调控细胞的正常周期发挥着必不可少的作用。
综上所述,Dab1在乳腺癌中表达下调,且Dab1对正常细胞周期发挥调控作用,提示Dab1是一个潜在的抑癌基因,可能为肿瘤治疗的新靶点。但关于Dab1的表达趋势在临床乳腺癌组织中是否一致以及Dab1表达下调的机制、下调的Dab1对乳腺癌细胞周期的具体作用机制等仍需进一步探讨。
| [1] | Tissir F, Goffinet AM. Reelin and brain development[J]. Nat Rev Neurosci , 2003, 4 (6) : 496–505. DOI:10.1038/nrn1113 |
| [2] | McAvoy S, Zhu Y, Perez DS, et al. Disabled-1 is a large common fragile site gene, inactivated in multiple cancers[J]. Gene Chromosome Canc , 2008, 47 (2) : 165–174. DOI:10.1002/(ISSN)1098-2264 |
| [3] | Cao R, Chen J, Zhang X, et al. Elevated expression of myosin X in tumours contributes to breast cancer aggressiveness and metastasis[J]. Br J Cancer , 2014, 111 (3) : 539–550. DOI:10.1038/bjc.2014.298 |
| [4] | Xiao Z, Li CH, Chan SL, et al. A small-molecule modulator of the tumor-suppressor miR34a inhibits the growth of hepatocellular carcinoma[J]. Cancer Res , 2014, 74 (21) : 6236–6247. DOI:10.1158/0008-5472.CAN-14-0855 |
| [5] | Trotter J, Lee GH, Kazdoba TM, et al. Dab1 is required for synaptic plasticity and associative learning[J]. J Neurosci , 2013, 33 (39) : 15652–15668. DOI:10.1523/JNEUROSCI.2010-13.2013 |
| [6] | Stranahan AM, Erion JR, Wosiski-kuhn M. Reelin signaling in development, maintenance, and plasticity of neural networks[J]. Ageing Res Rev , 2013, 12 (3) : 815–822. DOI:10.1016/j.arr.2013.01.005 |
| [7] | Song Z, He CD, Sun C, et al. Increased expression of MAP2 inhibits melanoma cell proliferation, invasion and tumor growth in vitro and in vivo[J]. Exp Dermatol , 2010, 19 (11) : 958–964. DOI:10.1111/exd.2010.19.issue-11 |
| [8] | Wu S, Sun C, Tian D, et al. Expression and clinical significances of Beclin1, LC3 and mTOR in colorectal cancer[J]. Int J Clin Exp Pathol , 2015, 8 (4) : 3882–3891. |
| [9] | Souter S, Lee G. Microtubule-associated protein tau in human prostate cancer cells:isoforms, phosphorylation, and interactions[J]. J Cell Biochem , 2009, 108 (3) : 555–564. DOI:10.1002/jcb.v108:3 |
| [10] | Merk H, Zhang S, Lehr T, et al. Inhibition of endothelial Cdk5 reduces tumor growth by promoting non-productive angiogenesis[J]. Oncotarget , 2016, 7 (5) : 6088–6104. |
| [11] | Lan ZJ, Hu Y, Zhang S, et al. GGNBP2 acts as a tumor suppressor by inhibiting estrogen receptor alpha activity in breast cancer cells[J]. Breast Cancer Res Treat , 2016, 158 (2) : 263–276. DOI:10.1007/s10549-016-3880-2 |
| [12] | Fang Z, Yao W, Xiong Y, et al. Functional elucidation and methylation-mediated downregulation of ITGA5 gene in breast cancer cell line MDA-MB-468[J]. J Cell Biochem , 2010, 110 (5) : 1130–1141. DOI:10.1002/jcb.v110:5 |
| [13] | Rhodes LV, Tate CR, Hoang VT, et al. Regulation of triple-negative breast cancer cell metastasis by the tumor-suppressor liver kinase B1[J]. Oncogenesis , 2015, 4 : e168. DOI:10.1038/oncsis.2015.27 |
| [14] | 李晓欧, 从占杰, 李艳. EGCG对人乳腺癌细胞作用的分子靶点[J]. 中国实验诊断学 , 2015, 19 (10) : 1809–1812. |
 2016, Vol. 42
2016, Vol. 42


