扩展功能
文章信息
- 曲萌, 姜锐, 冯凯, 孙立伟, 董志恒
- QU Meng, JIANG Rui, FENG Kai, SUN Liwei, DONG Zhiheng
- 单宁酸对高糖下大鼠肾小球系膜细胞增殖及细胞周期的影响
- Effects of gallotannin on proliferation and cell cycle of rat glomerular mesangial cells under condition of high glucose
- 吉林大学学报(医学版), 2016, 42(05): 920-924
- Journal of Jilin University (Medicine Edition), 2016, 42(05): 920-924
- 10.13481/j.1671-587x.20160516
-
文章历史
- 收稿日期: 2015-08-07
2. 北华大学化学与生物学院 吉林省中药生物技术创新中心, 吉林 吉林 132013;
3. 北华大学基础医学院病理学教研室, 吉林 吉林 132013
2. Jilin Province Chinese Medical Biotechnology Innovation Center, College of Chemistry and Biology, Beihua University, Jilin 132013, China;
3. Department of Pathology, College of Basic Medical Sciences, Beihua University, Jilin 132013, China
糖尿病肾病(diabetic nephropathy,DN)作为糖尿病(diabetes mellitus,DM)最严重的微血管并发症之一,已成为终末期肾功能衰竭常见的原因[1-2]。作为DN发生发展中最重要的受损靶细胞,肾小球系膜细胞(glomerular mesangial cell,GMC)表现为肥大、增殖,产生过多的基质蛋白及大量细胞因子,进而导致肾小球硬化的发生。可见,在DN早期,有效地阻止GMC过度增殖已成为治疗DN的关键。单宁酸(gallotannin,GLTN)广泛存在于植物界,约70%以上的中草药中含有此类化合物。研究[3]表明: GLTN具有抗菌、抗病毒、清除自由基和抗氧化、抗炎、降血脂及降血糖等多种药理作用。也有文献[4]报道GLTN对DM具有疗效,但其对GMC的增殖活性、细胞周期以及转化生长因子β1(TGF-β1)和结缔组织生长因子(connective tissue growth factor,CTGF)表达的影响尚未见报道。本研究通过探讨GLTN对高糖诱导的大鼠肾小球系膜细胞增殖的抑制作用及对细胞周期的影响,旨在阐明GLTN对DN发生发展的延缓作用,为临床治疗DN提供有效的候选药物和一定的实验依据。
1 材料与方法 1.1 细胞、主要试剂和仪器大鼠肾小球系膜细胞株(HBZY-1)由中国医学科学院基础医学研究所细胞中心提供。3-氨基苯甲酰胺(3-AB)和GLTN购于美国Sigma公司,ECL增强发光试剂盒、兔抗大鼠TGF-β1、CTGF多克隆抗体及羊抗兔二抗购于美国Santa Cruz公司,DMEM培养基和胎牛血清购于美国Gibco公司,其他试剂均为国产分析纯。BD FACSVerse流式细胞仪购于美国Becton Dickinson公司,SpectraMax 190型全波长酶标仪购于美国Molecular Devices公司,Bioshine ChemiQ 4600化学发光成像系统购于上海鸥翔医学仪器有限公司,J-26XP型低温高速离心机购于美国贝克曼公司。
1.2 GMC的培养从液氮中取出大鼠GMC的冻存管后迅速复苏,接种于含15 %胎牛血清(FBS)的DMEM低糖培养基中,5% CO2、37℃培养,24 h半量换液,以后每2~3 d完全更换培养液1次,换液过程中逐渐将FBS浓度降为10%,待长满平底后0.25%胰酶消化,进行细胞传代。
1.3 MTT法检测不同培养条件下GMC的增殖取第5代GMC,用含15%FBS的DMEM低糖培养液,以1×103 mL-1接种于96孔板中,贴壁后同步化(含0.5%FBS的DMEM低糖培养液)24 h,按实验设计分组加条件。实验分为正常对照组(D-葡萄糖5.5 mmol· L-1,NC组)、高糖组(D-葡萄糖30 mmol· L-1,HC组)、高糖+5 mmol·L-1 3-AB(阳性药物对照组,AB组),高糖+20 μmol·L-1 GLTN (G20组) 、高糖+40 μmol·L-1 GLTN (G40组),每组设5个复孔,继续培养4、8、12、24、48和72 h,于每个时间点结束时,以每孔20 μL的剂量加入5 g·L-1MTT溶液,37℃继续孵育4 h,弃去孔内上清,每孔加入DMSO150 μL,震荡溶解结晶物10 min,酶标仪490 nm处检测各孔吸光度(A)值,以A值表示各组GMC的增殖水平。
1.4 流式细胞术检测各组GMC的细胞周期将GMC以5×104 mL-1接种于培养瓶中,待70%融合后同步化,按分组加各相应条件,继续培养48 h;收集细胞样本,细胞数在10×105 mL-1以内;冷PBS洗细胞2次,75%冰冻乙醇-20℃固定1 h,再次洗涤,沉淀重悬于500 μL冷PBS中;加RNase A 30 μL,37℃水浴30 min;400目网筛过滤细胞,制备成单个细胞;加PI染液400 μL,4℃ 避光孵育1 h;流式细胞术检测各组标本,最大激发波长为488 nm。
1.5 Western blotting法检测各组GMC中TGF-β1和CTGF的蛋白表达每组样品各取50 μg总蛋白,加入5×SDS上样缓冲液,煮沸5 min,使其变性;10% SDS-PAGE电泳,20 mA出浓缩胶后调至40 mA恒流继续电泳约30 min,15 mA电转移至PVDF膜;含5% 脱脂奶粉的TBST 20~37℃封闭1 h;按说明书所示比例,将各一抗加入封闭液中,4℃孵育过夜,TBST振荡洗膜5 min×5;根据一抗选择相应的二抗,37℃孵育2 h,TBST洗膜;ECL增强发光试剂盒A、B液1∶1显色处理;化学发光凝胶成像系统进行图像采集及数据处理,蛋白表达水平=每个样本条带的A值/ GAPDH的A值。
1.6 统计学分析采用SPSS 13.0软件对数据进行统计分析。各组细胞增殖水平、细胞周期、TGF-β1和CTGF蛋白表达水平以x±s表示,多组间样本均数比较采用单因素方差分析。以P<0.05表示差异有统计学意义。
2 结果 2.1 高糖环境下GMC的增殖与NC组比较,细胞培养4 h 时,各高糖组GMC开始出现增殖水平升高(P<0.01);细胞培养8 h时,AB组、G20组和G40组GMC增殖水平高于NC组(P<0.01),但与HC组比较明显下降(P<0.05或 P<0.01);随时间的延长(24和48 h),各给药组GMC的增殖水平明显下降(P<0.01),并呈现剂量-依赖关系。培养48 h时,高糖环境下GMC增殖最为明显,故选取48 h作为后续实验的时间。培养72 h时,高糖环境下GMC的增殖水平开始下降,但组间比较差异无统计学意义(P>0.05)。见表 1。
| (n=5,x±s) | |||||
| Group | A value(×10-1) | ||||
| (t/h) 4 | 8 | 24 | 48 | 72 | |
| NC | 1.40±0.07 | 1.46±0.02 | 1.96±0.03 | 2.53±0.03 | 2.59±0.02 |
| HC | 2.66±0.10** | 2.90±0.08** | 3.15±0.08** | 4.28±0.15** | 2.95±0.04 |
| AB | 2.48±0.08** | 2.21±0.10 **△△ | 2.14±0.05 *△△ | 2.88±0.09*△△ | 2.53±0.02 |
| G20 | 2.67±0.11** | 2.70±0.03*△△ | 2.49±0.05 **△△ | 2.9±0.04*△△ | 2.63±0.06 |
| G40 | 2.71±0.05** | 2.25±0.09**△△ | 2.12±0.06*△△ | 2.85±0.08*△△ | 2.52±0.03 |
| *P<0.05,** P<0.01 vs NC goup;△P<0.05,△△P<0.01 vs HC group. | |||||
GMC于高糖(HC组)环境中培养48 h,S期细胞百分比(29.47%±1.96 %)较低糖(NC组)环境中的细胞(10.71%±1.29 %)明显增多(P<0.01),给予3-AB(AB组)及高(G40组)、低(G20组)剂量GLTN后,S期细胞的百分比虽较低糖(NC组)环境中的明显升高(P<0.05或P<0.01),但均低于高糖(HC组)环境中S期细胞的百分比(P<0.01)。见表 2。
| (n=3,x±s,η/%) | |||
| Group | Percentage of GMC | ||
| G1 | S | G2/M | |
| NC | 70.83±1.30 | 10.71±1.29 | 19.14±1.90 |
| HC | 63.76±2.02 | 29.47±1.96** | 6.47±1.45 |
| AB | 67.17±1.01 | 16.53±1.51**△ | 15.59±1.47 |
| G20 | 64.51±0.97 | 19.01±1.74**△ | 16.51±1.52 |
| G40 | 65.50±1.42 | 16.32±1.38*△ | 19.13±1.33 |
| *P<0.05,** P<0.01 vs NC goup;△P<0.01 vs HC group. | |||
NC组GMC中TGF-β1和CTGF呈弱表达(0.38±0.02、0.26±0.03);与NC组比较,HC组TGF-β1和CTGF表达水平升高(0.71±0.06和0.60±0.04,P<0.01);GLTN作用48 h后,高糖所致的TGF-β1和CTGF高表达水平明显降低(P<0.01),但与NC组比较差异有统计学意义(P<0.05或P<0.01)。TGF-β1和CTGF在GMC中的蛋白表达水平呈正相关关系(r=0.871,P<0.01)。见图 1。
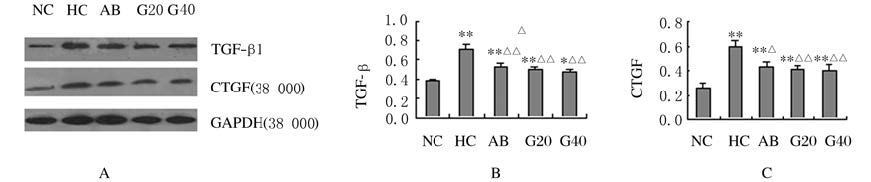
|
| 图 1 各组GMC中TGF-β1 和CTGF蛋白表达 Figure 1 Expressions of TGF-β1 and CTGF protein in GMC in various groups |
|
|
DN的发病机制非常复杂,近年来的研究[5]表明:产生过量的过氧化物是高血糖导致糖尿病血管损伤的共同机制。过氧化物及超氧化物引起DNA损伤,激活聚(ADP-核糖)聚合酶[poly(ADP-ribose) polymerase,PARP][6],活化的PARP形成ADP-核糖聚合物[poly(ADP-ribose),PAR],结合在单链或双链DNA断端,损伤较轻时,有利于其他DNA修复酶接近受损位点并对受损DNA进行修复[7],当DNA严重受损时,可形成长的或带有分支的PAR[8-9],耗竭大量NAD+和ATP,导致细胞抗氧化能力下降及Ca2+内流增加,引发DN;GAPDH作为糖酵解的关键酶被PARP修饰后活性减低,引发DN;活化的PARP通过上调ET-1、TNF-α和NOS等大量因子的表达,共同诱发DN。可见,PARP在DN的发生发展中发挥着重要的作用。相关研究[10]也表明:PARP抑制剂对DM并发症,如DN、糖尿病心肌病和糖尿病神经病变等具有一定防治作用。目前处于临床研究阶段的PARP抑制剂主要有Olaparib (AZD-2281) [11]、Veliparib (ABT-888) 和3-AB等,均属于化学试剂,可引起人体产生一系列的不良反应,且可产生耐药性[12-15]。然而,GLTN作为PARG的抑制剂,是许多传统中药中的有效成分之一,已在临床应用多年,研究[16]表明:在PARP介导细胞死亡途径中,PARG发挥着重要作用,PARG抑制剂通过减慢对PARG的分解代谢,降低PARP的催化活性,减缓NAD+的消耗量,从而降低PARP介导细胞死亡。可见,以GLTN作为PARP间接抑制剂进行DN的防治或辅助治疗措施,可能会具有更广泛的应用前景。
GMC是肾脏中最为活跃的细胞,本实验以高糖环境中的GMC为研究对象,结果表明:处于高糖环境中的GMC,受到高糖的双重调节,培养24~48 h时促进其增殖,培养72 h后抑制其增殖,当GMC有丝分裂受抑制后细胞出现肥大。正常情况下,GMC行使收缩、吞噬、维持基质代谢等生物学功能,高血糖时,GMC增殖明显加快,整合素及凝血酶受体表达上调,产生多种细胞因子及ECM,凝血因子和细胞因子再度刺激GMC,使其过度增殖,形成恶性放大环路,进一步导致ECM的积聚,而肾小球硬化的关键正是ECM的聚集。本研究MTT结果证实:GLTN可抑制高糖诱导的GMC的增殖。细胞周期检测结果显示:GLTN可明显降低高糖环境中S期GMC的百分比,进一步验证了GLTN对高糖促GMC增殖的阻断作用。
在众多的与DN相关的细胞因子中TGF-β和CTGF的作用更为突出。本实验选取了TGF-β1、CTGF作为观察指标,高糖导致GMC增殖,高表达TGF-β1,而TGF-β1的高表达又进一步促进GMC的增殖、ECM沉积,可见下调TGF-β1表达对延缓DN病程发展、减少肾脏损伤具有一定的意义。Shevalye等[17-18]使用PARP抑制剂GPI-15427 对DM大鼠治疗26周后,大鼠肾组织内因高糖所致高表达的TGF-β1降低,这与本实验中应用PARG抑制剂所取得的结果相一致。在DN的微血管病变中CTGF与TGF-β1相互促进,密切相关,CTGF介导着TGF-β1的负面效应,其生物学活性比TGF-β1更加广范。CTGF的高表达可导致纤维黏连蛋白(FN)、各型胶原等细胞外基质(ECM)的合成,促进肾纤维化的发生。本实验中,经GLTN处理的高糖培养下的大鼠GMC中CTGF和TGF-β1表达下调,与 AB组比较差异无统计学意义。考虑GLTN下调CTGF和TGF-β1表达的原因可能为:作为PARG的抑制剂,GLTN下调了PARP的表达,从而减轻了高糖对GMC的氧化损伤,导致TGF-β1和CTGF的合成分泌减少。另一方面,TGF-β1和CTGF的下调,可部分切断细胞增殖-细胞因子高表达-细胞进一步增殖这一恶性循环途径,抑制高糖所致的GMC的增殖,从而对高糖培养下的GMC发挥保护作用。
综上所述,GLTN可能部分通过对TGF-β1和CTGF的表达下调及细胞周期的阻滞,有效地抑制高糖所致的GMC增殖,从而对DN的发生发展起到一定的延缓作用。
| [1] | Cherney DZ. Advances in the treatment of diabetic nephropathy[J]. Nephrol News Issues , 2013, 7 (5) : 18,33. |
| [2] | Appel G. Detecting and controlling diabetic nephropathy:what do we know[J]. Cleve Clin J Med , 2013, 80 (4) : 209–217. DOI:10.3949/ccjm.80gr.12006 |
| [3] | Singh AK, Singh J. Evaluation of anti-diabetic potential of leaves and stem of Flacourtia jangomas in streptozotocin-induced diabetic rats[J]. Indian J Pharmacol , 2010, 42 (5) : 301–305. DOI:10.4103/0253-7613.70238 |
| [4] | Chandak PG, Gaikwad AB, Tikoo K. Gallotannin ameliorates the development of streptozotocin-induced diabetic nephropathy by preventing the activation of PARP[J]. Phytother Res , 2009, 23 (1) : 72–77. DOI:10.1002/ptr.v23:1 |
| [5] | Brownlee M. The pathobiology of diabetic complications:a unifying mechanism[J]. Diabetes , 2005, 54 (6) : 1615–1625. DOI:10.2337/diabetes.54.6.1615 |
| [6] | Smith MA, Hampton OA, Reynolds CP, et al. Initial testing (stage 1) of the PARP inhibitor BMN 673 by the pediatric preclinical testing program:PALB2 mutation predicts exceptional in vivo response to BMN 673[J]. Pediatr Blood Cancer , 2015, 62 (1) : 91–98. DOI:10.1002/pbc.25201 |
| [7] | Jang NY, Kim DH, Cho BJ, et al. Radiosensitization with combined use of olaparib and PI-103 in triple-negative breast cancer[J]. BMC Cancer , 2015, 15 : 89. DOI:10.1186/s12885-015-1090-7 |
| [8] | Yao H, Ji M, Zhu Z, et al. Discovery of 1-substituted benzyl-quinazoline-2,4(1H,3H)-dione derivatives as novel poly(ADP-ribose) polymerase-1 inhibitors[J]. Bioorg Med Chem , 2015, 23 (4) : 681–693. DOI:10.1016/j.bmc.2014.12.071 |
| [9] | Faraoni I, Compagnone M, Lavorgna S, et al. BRCA1, PARP1 and γH2AX in acute myeloid leukemia:Role as biomarkers of response to the PARP inhibitor olaparib[J]. Biochim Biophys Acta , 2015, 1852 (3) : 462–472. DOI:10.1016/j.bbadis.2014.12.001 |
| [10] | Lupachyk S, Shevalye H, Maksimchyk Y, et al. PARP inhibition alleviates diabetes-induced systemic oxidative stress and neural tissue 4-hydroxynonenal adduct accumulation:Correlation with peripheral nerve function[J]. Free Radic Biol Med , 2011, 50 (10) : 1400–1409. DOI:10.1016/j.freeradbiomed.2011.01.037 |
| [11] | Gunderson CC, Moore KN. Olaparib:an oral PARP-1 and PARP-2 inhibitor with promising activity in ovarian cancer[J]. Fut Oncol , 2015, 11 (5) : 747–757. DOI:10.2217/fon.14.313 |
| [12] | Li Y, Fan L, Sun Y, et al. Paris saponin Ⅶ from trillium tschonoskii reverses multidrug resistance of adriamycin-resistant MCF-7/ADR cells via P-glycoprotein inhibition and apoptosis augmentation[J]. J Ethnopharmacol , 2014, 154 (3) : 728–734. DOI:10.1016/j.jep.2014.04.049 |
| [13] | Durmus S, Sparidans RW, van Esch A, et al. Breast cancer resistance protein (BCRP/ABCG2) and P-glycoprotein (P-GP/ABCB1) restrict oral availability and brain accumulation of the PARP inhibitor rucaparib (AG-014699)[J]. Pharm Res , 2015, 32 (1) : 37–46. DOI:10.1007/s11095-014-1442-z |
| [14] | Henneman L, van Miltenburg MH, Michalak EM, et al. Selective resistance to the PARP inhibitor olaparib in a mouse model for BRCA1-deficient metaplastic breast cancer[J]. PNAS , 2015, 112 (27) : 8409–8414. DOI:10.1073/pnas.1500223112 |
| [15] | Jaspers JE, Sol W, Kersbergen A, et al. BRCA2-deficient sarcomatoid mammary tumors exhibit multidrug resistance[J]. Cancer Res , 2015, 75 (4) : 732–741. DOI:10.1158/0008-5472.CAN-14-0839 |
| [16] | Tikoo K, Tamta A, Ali IY, et al. Tannic acid prevents azidothymidine (AZT) induced hepatotoxicity and genotoxicity along with change in expression of PARG and histone H3 acetylation[J]. Toxicol Lett , 2008, 177 (2) : 90–96. DOI:10.1016/j.toxlet.2007.12.012 |
| [17] | Shevalye H, Stavniichuk R, Xu W, et al. Poly(ADP-ribose) polymerase (PARP) inhibition counteracts multiple manifestations of kidney disease in long-term streptozotocin-diabetic rat model[J]. Biochem Pharmacol , 2010, 79 (7) : 1007–1014. DOI:10.1016/j.bcp.2009.11.018 |
| [18] | Shevalye H, Maksimchyk Y, Watcho P, et al. Poly(ADP-ribose) polymerase-1(PARP-1) gene deficiency alleviates diabetic kidney disease[J]. Biochim Biophys Acta , 2010, 1802 (11) : 1020–1027. DOI:10.1016/j.bbadis.2010.07.004 |
 2016, Vol. 42
2016, Vol. 42


