扩展功能
文章信息
- 王亚东, 李东朋, 郭德伟, 宋及时, 李红伟, 钱伟强, 杨波
- WANG Yadong, LI Dongpeng, GUO Dewei, SONG Jishi, LI Hongwei, QIAN Weiqiang, YANG Bo
- 富血小板血浆对创伤性颅脑损伤大鼠神经功能的保护作用
- Protective effect of platelet-rich plasma on never function in rats with traumatic brain injury
- 吉林大学学报(医学版), 2016, 42(05): 910-914
- Journal of Jilin University (Medicine Edition), 2016, 42(05): 910-914
- 10.13481/j.1671-587x.20160514
-
文章历史
- 收稿日期: 2015-11-05
2. 郑州大学生命科学学院干细胞研究室, 河南 郑州 450052
2. Stem Cell Laboratory, School of Life Science, Zhengzhou University, Zhengzhou 450001, China
创伤性颅脑损伤(traumatic brain injury,TBI)是现代社会致死致残的重要原因之一,颅脑损伤后的一系列病理生理改变常常造成更为严重的二次损害,发生神经细胞凋亡和坏死等改变,从而导致患者的运动功能缺失、学习和记忆能力受损等。颅脑损伤后的修复情况很大程度上影响着患者的预后,目前对于颅脑创伤的早期治疗主要以神经保护以及预防二次损害为主,因此,探寻颅脑损伤早期新的治疗手段有着很高的研究价值。富血小板血浆(platelet-rich plasma,PRP)从问世起,就以其激活后所含丰富的细胞因子和各类生长因子而受到广泛关注,已经应用于骨质重建、美容修复等多个领域。对神经系统来说,神经修复主要包括血管再生、神经再生以及突触重建3个部分[1],PRP激活后可分泌一系列神经保护因子和神经生长因子[2](neurotrophic growth factors,NGFs),包括血小板源性生长因子(platelet derived growth factor,PDGF)、转化生长因子β(transforming growth factor beta,TGF-β)、血管内皮生长因子(vascular endothelial growth factor,VEGF)、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)和上皮细胞生长因子(epithelial growth factor,EGF)等。Zhang等[3]报道:血管内注射PRP对于脑的缺血性卒中有确切的保护与修复作用,但是对于颅脑外伤的效果尚不明确。本研究旨在研究PRP对于TBI大鼠神经功能的影响,阐明其是否有潜在的脑外伤后神经保护作用。
1 材料与方法 1.1 实验动物、主要试剂和仪器健康成年雄性SD大鼠100只(SPF级),体质量280~300g,由河南省实验动物中心提供,动物合格证号:SCXK(豫)2010-0002。免疫组织化学试剂盒(北京鼎国生物技术有限责任公司)。大鼠脑立体定位仪、低速离心机。
1.2 动物分组及干预取40只大鼠用于取血并制备PRP,其余60只采用随机数字表法分为假手术组(Sham组,仅开放骨窗)、TBI模型组(TBI组)和TBI模型并PRP处理组(PRP组),每组20只。大鼠10%水合氯醛麻醉后置于大鼠脑立体定位仪上,取头皮正中切口,暴露大鼠顶骨,以观察到冠状缝和人字缝为准,在大鼠右侧顶骨区域以牙科钻钻孔,纹式钳扩大骨窗至约5 mm直径,假手术组大鼠关颅,TBI组及PRP组大鼠按Feeney法[4]制作重度颅脑损伤模型。重度颅脑损伤模型制备方法:20 g重砝码垂直从40 cm高度落下撞击置于颅骨骨窗内的柱状打击器,损伤深度可达海马区域,常规关颅并缝合切口。分别于外伤术后当天、术后第2和6天,通过股动脉,假手术组和TBI组大鼠注射0.9%生理盐水,PRP组大鼠注射PRP,注射剂量为2 mL·kg-1。
1.3 PRP制备将40只SD大鼠10%水合氯醛麻醉后,每只取心室血10 mL。采用Landesberg二次离心法[5-6],首先用抗凝管收集大鼠全血,200 g离心10 min,待大部分红细胞沉在抗凝管下部,移液器吸取上部清亮血浆及分界线下1 mm内的红细胞转移至另一抗凝管内,500g离心10 min,弃去约2/3上清,剩下部分轻摇震荡即得到PRP,将制得的PRP置于-80℃冰箱冻存,使用时水浴箱摇床解冻。
1.4 改良大鼠神经功能缺损(mNSS)评分及脑切片制备各组大鼠于术后第1、3和7天,行mNSS评分 [7],评价大鼠外伤术后及治疗后神经功能缺损情况,由2名熟悉各项评价标准的专业人员分别评定,评分越低表明大鼠神经功能缺损越少。于第7天评分完成后,每组随机选取10只大鼠处死,断头取脑,用4%多聚甲醛固定,石蜡包埋,制作损伤区域脑切片。
1.5 免疫组织化学法检测60℃温箱烤片 60min,二甲苯Ⅰ 、二甲苯Ⅱ各10min,脱蜡,梯度酒精水化,PBS冲洗,0.1 mol·L-1柠檬酸缓冲液修复抗原,10%羊血清封闭,滴加一抗(GFAP一抗稀释1∶50,NeuN一抗稀释1∶100),4℃冰箱孵育过夜,次日37℃水浴箱复温30min,滴加二抗,PBS冲洗,DBA染色,中性树胶封片。观察时每组各取10张切片,每张切片取2个相互不重叠的高倍视野,计数阳性细胞数并进行统计学分析。
1.6 Morris水迷宫试验Morris水迷宫为一个直径180 cm、高度约50 cm的黑色圆形池子,将水池分为4个象限,在第三象限放置一个圆柱形平台,平台上缘在水平面下1cm,水温约26℃。Morris水迷宫实验分为2部分:①定位航行实验。测定大鼠通过训练获得经验的能力,以潜伏期表示(大鼠从入水到找到平台的时间);② 空间探索实验。测定大鼠空间记忆能力,以穿越平台次数及大鼠在各象限游泳时间表示。方法:每组各取10只大鼠于第7天开始,每天4次进行定位航行试验,依次面朝池壁放入4个象限中,60 s内登上水下平台视为成功,若90s内仍未找到水下平台,则人为将其放置在平台上10 s后,放回鼠笼等待下一轮训练,记录每只大鼠水下游泳速度及各象限入水后的逃避潜伏期。4d后撤去水下平台,开始空间探索试验,进行4 d,分析最后一天大鼠从各象限入水后穿越平台次数及在各象限的游泳时间比例(所有数据由固定在Morris水迷宫上方的摄像设备记录,计算机软件分析)。
1.7 组织学观察根据大体标本利用自制带刻度的软质探针估算损伤深度,利用软件对与实物等大的脑组织照片分析测量其损伤平面面积,计算各组大鼠脑损伤体积;每只大鼠各取损伤部位中心处脑组织切片做Nissl染色,镜下观察损伤区组织学变化;利用免疫组织化学法对脑切片进行处理,标记GFAP+和neuN+细胞。
1.8 统计学分析利用SPSS 21.0软件对数据进行统计学分析。各组大鼠mNSS评分、脑损伤体积、GFAP+和neuN+细胞数、逃避潜伏期和穿越平台次数以x±s表示,多组间样本均数比较采用单因素方差分析,两组间比较采用LSD-q检验。检验水准为α=0.05。
2 结 果 2.1 PRP血小板浓度测定及注射剂量采用血小板计数板对制备的PRP进行血小板计数。本实验中制备的PRP中血小板浓度为(1320±160)×109L-1;PRP组每只大鼠每次注射0.6mL PRP,其中约含血小板790×106个。
2.2 各组大鼠mNSS评分各组大鼠术后第1、3和7天评分均值见图 1。与假手术组比较,TBI组和PRP组大鼠mNSS评分在术后第1、3和7天时均较高(P<0.05),TBI组和PRP组术后第3天mNSS评分开始下降;与TBI组比较,PRP组mNSS评分下降明显(P<0.05)。
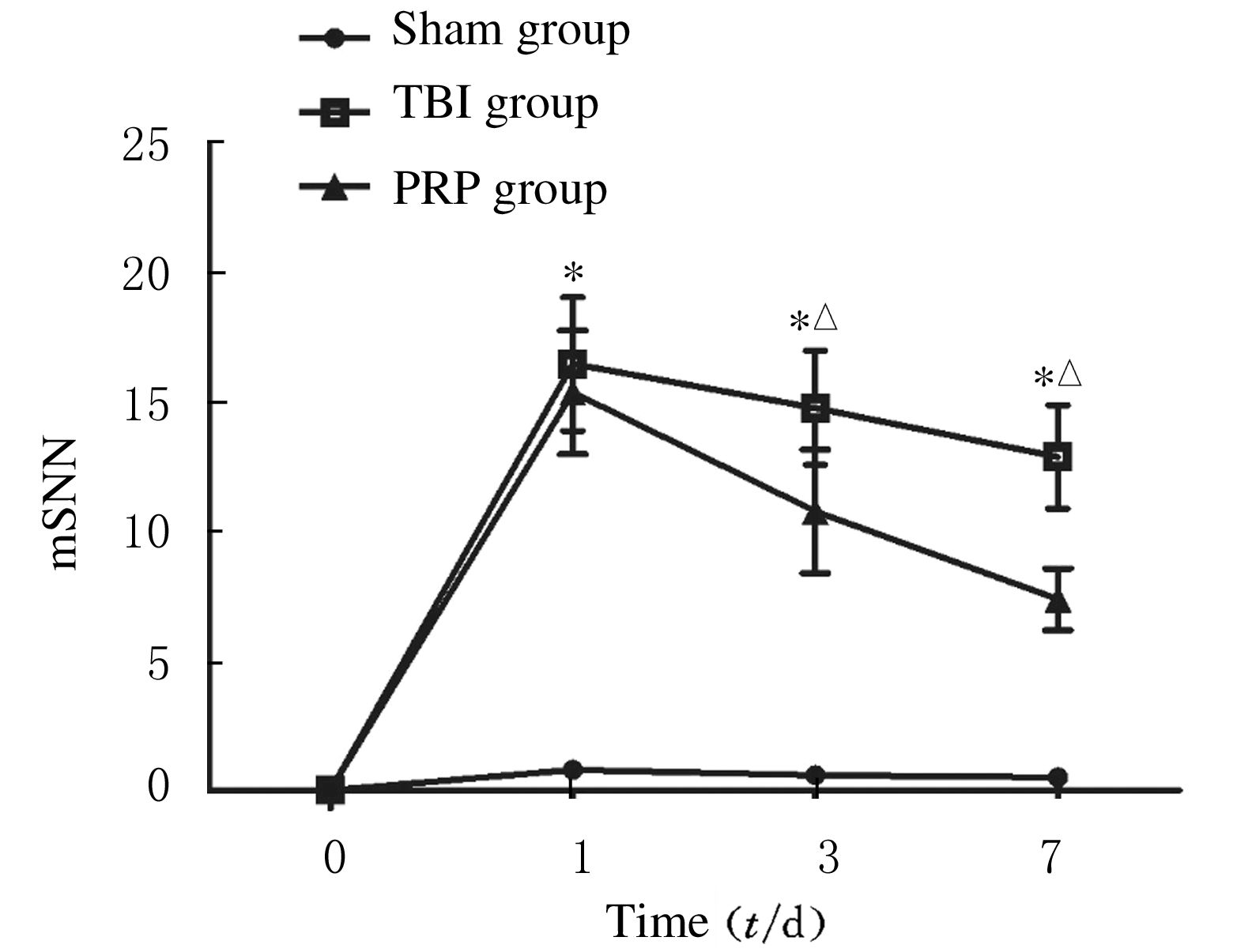
|
| 图 1 各组大鼠在1、3和7 d的mNSS评分 Figure 1 mNSS scores of rats in various groups on 1st,3th,and 7th days |
|
|
脑损伤7d后,TBI组大鼠皮层损伤体积[(40.60±2.88)μm3]大于PRP组[(24.50±2.92)μm3](P<0.05)。见图 2(插页三)。Nissl染色,假手术组大鼠脑皮层区细胞排列整齐,细胞形态规则,尼氏体着蓝色,细胞清晰可见,神经细胞数为(82.36±6.92)个;TBI组大鼠脑损伤区细胞稀疏,排列紊乱,无层次感,尼氏体明显减少,胞核体积变小甚至固缩深染,结构不清,神经细胞数为(36.00±6.24)个,并有少量新生血管生成;PRP组大鼠脑组织中细胞排列稍紊乱,细胞体积略有缩小,形态不规则,着色不均匀,尼氏体减少,神经细胞数为(68.60±6.28)个,较TBI组增多(P<0.05),新生血管明显多于TBI组。术后第7天时Nissl染色皮层区组织学表现见图 3(插页三)。
2.4 各组大鼠脑组织免疫组织化学染色假手术组GFAP+细胞数[(3.6±1.60)个]较少,TBI组为(28.8±6.52)个,PRP组为(12.6±4.32)个,3组间比较差异有统计学意义(P<0.01);与TBI组比较,PRP组GFAP+细胞明显较少(t=9.26,P<0.01)。假手术组大鼠海马C3区neuN+细胞数为(2224.6±403.68)个;TBI组大鼠海马C3区细胞排列紊乱、细胞形态不规则,部分细胞凋亡等,neuN+细胞数为(1768.2±345.55)个,PRP组大鼠海马C3区细胞较TBI组整齐,neuN+细胞数[(2006.4±368.98)个]多于TBI组,3组间比较差异有统计学意义(P<0.05);与TBI组比较,PRP组表达neuN+细胞更多(t=2.10,P=0.04)。术后第7天GFAP免疫组织化学染色结果见图 4(插页三)。
2.5 各组大鼠Morris水迷宫实验各组大鼠水下游泳速度比较差异无统计学意义(F=3.10,P>0.05)。与假手术组比较,TBI组和PRP组大鼠潜伏期明显延长(P<0.05);与TBI组比较,PRP组大鼠潜伏时间明显缩短并逐渐接近假手术组大鼠,TBI组大鼠下降趋势逐渐平稳。空间航行实验:假手术组大鼠60s内穿越平台次数、在第三象限游泳时间比例均高于TBI组及PRP组;与TBI组比较,PRP组大鼠穿越平台次数及第三象限游泳时间比例均明显增加(P<0.05)。见图 5和表 1。

|
| 图 5 各组大鼠Morris水迷宫逃避潜伏期 Figure 5 Escape latency time in Morris water maze of rats in various groups |
|
|
| (n=10,x±s,η) | |||
| Group | Swimming speed[v/(cm·s-1)] | Times acrossing plaltform | Percent of swimming time during the third quandran(η/%) |
| Sham | 26.00±1.33 | 4.90±0.57 | 52.9±3.38 |
| TBI | 24.30±1.06 | 1.60±0.70* | 25.0±2.21* |
| PRP | 25.50±2.12 | 3.30±0.67*△ | 35.7±3.40*△ |
| *P<0.05 vs sham group;△P<0.05 vs TBI group. | |||
原发性颅脑损伤后一系列病理生理反应,如炎性因子生成、代谢障碍、钙超载、自由基产生、血脑屏障破坏和脑组织缺血缺氧等,常常造成严重的继发性脑损伤,最终引起大量神经细胞凋亡坏死,导致神经功能缺失、认知和记忆受损等。Narayan等[8]研究发现:90%死于颅脑外伤的患者,在损伤区域出现缺血性改变,而缺血性改变又是一系列严重继发损害的主要机制,因此良好微循环的建立是减轻脑损伤后相关神经损害的基础。PRP中所含的丰富的神经生长因子和细胞因子则为血管新生以及神经重建提供了良好的条件[9]。研究[10]表明:PDGF不仅能起到神经保护作用,还通过与血管内皮细胞的交互作用促进血管生成与重塑,改善微环境。另外,TGF-β参与体内许多炎症反应和组织修复,是体内一种多功能基础抗炎因子,对于减轻损伤区域炎症反应和脑水肿,改善循环非常重要,并且是一些神经营养因子发挥作用所不可缺少的[11]。此外,VEGF是血管生成作用最强也是最重要的刺激因子,可促进血管内皮细胞分裂增殖,在PRP中所占构成比很高,在脑损伤以及脑梗死的神经修复中日益受到重视[12]。研究[13-14]显示:血清VEGF水平与脑外伤程度及脑梗死面积呈负相关关系,并且较高的VEGF水平通常预示着较好的预后。
GFAP是胶质增生的标志,脑外伤后早期,胶质细胞的增生可以释放一系列的神经生长因子促进神经元的修复与再生;但脑外伤后期,胶质瘢痕的存在又抑制了神经突触结构的重建与修复,不利于外伤后的功能恢复[15],PRP通过提供外源性的神经生长因子和细胞生长因子,不仅促进了损伤神经元的修复,同时抑制了胶质瘢痕的形成,对脑外伤后大鼠神经功能的恢复起到了重要的作用。本研究中GFAP+细胞数量的减少直观地反映了PRP的这一效应。
本研究中PRP组大鼠mNSS评分较低,神经功能的恢复情况明显优于TBI组。
海马区被认为与学习与记忆功能密切相关,创伤性颅脑损伤后大鼠海马CA1区、CA3区和齿状回等区域出现突触传递功能的改变和神经细胞凋亡,可能是导致学习和记忆功能紊乱的主要原因。本研究采用经典Morris水迷宫实验比较各组大鼠学习与记忆功能结果显示:PRP组大鼠表现明显优于TBI组,从侧面说明了PRP对于脑损伤大鼠学习与记忆功能的改善。neuN可特异性地与神经元细胞核抗原结合,是神经系统特异性调节分子,正常表达于脑组织成熟的锥体神经元和颗粒神经元中,神经元受损或凋亡时neuN染色减少甚至不能染色[16],故常作为神经元存活的主要检测指标。本研究中,PRP组脑外伤大鼠海马C3区neuN+神经元明显多于TBI组,表明PRP对海马区神经元的凋亡有一定的抑制作用,凋亡进程的抑制一定程度上也利于新生神经元的存活[17]。
目前PRP在临床的应用还处于探索阶段,应用有所限制,一方面是由于制备方法还未统一,各种方法制备出的PRP血小板浓度不尽相同,所发挥的生理作用亦有所差异,尚未有统一的制备条件及最有效的血小板浓度报道;另外,目前还没有较为有力的临床数据支持其疗效,也没有证据表明PRP的应用是否有相关的不良反应。目前,PRP制品研发过程中还衍生出了一类PRP凝胶,制备方法为在PRP 中加入凝血酶及氯化钙等催化剂后,其血小板中的生长因子被激活并释放出来,形成胶冻样PRP凝胶,原位注射于作用部位进而促进各种组织的修复与再生,与普通PRP比较,PRP凝胶具有其独特的骨架结构,其内所含的各种生长因子和细胞因子可以缓慢释放、持续作用,目前基于动物实验的局部应用效果好于普通PRP。临床上PRP取材方便,术中自体血回收即可制备,PRP类生物制品有望成为今后各相关学科的一个研究方向。
综上所述,PRP治疗用于早期TBI大鼠,可起到有效的神经保护作用,对TBI大鼠的神经功能恢复、学习和记忆功能的改善有着较好的促进作用。
| [1] | Angels Font M, Arboix A, Krupinski J. Angiogenesis, neurogenesis and neuroplasticity in ischemic stroke[J]. Curr Cardiol Rev , 2010, 6 (3) : 238–244. DOI:10.2174/157340310791658802 |
| [2] | Boswell SG, Cole BJ, Sundman EA, et al. Platelet-rich plasma:a milieu of bioactive factors[J]. Arthroscopy , 2012, 28 (3) : 429–439. DOI:10.1016/j.arthro.2011.10.018 |
| [3] | Zhang Y, Ying G, Ren C, et al. Administration of human platelet-rich plasma reduces infarction volume and improves motor function in adult rats with focal ischemic stroke[J]. Brain Res , 2015, 1594 : 267–273. DOI:10.1016/j.brainres.2014.10.035 |
| [4] | 张荣军, 游潮, 蔡博文, 等. Feeney法建立大鼠闭合性脑损伤模型及评估[J]. 中国修复重建外科杂志 , 2005, 19 (12) : 1015–1018. |
| [5] | Landesberg R, Roy M, Glickman RS. Quantification of growth factor levels using a simplified method of platelet-rich plasma gel preparation[J]. J Oral Maxillofac Surg , 2000, 58 (3) : 297–300. DOI:10.1016/S0278-2391(00)90058-2 |
| [6] | 吕敏, 裴国献, 刘勇, 等. 富血小板血浆的制备现状及研究进展[J]. 现代生物医学进展 , 2013, 13 (13) : 2574–2577. |
| [7] | Lu D, Goussev A, Chen J, et al. Atorvastatin reduces neurological deficit and increases synaptogenesis, angiogenesis, and neuronal survival in rats subjected to traumatic brain injury[J]. J Neurotrauma , 2004, 21 (1) : 21–32. DOI:10.1089/089771504772695913 |
| [8] | Narayan RK, Maas AI, Servadei F, et al. Progression of traumatic intracerebral hemorrhage:a prospective observational study[J]. J Neurotrauma , 2008, 25 (6) : 629–639. DOI:10.1089/neu.2007.0385 |
| [9] | Takeuchi M, Kamei N, Shinomiya R, et al. Human platelet-rich plasma promotes axon growth in brain-spinal cord coculture[J]. Neuroreport , 2012, 23 (12) : 712–716. DOI:10.1097/WNR.0b013e3283567196 |
| [10] | Shen J, Ishii Y, Xu G, et al. PDGFR-β as a positive regulator of tissue repair in a mouse model of focal cerebral ischemia[J]. J Cereb Blood Flow Metab , 2012, 32 (2) : 353–367. DOI:10.1038/jcbfm.2011.136 |
| [11] | Haas SL, Fitzner B, Jaster R, et al. Transforming growth factor-beta induces nerve growth factor expression in pancreatic stellate cells by activation of the ALK-5 pathway[J]. Growth Factors , 2009, 27 (5) : 289–299. DOI:10.1080/08977190903132273 |
| [12] | Pandya NM, Dhalla NS, Santani DD. Angiogenesis-a new target for future therapy[J]. Vascul Pharmacol , 2006, 44 (5) : 265–274. DOI:10.1016/j.vph.2006.01.005 |
| [13] | 张源, 张文进, 田毅, 等. 大鼠创伤性颅脑损伤程度与血清MCP-1、VEGF及损伤区CD34+细胞表达水平的关系[J]. 中华神经医学杂志 , 2014, 13 (3) : 224–228. |
| [14] | Lee SC, Lee KY, Kim YJ, et al. Serum VEGF levels in acute ischaemic strokes are correlated with long-term prognosis[J]. Eur J Neu , 2010, 17 (1) : 45–51. DOI:10.1111/j.1468-1331.2009.02731.x |
| [15] | Yates D. Traumatic brain injury:Serum levels of GFAP and S100B predict outcomes in TBI[J]. Nat Rev Neurol , 2011, 7 (2) : 63. |
| [16] | Preusser M, Laggner U, Haberler C, et al. Comparative analysis of NeuN immunoreactivity in primary brain tumours:conclusions for rational use in diagnostic histopathology[J]. Histopathology , 2006, 48 (4) : 438–444. DOI:10.1111/his.2006.48.issue-4 |
| [17] | Zhang RSS, Xue YSS, Lu SSS, et al. Bcl-2 enhances neurogenesis and inhibits apoptosis of newborn neurons in adult rat brain following a transient middle cerebral artery occlusion[J]. Neurobiol Dis , 2006, 24 (2) : 345–356. DOI:10.1016/j.nbd.2006.07.012 |
 2016, Vol. 42
2016, Vol. 42


