扩展功能
文章信息
- 陈默然, 赵行宇, 罗军, 朱文赫, 李妍, 张巍
- CHEN Moran, ZHAO Xingyu, LUO Jun, ZHU Wenhe, LI Yan, ZHANG Wei
- 胡桃醌联合顺铂对宫颈癌HeLa细胞的促凋亡作用及其机制
- Pomotion effect of juglone combined with cisplatin on apoptosis of human cervical cancer HeLa cells and its mechanism
- 吉林大学学报(医学版), 2016, 42(05): 901-904
- Journal of Jilin University (Medicine Edition), 2016, 42(05): 901-904
- 10.13481/j.1671-587x.20160512
-
文章历史
- 收稿日期: 2015-12-14
在发展中国家,以宫颈癌为代表的女性致死相关的癌症死亡率超过85%。顺铂(CDDP)作为一种临床广泛使用的抗肿瘤药物,长时间使用会使患者产生抗性,目前临床多为顺铂与其他药物联合使用以解决顺铂抗性而引起的肿瘤复发等[1-2]。目前研究[3-7]发现:胡桃醌可以通过不同的机制诱导多种肿瘤,如胃癌、肝癌、宫颈癌和前列腺癌细胞凋亡。本课题组在前期研究[8-10]中发现:胡桃醌联合顺铂可抑制宫颈癌 HeLa细胞的增殖并促进细胞凋亡。为进一步研究胡桃醌与顺铂联合后对宫颈癌HeLa促进凋亡作用的机制,本研究观察胡桃醌对PI3k/Akt信号转导通路的影响,为顺铂联合用药的抗肿瘤作用及其机制研究提供重要的理论依据。
1 材料与方法 1.1 细胞、药物与主要试剂宫颈癌HeLa细胞系由本院科研实验室保存。3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)、胡桃醌(5-羟基-1,4-奈醌)和顺铂购自江苏豪森药业,二甲基亚砜(DMSO,Dimethyl Sulfoxide ) 购于美国Sigma公司,一抗兔抗人Bcl-2、Bax、 Cleaved-caspase-3、Akt和pAkt单克隆抗体均购自美国Cell Signal公司,二抗HRP标记兔抗体购自美国Santa Cruz公司。
1.2 细胞培养HeLa细胞用含10%新生小牛血清的DMEM完全培养液培养于37℃、5%CO2和95%湿度培养箱中培养。细胞单层贴壁生长,每 2d更换1次培养基,细胞每周按1∶3传代。
1.3 MTT法检测细胞增殖取对数生长期HeLa细胞,调整细胞密度为1.0×107 L-1,接种于96孔细胞培养板,每孔100 μL。待细胞贴壁后,弃去培养液,加入含20 μmol· L-1胡桃醌、20 μmol· L-1顺铂及20 μmol· L-1顺铂与20 μmol· L-1胡桃醌联合的完全培养液(分别为胡桃醌组、顺铂组和联合用药组)继续培养24、48和72 h,设置不加药的对照组,每个浓度设5个复孔。每孔加入20 μL新配制的5g· L-1 MTT,37℃避光孵育4 h,弃去上清,每孔再加入150 μL DMSO,振荡10 min,选择490 nm波长处在酶标仪检测吸光度(A)值,以A值代表细胞殖增抑制作用。
1.4 Hoechst33258染色法检测细胞凋亡 4组HeLa 细胞培养12h后,采用Hoechst 33258染色法,吸出孔内培养液,用磷酸缓冲盐溶液(PBS) 冲洗2 次,每次2 min; 加入多聚甲醛固定15 min,吸出固定液,用PBS 洗2 次,每次2~3 min; 每孔加入 Hoechst33258 工作液1mL,避光染色5 min,荧光显微镜下观察细胞凋亡形态表现。随机观察5个视野。
1.5 蛋白印迹法检测HeLa细胞中相关蛋白表达水平按1.4方法处理细胞,加药12h后提取细胞蛋白。BCA 法检测蛋白浓度,变性后上样50μg,以 12% SDS-PAGE 凝胶电泳分离蛋白,湿转至PVDF 膜并用5%脱脂奶粉于37℃条件下封闭 2h,抗Bcl-2、Bax、caspase-3 、 Akt和pAkt的一抗分别按1∶1000 稀释,4℃孵育过夜,HRP 标记的二抗按1∶ 5000稀释,室温孵育2h,曝光显影。以实验组的灰度值与对照组之比表示蛋白相对表达水平。
1.6 统计学分析采用SPSS 10.0软件进行统计学处理。细胞增殖抑制以x±s表示,经F检验显示方差齐性,组间比较采用单因素分差分析。检验水准α=0.05。
2 结 果 2.1 MTT法检测各组HeLa细胞增殖抑制作用 与对照组比较,胡桃醌组、顺铂组和联合用药组在不同作用时间点均可抑制HeLa 细胞的增殖,随着作用时间的增加,增殖抑制作用明显增高(P<0.05或P<0.01)。见表 1。
| (n=5,x±s,η) | ||||
| Group | Inhibition of proliferation | |||
| (t/h) 0 | 24 | 48 | 72 | |
| Control | 0.780±0.040 | 0.840±0.050 | 1.020±0.070 | 1.140±0.090 |
| Juglone | 0.710±0.060 | 0.654±0.020* | 0.465±0.030** | 0.362±0.020** |
| Cisplatin | 0.800±0.090 | 0.533±0.030* | 0.412±0.020** | 0.304±0.030** |
| Combined treatment | 0.740±0.050 | 0.312±0.040 **△# | 0.223±0.013**△# | 0.145±0.020***# |
| *P<0.05,** P<0.01 compared with control group;△P<0.01 compared with juglone group;#P<0.05 compared with cisplatin group. | ||||
荧光显微镜下观察:对照组HeLa细胞大小均一,成弥散均匀的淡蓝色弱荧光;胡桃醌组和顺铂组HeLa细胞核明显皱缩,并可见致密强荧光,存在核碎裂和凋亡小体等强荧光团块;联合用药组细胞凋亡现象更加明显。见图 1(插页二)
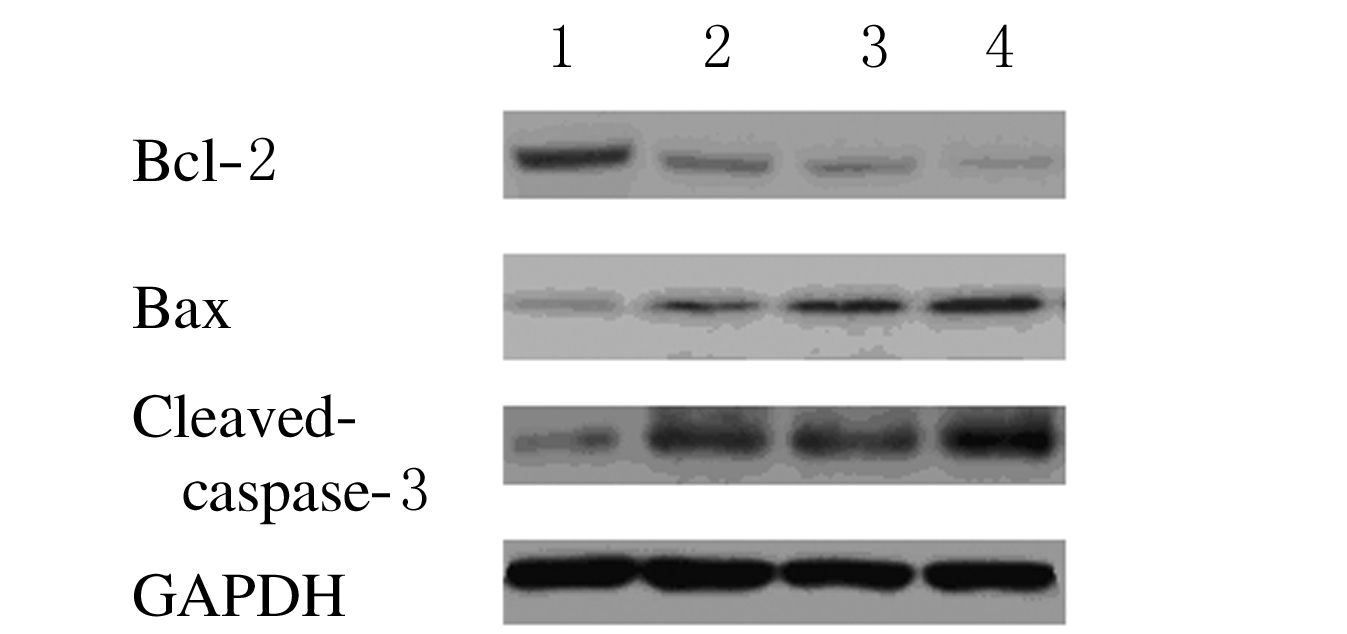
2.3 各组HeLa细胞中BcL-2、Bax>和caspase-3 蛋白表达水平各组人宫颈癌HeLa细胞株培养12h 后,与对照组比较,胡桃醌组、顺铂组细胞中Bcl-2蛋白表达水平明显降低,而Bax和Cleave-caspase-3 蛋白表达水平明显升高,联合用药组Bcl-2蛋白表达下降较明显,Bax和Cleave-caspase-3 蛋白表达水平明显升高。见图 2。
|
| 图 2 各组HeLa细胞中Bcl-2、Bax和Cleaved-caspase-3 表达水平电泳图 Figure 2 Electrophoregram of expression levels of Bcl-2,Bax,and caspase-3 in HeLa cells in various groups |
|
|
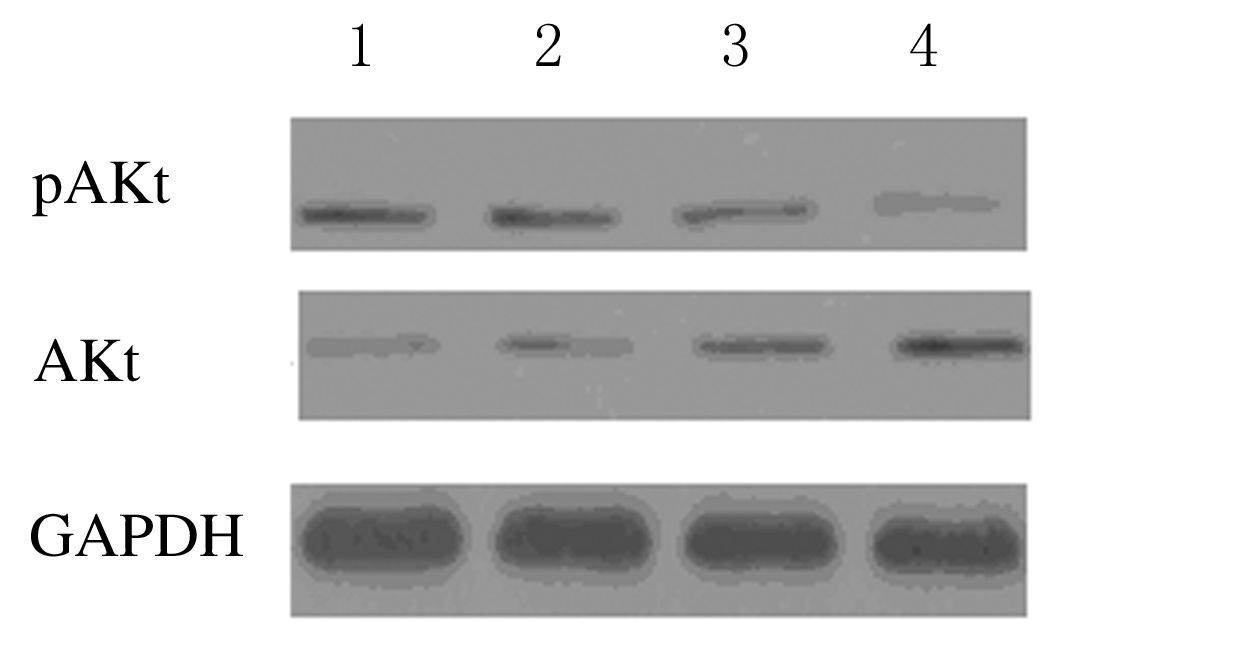
法检测各组HeLa细胞中AKt和pAKt蛋白表达水平 与对照组比较,胡桃醌组、顺铂组和联合用药组细胞中pAKt表达水平明显降低,Akt 表达水平增加,以联合用药组变化更为明显。见图 3。
|
| 图 3 各组HeLa细胞中AKt和pAKt蛋白表达水平电泳图 Figure 3 Electrophoregram of expression levels of AKtand pAKt in HeLa cells in various groups |
|
|
胡桃醌可与Pin1催化域不可逆性结合,抑制Pin1的活性,抑制细胞的增殖,促进细胞的凋亡[11]。顺铂可导致DNA单链内两点或双链发生交叉联接,从而引起复制阻滞和转录抑制,进而诱导细胞凋亡[12-14]。本研究中,胡桃醌组、顺铂组细胞中Bcl-2表达水平降低而Bax表达水平增加,而联合用药组则表现更明显,说明胡桃醌与顺铂联合使用可增加细胞的增殖抑制作用。Brown[15]研究表明:Akt可调节各种细胞功能,其中包括诱导下游靶基因磷酸化而调控细胞凋亡,增加pAkt表达水平,并可增加细胞葡萄糖的摄取,而Akt可导致凋亡相关蛋白磷酸化,减少凋亡的发生。本研究结果显示:各组细胞中p-Akt表达水平降低,抑制了凋亡相关蛋白的磷酸化过程,Bcl-2/Bax异源二聚体形成减少,而Bax同源二聚体形成增加 [16]。在线粒体外膜形成孔洞使细胞色素C从线粒体膜间隙释放出来,导致caspase级联的激活,并刺激PARP的裂解,这是细胞凋亡起始的关键指标[17-19]。
本研究结果表明 :胡桃醌和顺铂可抑制HeLa细胞的PI3K/Akt通路,而联合用药后该现象更加明显,说明联合用药对肿瘤代谢产生影响,可抑制肿瘤代谢,关于对PI3K/Akt下游靶基因的调控及对细胞葡萄糖摄取影响需进一步研究。
综上所述,胡桃醌和顺铂单独及联合应用,能够通过诱导人子宫颈癌HeLa细胞发生凋亡而发挥抑制HeLa细胞生长作用; 抑制PI3K/Akt3的激活是胡桃醌体外诱导人子宫颈癌HeLa 细胞发生凋亡的重要作用机制之一;胡桃醌与顺铂联合用药对宫颈癌细胞的抑制作用更加明显。
| [1] | Eskander RN, Tewari KS. Chemotherapy in the treatment of metastatic, persistent, and recurrent cervical cancer[J]. Curr Opin Obstet Gynecol , 2014, 26 (4) : 314–321. DOI:10.1097/GCO.0000000000000042 |
| [2] | Chao A, Lin CT, Lai CH. Updates in systemic treatment for metastatic cervical cancer[J]. Curr Treat Options Oncol , 2014, 15 (1) : 1–13. DOI:10.1007/s11864-013-0273-1 |
| [3] | Chao SH, Greenleaf AL, Price DH. Juglone, an inhibitor of the peptidyl-prolyl isomerase Pin1, also directly blocks transcription[J]. Nucleic Acids Res , 2001, 29 (3) : 767–773. DOI:10.1093/nar/29.3.767 |
| [4] | Xu HL, Yu XF, Qu SC, et al. Anti-proliferative effect of Juglone from Juglans mandshurica Maxim on human leukemia cell HL-60 by inducing apoptosis through the mitochondria-dependent pathway[J]. Eur J Pharmacol , 2010, 645 (1-3) : 14–22. DOI:10.1016/j.ejphar.2010.06.072 |
| [5] | Wahedi HM, Lee TH, Moon EY, ey al. Juglone up-regulates sirt1 in skin cells under normal and UVB irradiated conditions[J]. J Dermatol Sci , 2016, 81 (3) : 210–212. DOI:10.1016/j.jdermsci.2015.12.005 |
| [6] | Fiorito S, Genovese S, Taddeo VA, et al. Novel juglone and plumbagin 5-O derivatives and their in vitro growth inhibitory activity against apoptosis-resistant cancer cells[J]. Bioorg Med Chem Lett , 2016, 26 (2) : 334–337. DOI:10.1016/j.bmcl.2015.12.017 |
| [7] | Fang F, Qin Y, Qi L, et al. Juglone exerts antitumor effect in ovarian cancer cells[J]. Iran J Basic Med Sci , 2015, 18 (6) : 544–548. |
| [8] | 张巍, 吴亚猛, 陈思瑶, 等. 胡桃醌对宫颈癌SiHa细胞增殖及细胞周期的影响[J]. 吉林大学学报:医学版 , 2015, 41 (4) : 697–700. |
| [9] | Zhang W, Liu A, Li Y, et al. Anticancer activity and mechanism of juglone on human cervical carcinoma HeLa cells[J]. Can J Physiol Pharmacol , 2012, 90 (11) : 1553–1558. DOI:10.1139/y2012-134 |
| [10] | 张巍, 朱文赫, 李妍, 等. 胡桃醌及其与顺铂联用对宫颈癌HeLa细胞存活和凋亡的影响[J]. 中国药理学与毒理学杂志 , 2013, 27 (4) : 663–666. |
| [11] | Hu YG, Shen YF, Li Y. Effect of Pin1 inhibitor juglone on proliferation, migration and angiogenic ability of breast cancer cell line MCF7Adr[J]. J Huazhong Univ Sci Technolog Med Sci , 2015, 35 (4) : 531–534. DOI:10.1007/s11596-015-1465-7 |
| [12] | 徐冶, 李质馨, 曹慧玲, 等. 3-甲基腺嘌呤对顺铂诱导HeLa细胞凋亡的影响[J]. 解剖学报 , 2012, 43 (1) : 59–62. |
| [13] | Logotheti S, Khoury N, Vlahopoulos SA, et al. N-bromotaurine surrogates for loss of antiproliferative response and enhances cisplatin efficacy in cancer cells with impaired glucocorticoid receptor[J]. Transl Res , 2016, S1931 (16) : 101–108. |
| [14] | Nakano K, Sato Y, Toshiyasu T, et al. Predictive factors of head and neck squamous cell carcinoma patient tolerance to high-dose cisplatin in concurrent chemoradiotherapy[J]. Mol Clin Oncol , 2016, 4 (2) : 303–309. |
| [15] | Brown JR. The PI3K pathway:clinical inhibition in chronic lymphocytic leukemia[J]. Semin Oncol , 2016, 43 (2) : 260–264. DOI:10.1053/j.seminoncol.2016.02.004 |
| [16] | Tan ML, Ooi JP, Ismail N, et al. Programmed cell death pathways and current antitumor targets[J]. Pharm Res , 2009, 26 (7) : 1547–1560. DOI:10.1007/s11095-009-9895-1 |
| [17] | Bourdeanu L, Luu T. Targeted therapies in breast cancer:implications for advanced oncology practice[J]. J Adv Pract Oncol , 2014, 5 (4) : 246–260. |
| [18] | 刘倩, 刘忠山, 赵汝栋, 等. 顺铂增敏同步放化疗治疗中晚期宫颈癌的疗效[J]. 中国老年学杂志 , 2014, 34 (16) : 4712–4714. |
| [19] | 王蓓, 邢邯英, 李建立, 等. 阿司匹林对宫颈癌Hela细胞凋亡及增殖的影响[J]. 中国老年学杂志 , 2014, 34 (9) : 2459–2462. |
 2016, Vol. 42
2016, Vol. 42


