扩展功能
文章信息
- 周丽佳, 徐召南, 毕也, 杨鹤, 张泽兵, 王舒煜, 贾杰
- ZHOU Lijia, XU Zhaonan, BI Ye, YANG He, ZHANG Zebing, WANG Shuyu, JIA Jie
- 载顺铂联合氯喹聚乳酸静电纺丝膜对口腔鳞状细胞癌CAL-27细胞增殖的抑制作用
- Inhibitory effect of poly(lactic acid) electrospun membranes loaded with cisplatin and chloroquine on proliferation of oral squamous cell carcinoma CAL-27 cells
- 吉林大学学报(医学版), 2016, 42(05): 892-896
- Journal of Jilin University (Medicine Edition), 2016, 42(05): 892-896
- 10.13481/j.1671-587x.20160510
-
文章历史
- 收稿日期: 2016-01-24
2. 大庆医学高等专科学校临床医学系, 黑龙江 大庆 163312;
3. 吉林大学中日联谊医院电诊科, 吉林 长春 130033
2. Department of Clinical Medicine, Daqing Medcial College, Daqing 163312, China;
3. Department of Eelectronic Diagnosis, China-Japan Union Hospital, Jilin University, Changchun 130033, China
纳米纤维药物载体能够延长药物作用时间,维持局部药物浓度,提高化疗药物疗效和减少不良反应。其中,静电纺丝技术作为药物转运系统的载体获得了很大的关注。 细胞自噬是一种细胞正常的生理现象,在应激状态下维持细胞的正常生理功能,研究[1]表明:下调自噬可以增强口腔癌对化疗药物的敏感性。本研究将自噬抑制剂氯喹(chloroquine,CQ)、化疗药顺铂(DPP)通过静电纺丝技术制备成载DDP联合CQ聚乳酸(PLA)静电纺丝膜作用于口腔癌CAL-27细胞,通过测定静电纺丝膜的降解速率、表型、细胞增殖活性和自噬特异性蛋白LC3-Ⅱ的表达,研究载DDP联合CQPLA静电纺丝膜对CAL-27细胞的体外杀伤作用,为口腔癌的治疗提供一个新靶点、新思路和新方法。
1 材料与方法 1.1 细胞、主要试剂和仪器口腔鳞状细胞癌CAL-27细胞株由上海交通大学附属口腔医学院陈万涛教授惠赠。H-DMEM培养基粉剂、胎牛血清和牛血清白蛋白(BSA)(美国Gibco公司),青霉素-链霉素(奥地利PAA公司),4-羟乙基哌嗪乙磺酸(HEPES)和二甲基亚砜(DMSO)(美国Sigma 公司),DDP和CQ(中国食品药品检定研究所),噻唑蓝(MTT)和FITC标记的山羊抗兔二抗(北京中杉金桥公司),MAP1-LC3兔多克隆抗体(美国Santa Cruz公司),Annexin V-FITC/PI 试剂盒(凯基生物有限公司),细胞周期与细胞凋亡检测试剂盒(碧云天生物技术研究所)。静电纺丝膜由吉林大学化学院提供:① 载白蛋白聚乳酸静电纺丝膜(BSA/PLA膜);② 载顺铂聚乳酸静电纺丝膜(DDP/PLA膜);③ 载氯喹/顺铂/氯喹聚乳酸静电纺丝膜(CQ/DPP/CQ/PLA膜,复合膜),复合膜为夹层结构,中间为DDP膜,两侧为CQ膜;④ 载氯喹/顺铂聚乳酸静电纺丝膜(CQ/DDP/PLA膜,共混膜),共混膜为由CQ和DDP同时混纺而成。复合膜和共混膜是本研究的载顺铂联合氯喹聚乳酸静电纺丝膜的2种类型。
1.2 细胞培养口腔鳞状细胞癌CAL-27细胞在含10%胎牛血清的H-DMEM培养基(含100 U·mL-1青霉素和100 mg·L-1链霉素)中,置于37℃、5%CO2、95%相对湿度的培养箱中培养。每2 d换液传代1次,使细胞保持对数生长状态,取对数生长期细胞进行实验。
1.3 扫描电镜(SEM)观察纳米纤维膜表面形态在纤维表面喷金,将共混膜、复合膜和DDP/PLA膜送检观察。
1.4 紫外分光光度分析法测定PLA膜降解速率通过电子天平精确称取BSA/PLA膜447 mg,其中BSA为34.60 mg。将样品置于小烧杯中后倒入50 mL的PBS缓冲液对样品进行浸泡,密封后再将小烧杯放于37℃条件下进行动态透析,分别于1、2、3、5和7 d取释放液5 mL,取释放液直至药物释放完全,每次取完释放液后迅速补充空白PBS缓冲液5 mL,使原体积保持不变。采用紫外分光光度计于波长280 nm处对所取释放液进行吸光度(A)值测定, 根据标准曲线计算不同时间BSA/PLA膜释放出的BSA的量,根据计算所得到的累积释放量绘制成体外释放曲线。
1.5 激光共聚焦显微镜检测CAL-27细胞中自噬特异性蛋白LC3-Ⅱ表达 实验分为5组,分别为对照组、CQ组、DDP/PLA膜组、复合膜组和共混膜组。将处于对数生长期的CAL-27细胞接种于含有盖玻片的6孔细胞培养板内,每孔细胞密度为2.5×104个细胞,置于 37℃﹑5%CO2孵箱中培养24 h。将上清液吸走弃掉,按上述分组加入相应药膜和药物后,置于37℃﹑5%CO2孵箱中培养1、3、5和7 d。收获细胞后,用4℃丙酮固定细胞15 min,之后用PBS冲洗2次,每次冲洗时间为5 min,冲洗后用1%BSA封闭液封闭细胞30 min,兔抗人MAP1-LC3Ⅱ多克隆抗体(1∶200) 4℃孵育过夜;第2天,用PBS冲洗2次,每次5 min,冲洗完成后加入FITC标记的山羊抗兔IgG二抗,在37℃条件下于避光孵育1 h,用PBS冲洗2次,每次冲洗5 min,之后用PI核染色2 min,PBS冲洗2次,封片,完成后在激光共聚焦显微镜下观察、摄片。
1.6 MTT法检测加入药膜后CAL-27细胞的生存率实验分为4组,分别为对照组、DDP/PLA膜组、复合膜组和共混膜组。将处于对数生长期的CAL-27细胞接种于96孔细胞培养板中(细胞密度为每孔6×103个细胞),每孔加入200 μL细胞悬液,置于37℃、5%CO2孵箱培养24 h后,将上清液吸走弃掉,各组加入相应药膜。置于37℃、5%CO2孵箱中培养1、3、5和7 d后各组每孔加入20 μL MTT溶液,置于37℃﹑5%CO2孵箱中培养4 h。将上清液吸走弃掉,各组每孔加入150 μL DMSO,于室温下振荡10 min,通过酶标仪在波长490 nm处检测各孔的A值,计算细胞生存率。实验重复3次。细胞生存率=实验组A值/对照组A值×100%。
1.7 统计学分析采用SPSS 17.0软件进行统计学分析。细胞生存率以x±s表示,组间比较采用t检验。以P<0.05表示差异有统计学意义。
2 结 果 2.1 DDP/PLA膜、复合膜及共混膜的表面形态SEM观察可见:DDP/PLA膜、复合膜及共混膜中纳米纤维表面光滑,纤维直径较均匀,表明DDP和CQ已经被包埋进静电纺丝中。见图 1。

|
| 图 1 SEM下观察DDP/PLA膜(A)、复合膜(B)和共混膜(C)表面形态 Figure 1 Surface morphology of DDP/PLA membranes(A),CQ/DDP/CQ/PLA membranes(B) and CQ/DDP/PLA membranes(C) observed by SEM |
|
|
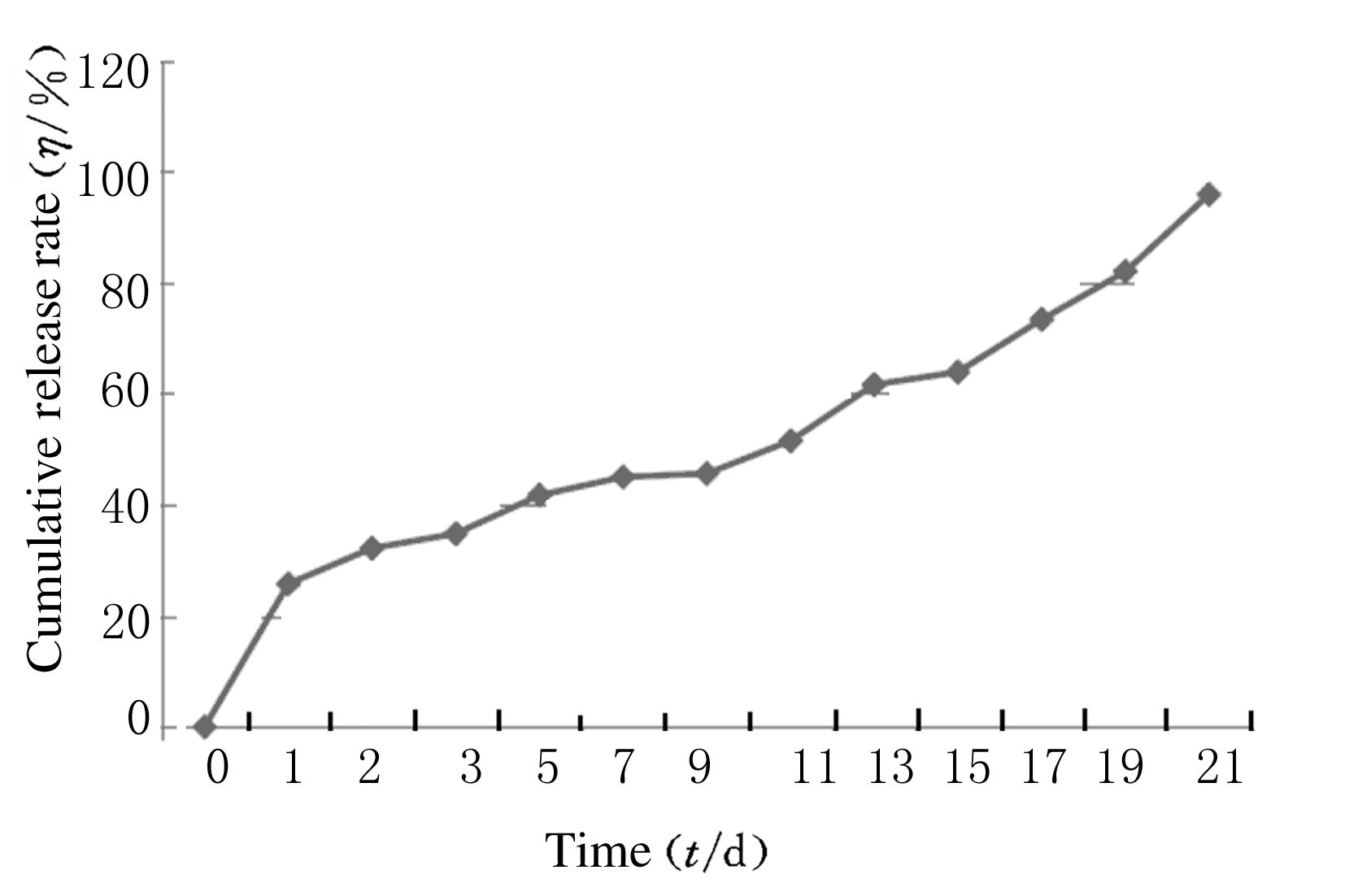
根据图 2中累积释放曲线可以看出:药膜在PBS中释放均匀缓慢。第1天时BSA/PLA膜中BSA的累积释放量约为25.76%,以后呈近似线性逐渐缓慢释放,至第21天时BSA/PLA膜中BSA的累积释放量约为95.85%,表明BSA释放趋于完全。
|
| 图 2 BSA/PLA膜体外累积释放曲线 Figure 2 Cumulative release curves of BSA/PLA membranes in vitro |
|
|
本实验采用绿色荧光 FITC 标记的自噬特异性蛋白LC3-Ⅱ,采用红色荧光PI标记DNA,通过激光共聚焦显微镜观察各组CAL-27细胞中LC3-Ⅱ的表达情况。在激光共聚焦显微镜下可以观察到LC3-Ⅱ在细胞中分布清晰,细胞质内LC3-Ⅱ绿色荧光呈点状散在分布,复合膜组和共混膜组荧光亮度均低于DDP/PLA膜组,表明CQ从静电纺丝膜中释放并起到下调自噬的作用。见图 3(插页二)。
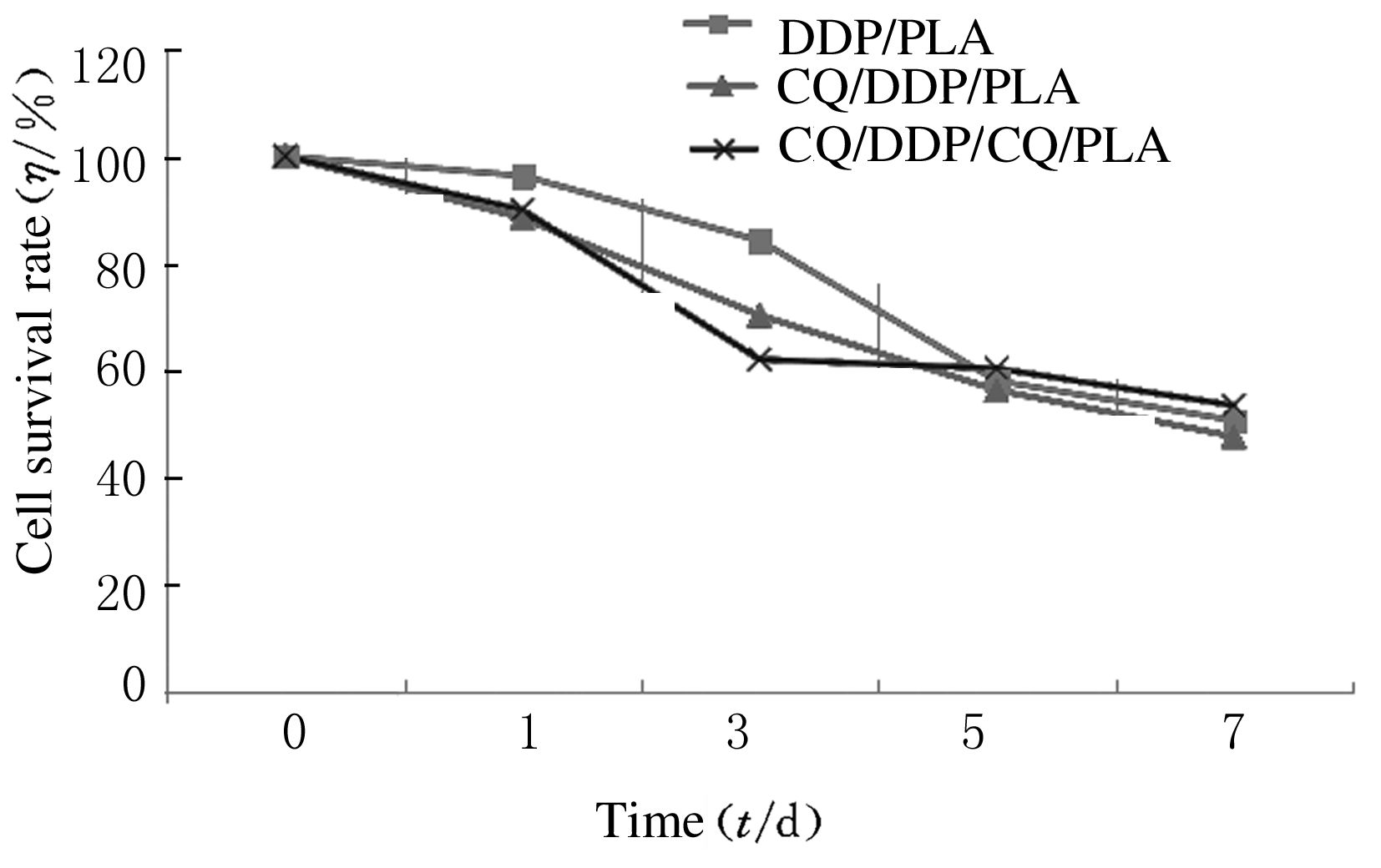
2.4 MTT法检测各组CAL-27细胞生存率与对照组比较,第1天DDP/PLA膜组、复合膜组和共混膜组对细胞的杀伤作用不明显(P>0.05);第3天以后,DDP/PLA膜组、复合膜组和共混膜组细胞生存率开始下降(P<0.05),说明DDP/PLA膜组、复合膜组和共混膜组具有缓释作用,随着时间的推移对细胞的杀伤作用增加。另外,由于复合膜组和共混膜组内的顺铂含量低于DDP/PLA膜组,而复合膜组和共混膜组细胞生存率与DDP/PLA膜组细胞生存率相近甚至有时低于DDP/PLA膜组,说明复合膜和共混膜中所含有的CQ起到了下调自噬的作用,增强了DDP对细胞的杀伤作用。见图 4。
|
| 图 4 各组CAL-27细胞生存率 Figure 4 Survival rates of CAL-27 cells in various groups |
|
|
目前口腔鳞状细胞癌的治疗采取以手术治疗为主,辅以化疗和放疗的综合治疗策略。虽然口腔癌的治疗得到改进,但口腔癌患者5年生存率无明显的提高[2-3]。化疗有易产生耐药性、不良反应明显等缺点[4]。因此提高肿瘤细胞对化疗药物的敏感性、延长化疗药物在体内的有效浓度时间、降低不良反应是目前亟待解决的问题。
研究[5-6]表明:在放疗和化疗对肿瘤细胞产生杀伤作用时,自噬可以清理受损的细胞器,使肿瘤细胞逃脱死亡而存活,是肿瘤细胞产生耐药的机制之一[7]。自噬的改变可能会引发多种疾病的发生,如神经退行性疾病、炎症性肠病、肝功能衰竭和衰老,最严重的是癌症的发生[8]。自噬在营养不足时通过抑制凋亡保护肿瘤细胞免于死亡[9]。大量癌症模型实验[10]表明:下调自噬可增强对癌症的治疗效果,如乳腺癌、神经胶质瘤、前列腺癌和结肠癌等癌症模型。自噬抑制剂CQ及其衍生物羟氯喹通过改变溶酶体pH值损害溶酶体的功能,抑制溶酶体依赖的自噬体降解,从而下调自噬[11-12]。CQ联合DNA烷基化制剂环磷酰胺对肿瘤杀伤作用明显增加,能够推迟肿瘤的复发[13]。
静电纺丝纳米纤维适用于药物载体主要有2个特点:一方面静电纺丝纳米纤维具有较大的表面积与体积比、高的孔隙率,可以克服局限性药物的吸收、药物扩散的限制,提高药物的总释放率;另一方面,直径、孔隙度和形态学处理以及不同的材料也可以调节药物的释放速率[4]。纳米静电纺丝膜被广泛应用于抗生素、抗肿瘤药物和生物大分子等药物的控制释放。如将载有顺铂的生物可降解纳米纤维膜应用于肺癌切除术后局部复发的研究,这种纳米纤维膜具有超疏水性,可以控制顺铂药物呈线性方式释放。与正常体内同等剂量直接给药比较,采用上述载药纳米纤维膜,可在一定程度上有效预防肺癌患者术后局部的复发[14]。载有阿霉素(DOX)的具有核壳结构的纳米纤维,可将药物直接释放到卵巢癌SKOV3细胞的细胞核中,能有效阻止卵巢癌细胞SKOV3的附着和增殖,并且可以在一定程度上调节DOX的载入量和药物的释放速度,在保证治疗效率的前提下还可以大大降低化疗剂施用的频率并减少其不良反应的产生[15-18]。
本研究对CAL-27细胞内表达的LC3-Ⅱ蛋白进行荧光染色,通过激光共聚焦显微镜观察CAL-27细胞中自噬的分布情况显示:共混膜组和复合膜组细胞中LC3-Ⅱ荧光强度低于DDP/PLA组,表明共混膜和复合膜内含有CQ并得到了释放,并能够下调CAL-27细胞的自噬表达水平。DDP/PLA膜组、复合膜组和共混膜组CAL-27细胞的体外杀伤实验表明:随着时间的延长,DDP/PLA膜组、复合膜组和共混膜组对CAL-27细胞的杀伤作用均逐渐增加,与对照组比较,DDP/PLA膜组、复合膜组和共混膜组的CAL-27细胞生存率呈逐渐下降趋势,第1天由于DDP从载药静电纺丝膜中的累积释放量较少,对CAL-27细胞杀伤作用不明显。第3天以后,DDP/PLA膜组、复合膜组和共混膜组CAL-27细胞生存率逐渐降低。本研究结果表明:DDP/PLA膜、复合膜和共混膜能够作为一种缓释药剂,使DDP随着时间的延长不断从载药静电纺丝膜中释放出来并维持较高浓度,在较长时间内保持对口腔癌CAL-27细胞的杀伤作用,降低DDP所引发的不良反应,延长其对CAL-27细胞的作用时间。另外,复合膜和共混膜中所含DDP量少于DDP/PLA膜中的DDP含量,但对CAL-27细胞的杀伤效果与DDP/PLA膜相近,甚至高于DDP/PLA膜的杀伤效果,说明复合膜和共混膜中的CQ起到了下调自噬的作用,使DDP对CAL-27细胞的杀伤作用得到了增强,提高了口腔癌CAL-27细胞对DDP的敏感性。因此,共混膜和复合膜具有较好的优越性,能提高局部药物浓度,使CAL-27细胞内的自噬水平得到下调,增强DDP对CAL-27细胞的杀伤效果,达到了预期目的。
综上所述,载DDP联合CQ的静电纺丝膜能下调自噬,延长药物作用时间,提高化疗的敏感性,增强DDP对口腔鳞状细胞癌的杀伤作用,可在肿瘤术后局部应用,对预防肿瘤复发有很好的临床应用前景。
| [1] | 全海英, 周丽佳. 氯喹增强口腔癌CAL-27细胞对顺铂化疗敏感性的观察[J]. 上海口腔医学 , 2015, 2 (1) : 30–37. |
| [2] | 李金忠, 李鑫, 郑家伟. 早期口腔癌检查及诊断方法的研究进展[J]. 中国口腔颌面外科杂志 , 2012, 10 (6) : 516–521. |
| [3] | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2015[J]. CA Cancer J Clin , 2015, 65 (1) : 5–29. DOI:10.3322/caac.21254 |
| [4] | 玄云泽, 张建国, 张杰, 等. 靶向持续性组织间化疗治疗舌鳞癌的初步观察[J]. 实用口腔医学杂志 , 2006, 22 (2) : 148–150. |
| [5] | Chen S, Rehman SK, Zhang W, et al. Autophagy is a therapeutic target in anticancer drug resistance[J]. Biochim Biophys Acta , 2010, 1806 (2) : 220–229. |
| [6] | Kung CP, Budina A, Balaburski G, et al. Autophagy in tumor suppression and cancer therapy[J]. Crit Rev Eukaryot Gene Expr , 2011, 21 (1) : 71–100. DOI:10.1615/CritRevEukarGeneExpr.v21.i1 |
| [7] | Huang Z, Zhou L, Chen Z, et al. Stress management by autophagy:implications for chemoresistance[J]. Int J Cancer , 2016, 139 (1) : 23–32. DOI:10.1002/ijc.29990 |
| [8] | Naveed S, Aslam M, Ahmad A. Starvation based differential chemotherapy:A novel approach for cancer treatment[J]. Oman Med J , 2014, 29 (6) : 391–398. DOI:10.5001/omj.2014.107 |
| [9] | Kim H, Moon JY, Ahn KS, et al. Quercetin induces mitochondrial mediated apoptosis and protective autophagy in human glioblastoma U373MG cells[J]. Oxid Med Cell Longev , 2013 : 596496. DOI:10.1155/2013/596496 |
| [10] | Chen N, Karantza V. Autophagy as a therapeutic target in cancer[J]. Cancer Biol Ther , 2011, 11 (2) : 157–168. DOI:10.4161/cbt.11.2.14622 |
| [11] | Glaumann H, Ahlberg J. Comparison of different autophagic vacuoles with regard to ultrastructure, enzymatic composition, and degradation capacity——formation of crinosomes[J]. Exp Mol Pathol , 1987, 47 (3) : 346–362. DOI:10.1016/0014-4800(87)90018-9 |
| [12] | Poole B, Ohkuma S. Effect of weak bases on the intralysosomal pH in mouse peritoneal macrophages[J]. J Cell Biol , 1981, 90 (3) : 665–669. DOI:10.1083/jcb.90.3.665 |
| [13] | Klionsky DJ, Abdalla FC, Abeliovich H, et al. Guidelines for the use and interpretation of assays for monitoring autophagy[J]. Autophagy , 2016, 12 (1) : 1–222. DOI:10.1080/15548627.2015.1100356 |
| [14] | Kaplan JA, Liu R, Freedman JD, et al. Prevention of lung cancer recurrence using cisplatin-loaded superhydrophobic nanofiber meshes[J]. Biomaterials , 2016, 76 : 273–281. DOI:10.1016/j.biomaterials.2015.10.060 |
| [15] | Yan E, Fan Y, Sun Z, et al. Biocompatible core-shell electrospun nanofibers as potential application for chemotherapy against ovary cancer[J]. Mater Sci CMater Biol Appl , 2014, 41 : 217–223. DOI:10.1016/j.msec.2014.04.053 |
| [16] | Yang G, Wang J, Wang Y, et al. An implantable active-targeting micelle-in-nanofiber device for efficient and safe cancer therapy[J]. ACS Nano , 2015, 9 (2) : 1161–1174. DOI:10.1021/nn504573u |
| [17] | 郭鹏荣, 盛玉文, 刘奔, 等. 灵芝多糖对顺铂抑制荷膀胱癌T24细胞裸鼠肿瘤生长及血管生成作用的影响[J]. 解放军医学杂志 , 2014, 39 (6) : 470–474. |
| [18] | 赵晓彪, 李光耀, 刘孟刚, 等. Tmub1过表达及沉默慢病毒载体转染对大鼠BRL-3A肝细胞增殖的影响[J]. 解放军医学杂志 , 2016, 41 (1) : 12–16. |
 2016, Vol. 42
2016, Vol. 42


