扩展功能
文章信息
- 于雷, 王蕴龙, 陈志深, 王新春, 郜玉钢, 贾晓晶
- YU Lei, WANG Yunlong, CHEN Zhishen, WANG Xinchun, GAO Yugang, JIA Xiaojing
- 鹿角脱盘对辐射诱发小鼠胸腺淋巴瘤Notch2基因表达和免疫功能的影响
- Influence of antlerbase on Notch2 gene expression and immune functionof mice with thymic lymphomas induced by ionizing radiation
- 吉林大学学报(医学版), 2016, 42(05): 887-891
- Journal of Jilin University (Medicine Edition), 2016, 42(05): 887-891
- 10.13481/j.1671-587x.20160509
-
文章历史
- 收稿日期: 2016-03-27
2. 吉林农业大学中药材学院中药生物技术教研室, 吉林 长春 130118
2. Department of Biological Technology of Traditional Chinese Medicine, College of Chinese Medicinal Materials, Jilin Agricultural University, Changchun 130118, China
电离辐射是一种确定的致癌因素[1],但其确切机制尚未完全阐明。鹿角脱盘是雄性梅花鹿或马鹿锯茸后于次年脱落的盘状骨化残角,具有活血化瘀、健骨强筋及补肝肾等功效,近期研究[2]发现:鹿角脱盘提取物对小鼠乳腺癌细胞MA782 的增殖有明显抑制作用,其通过抑制细胞端粒酶活性,使端粒酶催化亚基TERT基因的表达水平下降,表现出一定的抗肿瘤活性,但关于鹿角脱盘与辐射致癌的相关性研究尚无确切报道。本研究在探讨辐射致癌发生机制的同时,采用超微粉碎技术处理鹿角脱盘制备超微粉,研究其对辐射诱发胸腺淋巴瘤中Notch2基因表达和小鼠免疫功能的影响,进而评价鹿角脱盘在辐射致癌中的作用。
1 材料与方法 1.1 实验动物、主要试剂和仪器近交系BALB/c小鼠90只,雌性,体质量(18±2)g,由白求恩医学院实验动物中心提供[动物生产许可证号:SCXK(吉)2008-0005]。鹿角脱盘购自长春市东大鹿业有限公司。RNA提取剂和逆转录PCR(RT-PCR)试剂盒购自天根生化科技(北京)有限公司,蛋白质免疫印记发光试剂盒购自美国Santa Cruz公司,小鼠血清免疫球蛋白(IgG、IgA和 IgM)ELISA试剂盒购自上海丽臣生物科技有限公司,超氧化物歧化酶(SOD) 试剂盒购自浙江爱康生物科技有限公司。2700型 PCR扩增仪购自美国ABI公司,酶标仪购自上海纤检仪器有限公司,Jel Doc2001型凝胶成像仪购自美国BIO-RAD公司,超微粉碎机购自济南倍力粉技术有限公司,激光粒度分析仪购自美国Beckman Counter 公司。
1.2 鹿角脱盘超微粉和鼠粮的制备将鹿角脱盘制成粗粉,采用超微粉碎机将其粉碎为粒径为60~150μm的超微粉,采用激光粒度分析仪进行检测。鼠粮的制备: 将商品鼠粮粉碎成粉末,按照《中国药典》2005年版的标准,以2 g·kg-1的比例添加鹿角脱盘超微粉,充分混匀后压制成棒状鼠粮。
1.3 小鼠胸腺淋巴瘤模型的建立将90只近交系BALB/c小鼠随机分成对照组、照射组和照射给药组,每组30只,采用深部X射线治疗机对照射组和照射给药组小鼠进行照射,源皮距100 cm,剂量率0.287 Gy·min-1,每次1.75 Gy,每周1次,共4次,总剂量7 Gy[3];照射后,对照组和照射组小鼠喂饲正常鼠粮,照射给药组小鼠喂饲含鹿角脱盘超微粉的鼠粮。6个月后,将3组小鼠处死,取全血和胸腺,全血采用3 500 r ·min-1离心20 min,取血浆于-80℃条件下保存备用,部分胸腺组织行病理检查,判断其是否成瘤,并计算胸腺淋巴瘤的发生率。发生率计算公式:胸腺淋巴瘤发生率=胸腺淋巴瘤小鼠只数/照射小鼠只数×100%。
1.4 RT-PCR法检测小鼠不同胸腺组织中Notch2mRNA表达水平分别从照射组和照射给药组小鼠形成的胸腺淋巴瘤及对照组正常胸腺组织各取出6个样品,分别提取总RNA,然后逆转录成cDNA,-20℃保存备用。用Primer Premier 6设计引物,Notch2:上游引物 5′-CGAGACCCAGTACAGTGAAA-3′,下游引物5′-GGGATAAGCTGGAAAGTCA-3′,产物长度156 bp; β-actin:上游引物5′-AGGTATCCTGACCCTGAAGT-3′,下游引物5′-GCTCGTTGCCAATAGTGAT-3′,产物长度575 bp,将扩增产物行1.5%琼脂糖凝胶电泳,图像扫描后,用Quantity One 4.6.2图像分析软件进行分析,以Notch2与β-actin灰度值之比表示Notch2mRNA表达水平。
1.5 Westernblotting法检测Notch2蛋白表达水平具体方法参考文献[4],单去污裂解法提取总蛋白,考马斯亮蓝染色试剂盒进行蛋白定量,取处理后的30 g蛋白样品,进行SDS-PAGE电泳、转膜、封闭、抗体孵育和化学发光,同时以β-actin作为内参照,将胶片扫描后,用Quantity One 4.6.2图像分析软件分析条带灰度,以Notch2与β-actin灰度值之比表示Notch2蛋白表达水平。
1.6 小鼠免疫功能检测取1.4 中3组样品对应的小鼠血清,用小鼠血清免疫球蛋白(IgG、IgA和 IgM)ELISA试剂盒和酶标仪检测450 nm处吸光度(A) 值,通过标准曲线计算样品中小鼠免疫球蛋白的浓度,采用 SOD 试剂盒检测小鼠血清中 SOD 活性。
1.7 统计学分析采用SPSS 17.0统计软件进行统计学处理。Notch2mRNA和蛋白表达水平及小鼠免疫功能指标均以x±s表示,多组间样本均数比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结 果 2.1 电离辐射诱发小鼠胸腺淋巴瘤发生率照射给药组小鼠胸腺瘤发生率[36.67%(11/30)]低于照射组小鼠[53.33%(16/30)]。
2.2 RT-PCR法检测各组小鼠不同胸腺组织中Notch2mRNA表达水平 照射组小鼠胸腺淋巴瘤组织中Notch2mRNA表达水平(1.29 ± 0.06)较对照组正常胸腺组织中Notch2mRNA表达水平(0.65 ± 0.05)明显增高(P<0.05);照射给药组小鼠胸腺淋巴瘤组织中Notch2mRNA表达水平(0.91 ± 0.03)明显低于照射组(P<0.05)。见图 1。

|
| 图 1 RT-PCR法检测各组小鼠不同胸腺组织中Notch2 mRNA表达电泳图 Figure 1 Electrophoregram of Notch2 mRNA expressions in different thymic tissues of mice in various groups detected by RT-PCR |
|
|
blotting法检测各组小鼠不同胸腺组织中Notch2蛋白表达水平 照射组小鼠胸腺淋巴瘤组织中Notch2蛋白表达水平(0.93±0.06)较对照组(0.56±0.04)明显增高( P<0.05);照射给药组小鼠胸腺淋巴瘤组织中Notch2蛋白表达水平(0.74±0.03)明显低于照射组(P<0.05)。见图 2。
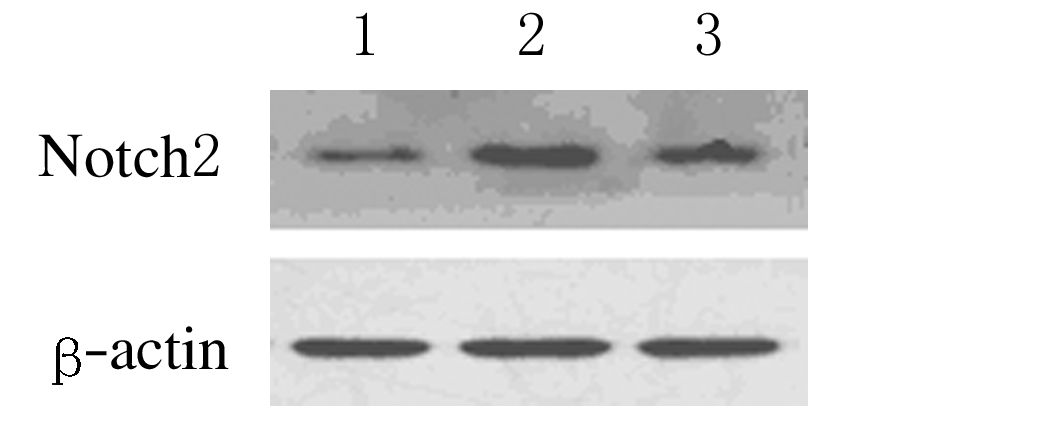
|
| 图 2 Western blotting法检测各组小鼠不同胸腺组织中Notch2蛋白表达电泳图 Figure 2 Electrophoregram of Notch2 protein expressions in different thymic tissues of mice in various groups detected by Western blotting method |
|
|
照射组小鼠血清中IgG、IgA和 IgM水平均低于对照组(P<0.05),照射给药组小鼠血清中IgG和IgM水平均高于照射组(P<0.05)。见表 1。照射组小鼠血清中血红蛋白水平和SOD 活性略低于对照组,但差异无统计学意义(P>0.05),照射给药组小鼠血清中血红蛋白水平和SOD 活性均高于照射组(P<0.05)。见表 2。
| [n=6,x±s,η,ρB/(mg·L-1)] | |||
| Group | IgG | IgA | IgM |
| Control | 0.78 ±0.11 | 0.23±0.03 | 0.40 ±0.18 |
| Irradiation | 0.53 ±0.09* | 0.14 ±0.04* | 0.26 ±0.11* |
| Combined | 1.04 ±0.06△ | 0.18 ±0.03 | 0.67±0.09△ |
| *P< 0.05 compared with control group; △P< 0.05 compared with irradiation group. | |||
| (n=6,x±s,η) | ||
| Group | Hemoglobin [ρB/(g·L-1)] | SOD [λB/(U·g-1)] |
| Control | 0.11±0.02 | 5.14±0.12 |
| Irradiation | 0.08±0.01 | 4.95±0.09 |
| Combined | 0.14±0.02* | 6.49±0.10* |
| *P< 0.05 compared with irradiation group. | ||
辐射致癌作为电离辐射对机体影响最大的远期效应,阐明其发生机制意义重大。研究[5]表明:DNA双链断裂是电离辐射引起各种生物效应的关键基因毒性损伤,其导致细胞内DNA 错配损伤修复反应,使某些特定基因异常表达,进而引起某些调控细胞增殖、分化和凋亡的信号通路发生功能失调,最终导致肿瘤的发生[6]。
Notch信号通路是各种组织细胞中广泛表达的信号通路之一[7],由Notch受体、配体、细胞内效应器分子和下游靶基因等构成。组织中相邻细胞可通过Notch受体与配体的结合来传递Notch信号,调节下游基因的表达[8],从而调控细胞的增殖、分化和凋亡,使机体维持正常的功能[9]。Notch2是人类Notch受体家族(Notch1~4)成员之一,其受体是由其基因编码的单跨膜蛋白,其异常变化会引起Notch 信号的功能失调,导致细胞发育缺陷,从而发生疾病,其中最重要的是介导肿瘤的发生[10]。研究[11-14]表明:Notch 信号通路的异常活化与多种肿瘤的发生有关,如鼻咽癌、结肠癌、乳腺癌和血液系统肿瘤等。但Notch 信号通路是否参与辐射致癌的发生,尚未见相关报道。本研究结果显示:辐射诱发胸腺淋巴瘤中Notch2 mRNA和蛋白表达水平均高于正常胸腺组织(P<0.05),提示电离辐射通过激活Notch2基因的高表达而引起Notch 信号的功能失调可能是辐射诱发胸腺淋巴瘤的发生机制之一。
血清免疫球蛋白IgG、IgA和IgM的水平反映了B 细胞产生非特异性抗体的能力[15]。本研究结果显示:辐射诱发胸腺淋巴瘤小鼠血清中IgG、IgA和IgM的水平均低于对照组(P<0.05),说明电离辐射损伤了B淋巴细胞的功能,使其分化为浆细胞,分泌抗体的能力降低,提示电离辐射对免疫系统的损伤可能是辐射致癌的一个因素。
鹿角脱盘为我国传统名贵中药鹿茸的副产品,具有温补肝肾、活血消肿、治阴症疮疡和消淤止痛等功效[16]。本研究结果显示:照射给药组小鼠胸腺淋巴瘤组织中Notch2mRNA和蛋白表达水平均低于照射组(P<0.05),血清中IgG和IgM水平均高于照射组(P<0.05),血清中血红蛋白水平和SOD 活性均高于照射组(P<0.05)。电离辐射可引起体内氧自由基的增多[17]。SOD是生物体内氧自由基的天然清除剂,鹿角脱盘可有效提高小鼠血清中SOD活性,进而增加氧自由基的清除率,降低了辐射引起的损伤,从而导致辐射诱发胸腺淋巴瘤成瘤率的降低[18-19]。
综上所述,电离辐射通过激活Notch2基因的高表达和降低小鼠免疫功能可能是辐射诱发胸腺淋巴瘤的发生机制之一;鹿角脱盘可通过抑制Notch2基因的表达和提高小鼠免疫功能而降低辐射致癌的发生率,起到抑制肿瘤作用。但肿瘤发生是多基因、多信号通路参与的复杂过程,本研究仅探讨了鹿角脱盘与Notch2基因表达和免疫功能的相关性,鹿角脱盘是否参与其他过程还有待今后进一步的研究。
| [1] | Borrego-Soto G, Ortiz-López R, Rojas-Martínez A. Ionizing radiation-induced DNA injury and damage detection in patients with breast cancer[J]. Genet Mol Biol , 2015, 38 (4) : 420–432. DOI:10.1590/S1415-475738420150019 |
| [2] | 王佳宁, 郜玉钢, 姬庆, 等. 鹿角盘有效成分及功效研究进展[J]. 上海中医药杂志 , 2015, 49 (4) : 102–105. |
| [3] | 于雷, 刘永哲, 孙世龙, 等. c-myc和k-ras基因多态性与辐射诱发小鼠胸腺淋巴瘤的关联性分析[J]. 吉林大学学报:医学版 , 2009, 35 (2) : 296–298. |
| [4] | 于雷, 邱玲, 孙磊, 等. 辐射诱发胸腺淋巴瘤Kras基因的表达及其启动子甲基化[J]. 吉林大学学报:医学版 , 2014, 40 (6) : 1127–1131. |
| [5] | Liang Y, Yang G, Liu F, et al. Monte Carlo simulation of ionizing radiation induced DNA strand breaks utilizing coarse grained high-order chromatin structures[J]. Phys Med Biol , 2016, 61 (1) : 445–460. DOI:10.1088/0031-9155/61/1/445 |
| [6] | Hwang HJ, Jung SH, Lee HC, et al. Identification of novel therapeutic targets in the secretome of ionizingradiation induced senescent tumor cells[J]. Oncol Rep , 2016, 35 (2) : 841–850. |
| [7] | Radtke F, Fasnacht N, Macdonald HR. Notch signaling in the immune system[J]. Immunity , 2010, 32 (1) : 14–27. DOI:10.1016/j.immuni.2010.01.004 |
| [8] | Jin MM, Ye YZ, Qian ZD, et al. Notch signaling molecules as prognostic biomarkers for non-small cell lung cancer[J]. Oncol Lett , 2015, 10 (5) : 3252–3260. |
| [9] | Yan S, Ma D, Ji M, et al. Expression profile of Notch-related genes in multidrug resistant K562/A02 cells compared with parental K562 cells[J]. Int J Lab Hematol , 2010, 32 (2) : 150–158. DOI:10.1111/clh.2010.32.issue-2 |
| [10] | Puente XS, Pinyol M, Quesada V, et al. Whole-genome sequencing identifies recurrent mutations in chronic lymphocytic leukaemia[J]. Nature , 2011, 475 (7354) : 101–105. DOI:10.1038/nature10113 |
| [11] | Guo S, Liu M, Gonzalez-Perez RR. Role of Notch and its oncogenic signaling crosstalk in breast cancer[J]. Biochim Biophys Acta , 2011, 1815 (2) : 197–213. |
| [12] | Fukaya R, Ohta S, Yamaguchi M, et al. Isolation of cancer stemlike cells from a side population of a human glioblastoma cell line,SK-MG-1[J]. Cancer Lett , 2010, 291 (2) : 150–157. DOI:10.1016/j.canlet.2009.10.010 |
| [13] | Rossi D, Rasi S, Fabbri G, et al. Mutations of Notch1 are an independent independent predictor of survival in chronic lymphocytic leukemia[J]. Blood , 2012, 119 (2) : 521–529. DOI:10.1182/blood-2011-09-379966 |
| [14] | Zhang Y, Li B, Ji ZZ, et al. Notch1 regulates the growth of humancolon cancers[J]. Cancer , 2010, 116 (22) : 5207–5218. DOI:10.1002/cncr.25449 |
| [15] | Ham JY, Suh JS, Lee WK, et al. POEMS syndrome with IgG-λ/IgA-κ biclonal gammopathy and abnormal serum free light chain ratio:a case report[J]. Ann Clin Lab Sci , 2015, 45 (6) : 702–706. |
| [16] | 田玉华, 胡薇. 鹿花盘及其它鹿副产品的研究和开发利用[J]. 时珍国医国药 , 2010, 21 (9) : 2310–2312. |
| [17] | Kehrer JP, Klotz LO. Free radicals and related reactive species as mediators of tissue injury and disease:implications for Health[J]. Crit Rev Toxicol , 2015, 45 (9) : 765–798. DOI:10.3109/10408444.2015.1074159 |
| [18] | 吴国峥, 张青玲, 孙达, 等. 神经淋巴瘤病的18F-PET/CT显像:1例报告并文献复习[J]. 解放军医学杂志 , 2016, 41 (1) : 31–35. |
| [19] | 李月敏, 李扬, 樊文梅, 等. 胸腺瘤与自身免疫性疾病的关系[J]. 解放军医学杂志 , 2014, 39 (8) : 669–672. |
 2016, Vol. 42
2016, Vol. 42


