扩展功能
文章信息
- 惠双, 郭宏强
- HUI Shuang, GUO Hongqiang
- DNA-PKcs介导多药耐药恶性胶质瘤细胞化疗抗性及分子机制
- Chemoresistance of multi-drug resistance malignant glioma cells mediated by DNA-PKcs and its molecular mechanism
- 吉林大学学报(医学版), 2016, 42(05): 877-881
- Journal of Jilin University (Medicine Edition), 2016, 42(05): 877-881
- 10.13481/j.1671-587x.20160507
-
文章历史
- 收稿日期: 2016-04-19
胶质瘤是最常见的脑部恶性肿瘤,起源于神经胶质细胞,其高增殖和侵袭行为导致其复发率居高不下,患者预后较差,中位存活时间低于1.5年[1]。多药耐药(multi-drug resistance,MDR)的产生是脑胶质瘤化疗失败的主要原因,随着化疗时间和次数的延长,MDR关联蛋白表达水平上调,导致多种化疗药物对胶质瘤的临床疗效不明显[2]。DNA依赖蛋白激酶催化亚基(DNA-PKcs)是DNA依赖的蛋白激酶(DNA-dependent kinase,DNA-PK)的催化亚单位,与另外2个亚单位Ku70和Ku80 共同组成DNA-PK复合体,在DNA损伤的非同源末端连接修复中发挥关键作用[3]。DNA-PKcs在脑部肿瘤[4]、肺癌[5]和卵巢癌[6]等多种肿瘤细胞中呈现高表达,并且DNA-PKcs在脑部肿瘤的高表达与其侵袭能力和恶性程度呈正相关关系,这种高表达的生物学意义和机制值得深入研究。本研究采用siRNA技术建立DNA-PKcs表达敲除的MDR脑胶质瘤细胞株,拟探讨DNA-PKcs对脑胶质瘤化疗敏感性的影响及其分子机制。
1 材料与方法 1.1 细胞株和试剂胶质瘤细胞株U251及对多柔比星(ariamycin,ADM)耐药的U251细胞株购自美国国家癌症研究中心,由本室保存。胎牛血清和改良型RPMI-1640培养基购自美国Gibco公司;胰蛋白酶、青霉素和链霉素购自美国Sigma公司;ADM、紫杉醇(paclitaxel,PTX)和吉西他滨 (gemcitabine,GEM)购自上海威奥生物科技公司;CCK-8(cell counting kit-8)试剂盒购自北京索莱宝生物科技公司;siRNA引物和pLKO.1-Puro质粒购自北京旷博生物技术有限公司;DNA-PKcs、MDR1 和pNF-κB/p65抗体购自上海铭睿生物科技有限公司;总Akt、pAkt/T308和pAKT/S473抗体购自南京凯基生物科技公司。
1.2 细胞培养及分组胶质瘤U251细胞培养于25 cm2细胞培养瓶中,每瓶加5 mL10%热灭活的胎牛血清、1% L-谷氨酰胺、25 mg·L-1青霉素和50 U·mL-1链霉素的RPMI-1640培养基,在37℃、5% CO2和100%饱和湿度的CO2培养箱中培养。当细胞融合达到80%以上,胰蛋白酶消化传代。分别培养3种细胞:胶质瘤细胞株U251(U251细胞)、ADM耐药细胞株(U251/ADM细胞)和DNA-PKcs基因表达沉默的ADM耐药的U251细胞(U251/ADM/SIDNA-PKcs细胞)。
1.3 siRNA靶序列设计及细胞筛选根据PubMed的GenBank数据库中DNA-PKcs基因的序列以及siRNA的设计原则,应用网站(http://www.genscript.com/)在线设计抑制DNA-PKcs基因表达的靶向siRNA序列(siDNA-PKcs)。正义链为 5′-GATCCCGGGCGCTAATCGTACTGAATTCAAGAGATTCAGTACGA-TTAGCGCCCTTTTTTGGAAA-3′,反义链为 3′-GGCCCGCGATTAGCATGACTTAAGTTCTCT-AAGTCATGCTAATCGCGGGAAAAAACCTT-TTCGA-5′,化学合成siDNA-PKcs克隆入pLKO.1 -Puro质粒中,交由上海生工公司鉴定。预先培养于75 cm2细胞培养瓶中,待80%细胞融合时,经Lipofectamine 2000介导siDNA-PKcs质粒转染U251细胞。转染48 h后使用潮霉素筛选阳性克隆,阳性克隆即DNA-PKcs基因表达沉默的ADM耐药的U251细胞,并扩大培养。
1.4 CCK8法测定药物敏感性收集对数生长期3组细胞,每孔200 μL分别接种于96孔细胞培养板中,每孔接种5×103个细胞,孵育24 h。孵育后,各组细胞分别加入不同浓度梯度的ADM(0.2、1.0、5.0、25.0、125.0和625.0 mg·L-1)、PTX(0.03、0.15、0.75、3.75、18.75和93.75 mg·L-1)、GEM(0.02、0.1、0.5、2.5、12.5和62.5 mg·-1),每组设置3个重复孔,继续培养48 h。培养结束后每孔加入CCK8试剂10 μL,继续培养3 h,在酶标仪上测定450 nm波长处吸光度(A)值,抑制率=[(对照组A值-实验组A值)/对照组A值]×100%。以抑制率为纵坐标,药物浓度为横坐标绘制抑制率-药物浓度曲线,根据回归方程计算半数抑制浓度(half-maximal inhibitory concentration,IC50)值。
1.5 Westernblotting法检测蛋白表达水平 收集对数生长期3组细胞,磷酸盐缓冲液清洗2次,裂解液裂解细胞,12 000 r·min-1、4℃离心10 min得到上清液。处理后的上清液经考马斯亮蓝法定量,每次取15~20 μg蛋白上样,使用SDS-聚丙烯酰胺电泳分离得到蛋白条带,转移至硝酸纤维膜上。在室温条件下脱脂奶粉中封闭1~2 h,室温下与耦联辣根过氧化物酶的DNA-PKcs、MDR1、pNF-κB/p6、总Akt、pAkt/T308、pAKT/S473抗体孵育1 h。随后完成结合信号显影,凝胶成像系统分析实验结果。
1.6 统计学分析采用SPSS 15.0软件进行统计学处理。 各组细胞ADM、PTX和GEM的IC50值以x±s表示,多组间样本均数比较采用单因素方差分析。以P<0.05表示差异有统计学意义。
2 结 果 2.1 Western blotting法检测胶质瘤U251细胞中DNA-PKcs的表达U251/ADM细胞中DNA-PKcs表达水平明显高于U251细胞(P<0.01);经siDNA-PKcs处理后,U251/ADM/siDNA-PKcs细胞DNA-PKcs表达水平明显低于U251/ADM细胞(P<0.01)。见图 1。
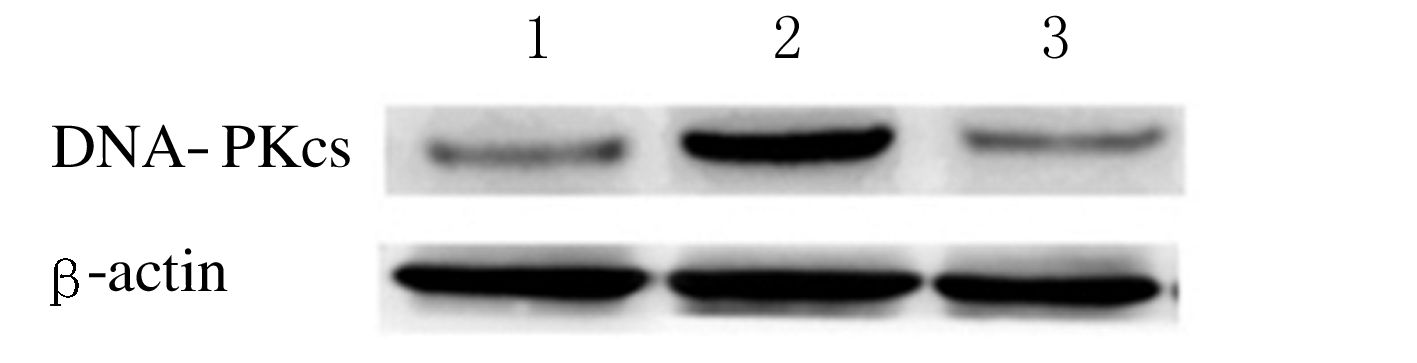
|
| 图 1 不同胶质瘤U251细胞中DNA-PKcs表达电泳图 Figure 1 Expressions of DNA-PKcs in different glioma U251 cells |
|
|
U251/ADM细胞ADM、PTX和GEM的IC50值明显高于U251细胞(P<0.05);经siDNA-PKcs降低DNA-PKcs表达后,U251/ADM/siDNA-PKcs细胞ADM、PTX和GEM的IC50值明显低于U251/ADM细胞(P<0.05)。见表 1。提示DNA-PKcs的表达沉默能逆转ADM耐药的U251细胞株的耐药性。
| (n=3,x±s,η) | |||
| Group | IC50 | ||
| ADM | PTX | GEM | |
| U251 cells | 9.25±1.28* | 2.31±0.13* | 0.28±0.04* |
| U251/ADM cells | 137.71±11.34 | 24.73±1.25 | 11.35±0.72 |
| U251/ADM/siDNA-PKcs cells | 26.84±2.36* | 6.93±0.52* | 2.16±0.12* |
| *P<0.05 compared with U251/ADM cells group. | |||
blotting法检测胶质瘤U251细胞中MDR1的表达 U251/ADM细胞中MDR1表达水平明显高于U251细胞(P<0.01);经siDNA-PKcs处理后,U251/ADM/siDNA-PKcs细胞中MDR1表达水平明显低于U251/ADM细胞(P<0.01)。见图 2。提示MDR1是DNA-PKcs的下游作用位点。
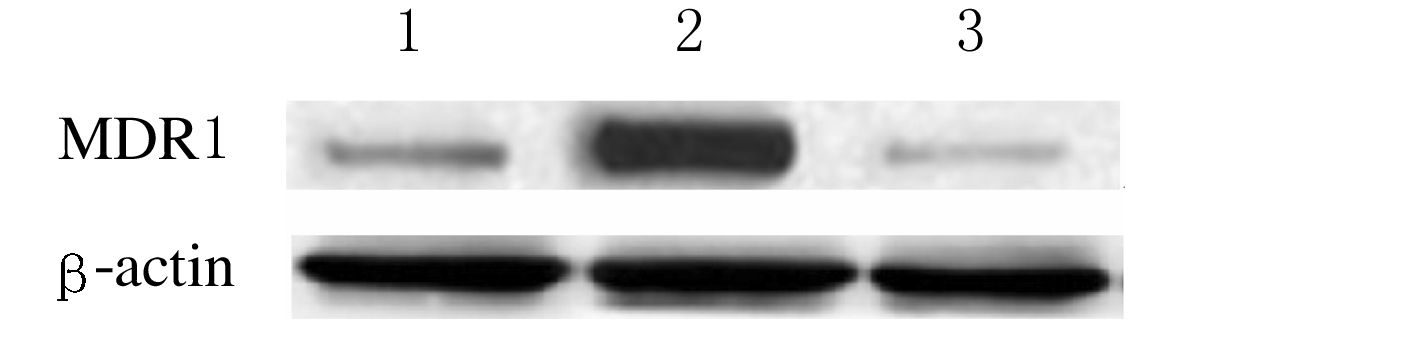
|
| 图 2 不同胶质瘤U251细胞中MDR1表达电泳图 Figure 2 Electrophoregram of MDR1 expressions in different glioma U251 cells |
|
|
U251/ADM细胞中pAkt/S473、pNF-κB/p65和MDR1均明显高于U251细胞(P<0.01);经siDNA-PKcs降低后DNA-PKcs表达后,U251/ADM/siDNA-PKcs细胞pAKT/S473、pNF-κB/p65和MDR1表达水平均明显低于U251/ADM细胞(P<0.01);而3组细胞中总Akt和pAkt/T308蛋白表达水平比较差异无统计学意义(P>0.05)。见图 3。
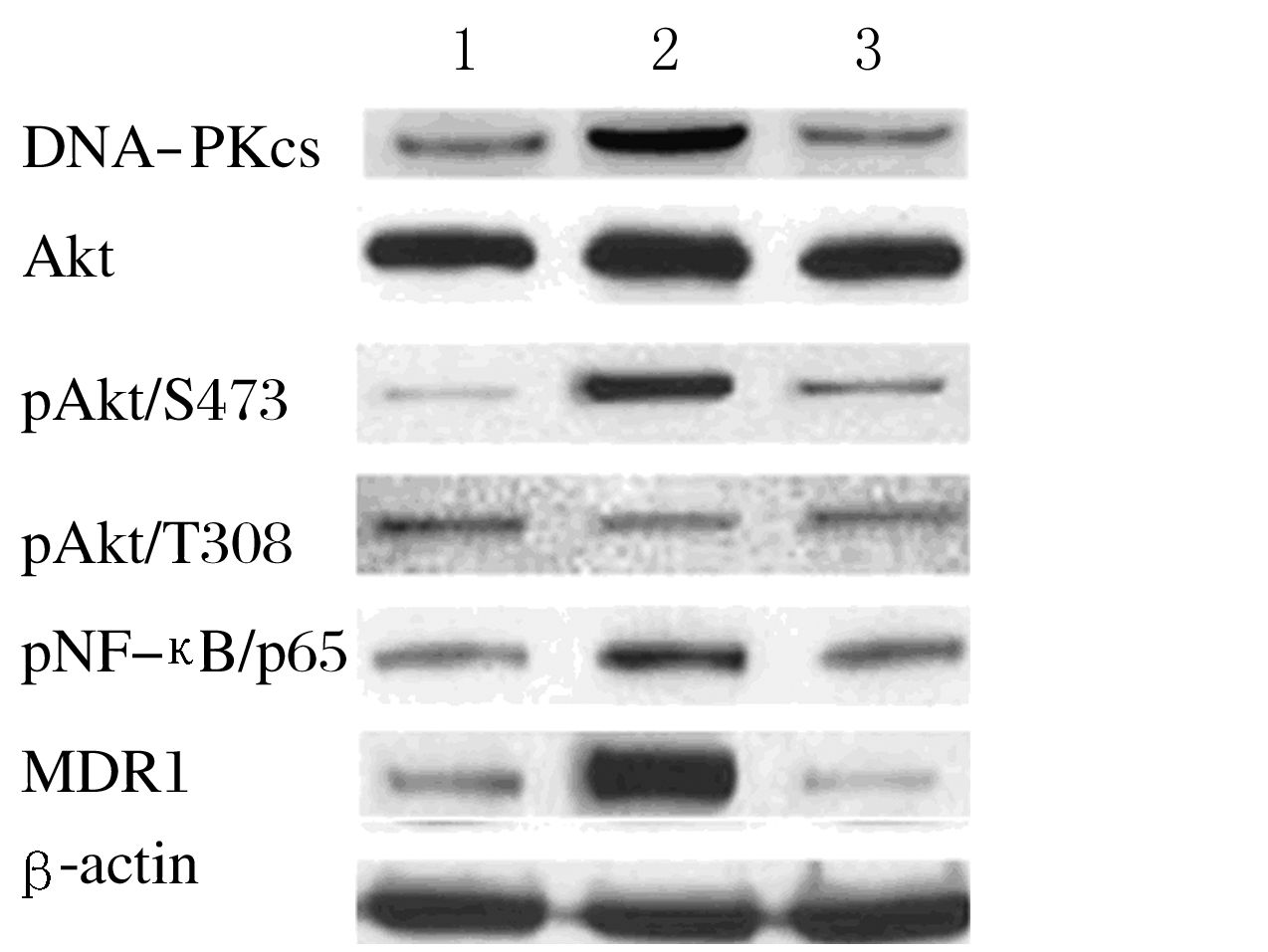
|
| 图 3 不同胶质瘤U251细胞中Akt-NF-κB信号通路中蛋白表达电泳图 Figure 3 Electrophoregram of protein expressions in Akt-NF-κB signaling pathway in different glioma U251 cells |
|
|
化疗是恶性胶质瘤重要的辅助治疗手段,然而恶性胶质瘤频繁出现的MDR降低了化疗的疗效,已成为其化疗的主要挑战。DNA损伤修复能力的增强是胶质瘤化疗耐受增加的原因之一,DNA双链断裂是大部分化疗药物的作用位点,DNA-PKcs是DNA非同源末端连接修复的重要调节者,其表达上调明显降低化疗中肿瘤细胞凋亡水平[7]。Tavecchio等[8]研究发现:人慢性淋巴细胞性白血病细胞中抑制DNA-PK表达则能降低其药物耐受,并且以DNA-PK为靶点能增强白血病患者化疗效果,改善患者预后。在获得性的PTX耐药的人胶质瘤U373细胞株中,DNA-PKcs的表达水平提高了3倍,而DNA-PKcs抑制剂NU7026逆转该化疗抗性[9]。上述研究提示DNA-PKcs与肿瘤MDR有密切关联,本研究拟探讨DNA-PKcs与脑胶质瘤化疗敏感性的相关关系及其分子机制。
多种MDR肿瘤细胞中均表现出DNA损伤修复能力提高,并呈现DNA-PKcs表达明显上调,两者呈正相关关系 [10]。本研究结果显示:U251/ADM细胞中DNA-PKcs表达水平明显高于正常U251细胞,这在恶性胶质瘤组织中也有发现,Yoon等[11]采用免疫组织化学法研究发现复发胶质瘤中DNA-PKcs阳性表达率高达73.68%。并且本研究中DNA-PKcs的基因沉默能明显降低ADM、PTX和GEM对ADM耐药的U251细胞株的IC50值,这提示DNA-PKcs能逆转U251/ADM细胞的耐药性。
临床研究[12]表明:复发胶质瘤中MDR关联蛋白的过表达是化疗失败的主要原因,而且培养的胶质瘤细胞和人高分化的胶质瘤细胞均有该类蛋白表达。MDR1定位于人7号染色质q21.1,其蛋白相对分子质量为1.70×105,能够结合并转运药物,在肿瘤化疗时表达增加,被认为是多药耐药形成主要原因[13]。本研究结果显示:MDR1在ADM耐药的U251细胞中呈高表达,并与DNA-PKcs表达上调有关。虽然MDR1是肿瘤治疗优秀的靶点,但临床上至今尚未开发出以MDR1为靶点的成功治疗手段,DNA-PKcs作为MDR1可能的上游作用位点,有潜力成为胶质瘤化疗增敏的重要靶点。
近年来研究表明:Akt-NF-κB信号通路与肿瘤MDR现象密切相关。丝氨酸/苏氨酸蛋白激酶(serine/threonine protein kinase,Akt)是多个信号通路的枢纽蛋白,Akt可以通过其第307位苏氨酸位点(T307) 或第473位的丝氨酸位点(Ser473) 的磷酸化进入活化状态;核因子κB(nuclear factor κB,NF-κB)是人体内重要的核转录调控因子,正常条件下NF-κB与其抑制分子结合存在于细胞质中,活化的Akt可通过磷酸化激活NF-κB而移位进入细胞核中,发挥核转录调控因子作用 [14]。已有研究[15-16]在肝癌细胞中发现:NF-κB能与MDR1基因启动子区域结合,激发MDR1蛋白的过量表达。本研究结果显示:ADM耐药的U251细胞中pAKT/S473、pNF-κB/p65上调,而DNA-PKcs的基因沉默能逆转该变化。上述结果提示DNA-PKcs的下游作用位点为Akt的Ser473,pAKT/S473能进一步磷酸化激活NF-κB,最终导致MDR1蛋白的过表达和胶质瘤U251细胞MDR。
综上所述,DNA-PKcs在U251/ADM细胞中呈高表达,下调DNA-PKcs表达能增强ADM耐药的U251细胞的化疗敏感性,其作用机制与激活Akt-NF-κB信号通路,诱导MDR1蛋白表达有关。DNA-Pkcs有潜力开发为胶质瘤化疗增敏的新靶点。
| [1] | Wheeler LA, Manzanera AG, Bell SD, et al. Phase 2 multicenter study of gene-mediated cytotoxic immunotherapy as adjuvant to surgical resection for newly diagnosed malignant glioma[J]. Neuro-Oncology , 2016, 18 (8) : 1137–1145. DOI:10.1093/neuonc/now002 |
| [2] | Alexiou GA, Goussia A, Kyritsis AP, et al. Influence of glioma's multidrug resistance phenotype on 99mTc-tetrofosmin uptake[J]. Mol Imaging Biol , 2011, 13 (2) : 348–351. DOI:10.1007/s11307-010-0369-y |
| [3] | 蔡蓉, 张丽珍. DNA依赖蛋白激酶的研究新进展[J]. 医学综述 , 2013, 19 (7) : 1182–1185. |
| [4] | Liu S, Opiyo SO, Manthey K, et al. Distinct roles for DNA-PK, ATM and ATR in RPA phosphorylation and checkpoint activation in response to replication stress[J]. Nucleic Acids Res , 2012, 40 (21) : 10780–10794. DOI:10.1093/nar/gks849 |
| [5] | Malewicz M, Kadkhodaei B, Kee N, et al. Essential role for DNA-PK-mediated phosphorylation of NR4A nuclear orphan receptors in DNA double-strand break repair[J]. Genes Dev , 2011, 25 (19) : 2031–2040. DOI:10.1101/gad.16872411 |
| [6] | 廖琪, 崔满华. 干扰DNA-PK和CHK1表达对卵巢癌细胞辐射凋亡影响的研究[J]. 中国实验诊断学 , 2013, 17 (9) : 1569–1570. |
| [7] | Kemp MG, Sancar A. ATR kinase inhibition protects non-cycling cells from the lethal effects of DNA damage and transcription stress[J]. J Biol Chem , 2016, 291 (17) : 9330–9342. DOI:10.1074/jbc.M116.719740 |
| [8] | Tavecchio M, Munck JM, Cano C, et al. Further characterisation of the cellular activity of the DNA-PK inhibitor, NU7441, reveals potential cross-talk with homologous recombination[J]. Cancer Chemother Pharmacol , 2012, 69 (1) : 155–164. DOI:10.1007/s00280-011-1662-4 |
| [9] | Zhuang W, Li B, Long L, et al. Knockdown of the DNA-dependent protein kinase catalytic subunit radiosensitizes glioma-initiating cells by inducing autophagy[J]. Brain Res , 2011, 1371 : 7–15. DOI:10.1016/j.brainres.2010.11.044 |
| [10] | Stronach EA, Chen M, Maginn EN, et al. DNA-PK mediates AKT activation and apoptosis inhibition in clinically acquired platinum resistance[J]. Neoplasia , 2011, 13 (11) : 1069–1080. DOI:10.1593/neo.111032 |
| [11] | Yoon JH, Ahn SG, Lee BH, et al. Role of autophagy in chemoresistance:Regulation of the ATM-mediated DNA-damage signaling pathway through activation of DNA-PKcs and PARP-1[J]. Biochem Pharmacol , 2012, 83 (6) : 747–757. DOI:10.1016/j.bcp.2011.12.029 |
| [12] | Munoz JL, Rodriguez-Cruz V, Greco SJ, et al. Temozolomide induces the production of epidermal growth factor to regulate MDR1 expression in glioblastoma cells[J]. Mol Cancer Ther , 2014, 13 (10) : 2399–2411. DOI:10.1158/1535-7163.MCT-14-0011 |
| [13] | Sakata S, Fujiwara M, Ohtsuka K, et al. ATP-binding cassette transporters in primary central nervous system lymphoma:decreased expression of MDR1 P-glycoprotein and breast cancer resistance protein in tumor capillary endothelial cells[J]. Oncol Rep , 2011, 25 (2) : 333–339. |
| [14] | 隋华, 付晓伶, 潘树芳, 等. PI3K/Akt/NF-κB通路调控ABCB1/P-gp介导的人结肠癌细胞多药耐药的研究[J]. 中国癌症杂志 , 2014, 24 (2) : 106–111. |
| [15] | Song L, Xiong H, Li J, et al. Sphingosine kinase-1 enhances resistance to apoptosis through activation of PI3K/Akt/NF-κB pathway in human non-small cell lung cancer[J]. Clin Cancer Res , 2011, 17 (7) : 1839–1849. DOI:10.1158/1078-0432.CCR-10-0720 |
| [16] | 李修明. 基于DC-CIK细胞免疫治疗联合化疗治疗晚期消化道肿瘤的临床疗效分析[J]. 中国实用内科杂志 , 2015, 35 (增1) : 119–121. |
 2016, Vol. 42
2016, Vol. 42


