扩展功能
文章信息
- 姜恩平, 唐泽立, 于春艳, 于春荣, 朱伟
- JIANG Enping, TANG Zeli, YU Chunyan, YU Chunrong, ZHU Wei
- 五味子乙素对大鼠脑缺血再灌注损伤的保护作用及其机制
- Protective effect of schisandrin B on cerebral ischemia reperfusion injury of rats and its mechanisms
- 吉林大学学报(医学版), 2016, 42(05): 860-865
- Journal of Jilin University (Medicine Edition), 2016, 42(05): 860-865
- 10.13481/j.1671-587x.20160504
-
文章历史
- 收稿日期: 2016-01-26
2. 北华大学基础医学院病理学教研室, 吉林 吉林 132013;
3. 国家食品药品监督管理总局药品审评中心, 北京 100038
2. Department of Pathology, School of Basic Medical Sciences, Beihua University, Jilin 132013, China;
3. Center for Drug Evaluation, China Food and Drug Administration, Beijing 100038, China
缺血性脑血管疾病是临床上的常见病和多发病。目前对于缺血性脑血管疾病的治疗主要采用溶栓疗法,恢复缺血区域血流再灌注。由于在脑缺血再灌注时会释放大量的炎性介质,可增加毛细血管通透性,加重神经细胞的损伤[1-2]。热休克蛋白A12B(heat shock protein A12B,HSPA12B)是新发现的热休克蛋白,是 HSP家族的一个新成员,由Han等[3]于 2003 年首次在人动脉粥样硬化斑块中克隆到。研究[4]发现:HSPA12B可作为一种炎症反应蛋白参与中枢神经系统的炎症反应。HSPA12B能够保护脑缺血损伤,该作用机制可能与激活磷脂酰肌醇3激酶(phosphatidylinositol 3-kinase,PI3K) /丝氨酸-苏氨酸蛋白激酶(serine-threonine kinase,Akt)有关。研究[5]表明:脑缺血时高表达的HSPA12B能够通过调节PI3K/Akt信号通路减少脑梗塞面积,保护脑缺血性损伤。PI3K/Akt信号通路参与调节炎症反应的神经保护作用。活化的Akt通过一系列酶促反应调节核因子kappaB(NF-κB)的磷酸化,影响炎症反应及其下游炎症基因的表达,故以HSPA12B/PI3K/Akt为靶标不失为一种抗脑缺血损伤的有效治疗思路。五味子乙素(schisandrin B,SchB)是中药五味子[Schisandra Chinensis (Turcz.) Baill]的主要活性成分之一。SchB具有抗炎、抗衰老、抗氧化应激及抗心肌缺血等生物活性[6-9]。关于SchB对脑缺血再灌注损伤时炎症反应的抑制作用及对HSPA12B/PI3K/Akt信号通路的调节作用目前尚不明确。本研究通过观察SchB对大鼠脑缺血再灌注损伤炎症反应的作用及对HSPA12B/PI3K/Akt信号通路的影响,探讨SchB调控HSPA12B/PI3K/Akt信号通路抗脑缺血再灌注损伤的机制。
1 材料与方法 1.1 实验动物、药品、主要试剂和仪器健康雄性SD大鼠130只,体质量(200±50) g,购自广东医科大学实验动物中心,动物合格证号:SCXK 2013-0008。SchB(上海源叶生物科技有限公司)。大脑中动脉栓塞 (middle cerebral artery occlusion,MCAO)栓线(北京沙东生物技术有限公司),甲苯胺蓝(美国Sigma公司),肿瘤坏死因子α(TNF-α)、白细胞介素1(IL-1)、白细胞介素6(IL-6)和NF-κBELISA试剂盒(南京建成生物技术有限公司),二喹啉甲酸(BCA)蛋白浓度测定试剂盒(碧云天生物试剂公司), HSPA12B、Akt、p-Akt和β-actin抗体(美国Santa Cruz公司)。TS100倒置显微镜(日本Nikon公司),GIS-2008天能凝胶成像分析仪(上海天能科技有限公司),BIO-RAD 680酶标仪(美国Bio-rad公司)。
1.2 动物分组及脑缺血再灌注损伤模型制备将130只雄性SD大鼠,随机分为假手术组、模型组、SchB1组、SchB2组和SchB3组,每组26只(其中测定脑含水量每组10只,ELISA法检测和Western blotting法检测每组10只,脑组织甲苯胺蓝染色每组6只)。将SchB溶解在5%的Tween20中,SchB1组、SchB2组和SchB3组大鼠分别每天腹腔注射3、10和30 mg·kg-1 SchB,假手术组和模型组每天腹腔注射与各给药组同体积的Tween 20,连续7 d。末次给药2 h后腹腔注射10%水合氯醛进行麻醉,建立脑缺血再灌注损伤动物模型。将麻醉好的大鼠固定于鼠台上,剪毛切开颈部皮肤,分离右侧颈总动脉、颈外动脉和颈内动脉。在颈总动脉和颈外动脉备好手术线,并用动脉夹夹住颈总动脉近心端,远心端处穿手术线并打活结,用眼科剪将颈总动脉剪口,将顶端钝圆的MCAO栓线插入颈内动脉18 mm(从颈外和颈内动脉分叉处算起,栓线事先用记号笔做好标记),遇到阻力停止,用手术线固定栓线,缝合皮肤。假手术组不插入栓线,只分离出颈外动脉以及颈内动脉。术后2 h选择出现竖毛、左侧肢体出现偏瘫的大鼠进行再灌注。术后24h立即断头取脑,进行神经功能缺损评分、脑组织含水量、病理组织学、ELISA法和Western blotting法检测。
1.3 大鼠神经功能缺损评分大鼠脑缺血再灌注22 h后进行神经功能指标评分。评分标准:神经功能正常者为0分;提尾时左前肢屈曲者为1分;向瘫痪侧转圈者为2分;向左侧倾斜者为3分;肢体无自由活动,意识丧失者为4分;死亡者为5分。得分越高,说明大鼠行为障碍越严重。
1.4 大鼠脑组织含水量的测定采用干湿法测定大鼠脑组织含水量,大鼠断头取脑后称量湿质量,然后将脑组织在100℃烤箱烘干24 h称量干质量。脑组织含水量按以下公式计算:含水量=(湿质量-干质量)/湿质量×100%。
1.5 甲苯胺蓝染色观察大鼠脑组织形态表现取大鼠右侧脑组织(即梗死侧)进行常规多聚甲醛固定,石蜡包埋,切片。用二甲苯脱蜡,乙醇水化后,放入甲苯胺蓝染液中30 min,自来水清洗,放入配好的冰醋酸中,镜下观察细胞核清晰后,用水清洗,吹干后二甲苯透明,封片,镜下观察海马部位神经元的形态表现。
1.6 ELISA法检测大鼠脑组织匀浆中NF-κB、TNF-α、IL-1和IL-6水平实验结束后快速取脑,取大鼠右侧脑组织(即梗死侧)称质量,记录后剪碎,加入预冷的PBS(临用前加入蛋白酶抑制剂)匀浆,匀浆时置于冰浴中,4℃、10 000 r·min-1离心10 min,取上清,按照ELISA试剂盒说明书检测NF-κB、TNF-α、IL-1和IL-6水平。
1.7 Westernblotting法检测脑组织中HSPA12B、Akt和p-Akt表达水平 取大鼠右侧脑组织(即梗死侧),制成匀浆,裂解、离心取上清(同ELISA步骤),将提取的蛋白用BCA蛋白浓度测定试剂盒进行蛋白定量检测。分别配制积层胶和分离胶,铺胶,每孔上样30 μg总蛋白,进行SDS-PAGE垂直板电泳,然后电转至PVDF膜上,转膜完毕后,用PBST洗膜,5%的脱脂奶粉封闭2 h;将PVDF膜根据Marker剪开,放入稀释好的HSPA12B、Akt和p-Akt抗体(1∶1 000稀释)中4℃下孵育过夜,用PBST洗膜2次,每次10 min,放入辣根过氧化物酶标记的二抗中,室温孵育2 h,ECL发光显色,拍照分析。蛋白表达水平=每个样本条带的A值/β-actin的A值。
1.8 统计学分析采用 SPSS 13.0 统计软件进行统计学分析。各组大鼠的神经功能缺损评分、脑水肿情况、TNF-α水平、IL-1水平、IL-6水平、NF-κB水平、HSPA12B、Akt和p-Akt蛋白表达水平等相关指标以x±s表示,多组间样本均数比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结 果 2.1 各组大鼠的神经功能缺损评分和脑含水量与假手术组比较,模型组大鼠出现神经功能障碍表现,神经功能缺损评分明显升高(P<0.01),表明大鼠缺血再灌注损伤模型造模成功;与模型组比较,SchB1、SchB2和SchB3组大鼠神经功能缺损评分明显降低(P<0.01)。与假手术组比较,模型组大鼠脑组织含水量明显升高(P<0.01);与模型组比较,SchB1、SchB2和SchB3组大鼠脑组织含水量明显降低(P<0.05或 P<0.01)。见表 1。
| (n=10,x±s,η) | |||
| Group | Dose (mg·kg-1) | Neurologic deficit score | Content of water in brain tissue(η/%) |
| Sham | 0 | 0 | 76.54±2.29 |
| Model | 0 | 3.41±0.32* | 80.21±2.19* |
| SchB1 | 3 | 2.96±0.27△△ | 79.42±3.29 |
| SchB2 | 10 | 2.58±0.23△△ | 78.56±1.14△ |
| SchB3 | 30 | 2.43±0.19△△ | 78.01±2.58△ |
| *P<0.01 compared with sham group;△P<0.05,△△P<0.01 compared with model group. | |||
与假手术组比较,模型组大鼠的神经细胞膜不完整,核仁不清晰,部分神经细胞胞体为三角形,细胞间隙增大,组织结构疏松,间质出现水肿、空泡;与模型组比较,SchB1、SchB2和SchB3组大鼠神经细胞水肿有一定减轻,核仁较清晰,间质空泡减少。见图 1(插页一)。
2.3 各组大鼠脑组织中NF-κB、TNF-α、IL-1和IL-6水平与假手术组比较,模型组大鼠脑组织匀浆中NF-κB、TNF-α、IL-1和IL-6水平明显升高(P<0.01);与模型组比较,SchB1、SchB2和SchB3组大鼠脑组织匀浆中TNF-α、IL-1和IL-6的水平明显降低(P<0.05或P<0.01),SchB2和SchB3组大鼠脑组织匀浆中NF-κB水平明显降低(P<0.01),SchB1组的NF-κB水平无明显变化(P>0.05)。见表 2。
| (n=10,x±s,η) | |||||
| Group | Dose (mg·kg-1) | NF-κB [ρB/(ng·L-1)] | TNF-α [ρB/(μg·L-1)] | IL-1 [ρB/(ng·L-1)] | IL-6 [ρB/(ng·L-1)] |
| Sham | 0 | 1.35±0.15 | 1.25±0.13 | 2.41±0.23 | 1.84±0.15 |
| Model | 0 | 1.96±0.21* | 2.66±0.21* | 3.64±0.31* | 2.53±0.27* |
| SchB1 | 3 | 1.93±0.18 | 2.43±0.24△ | 3.23±0.34△ | 2.37±0.26△ |
| SchB2 | 10 | 1.85±0.19△△ | 2.17±0.19△△ | 3.08±0.29△△ | 2.19±0.23△△ |
| SchB3 | 30 | 1.79±0.18△△ | 1.97±0.16△△ | 2.87±0.26△△ | 2.15±0.18△△ |
| *P<0.01 compared with sham group;△P<0.05,△△P<0.01 compared with model group. | |||||
与假手术组比较,模型组大鼠脑组织中HSPA12B蛋白表达水平明显降低(P<0.01);与模型组比较,SchB2和SchB3组大鼠脑组织中HSPA12B蛋白表达水平明显升高(P<0.05或P<0.01)。与假手术组比较,模型组大鼠脑组织中p-Akt蛋白表达水平明显降低(P<0.01);与模型组比较,SchB1、SchB2和SchB3组大鼠脑组织中p-Akt蛋白表达水平明显升高(P<0.01);除SchB1组Akt蛋白表达水平升高之外(P<0.05),其他假手术组、模型组、SchB2和SchB3组各组间Akt蛋白表达水平无明显变化(P>0.05)。见图 2和表 3。
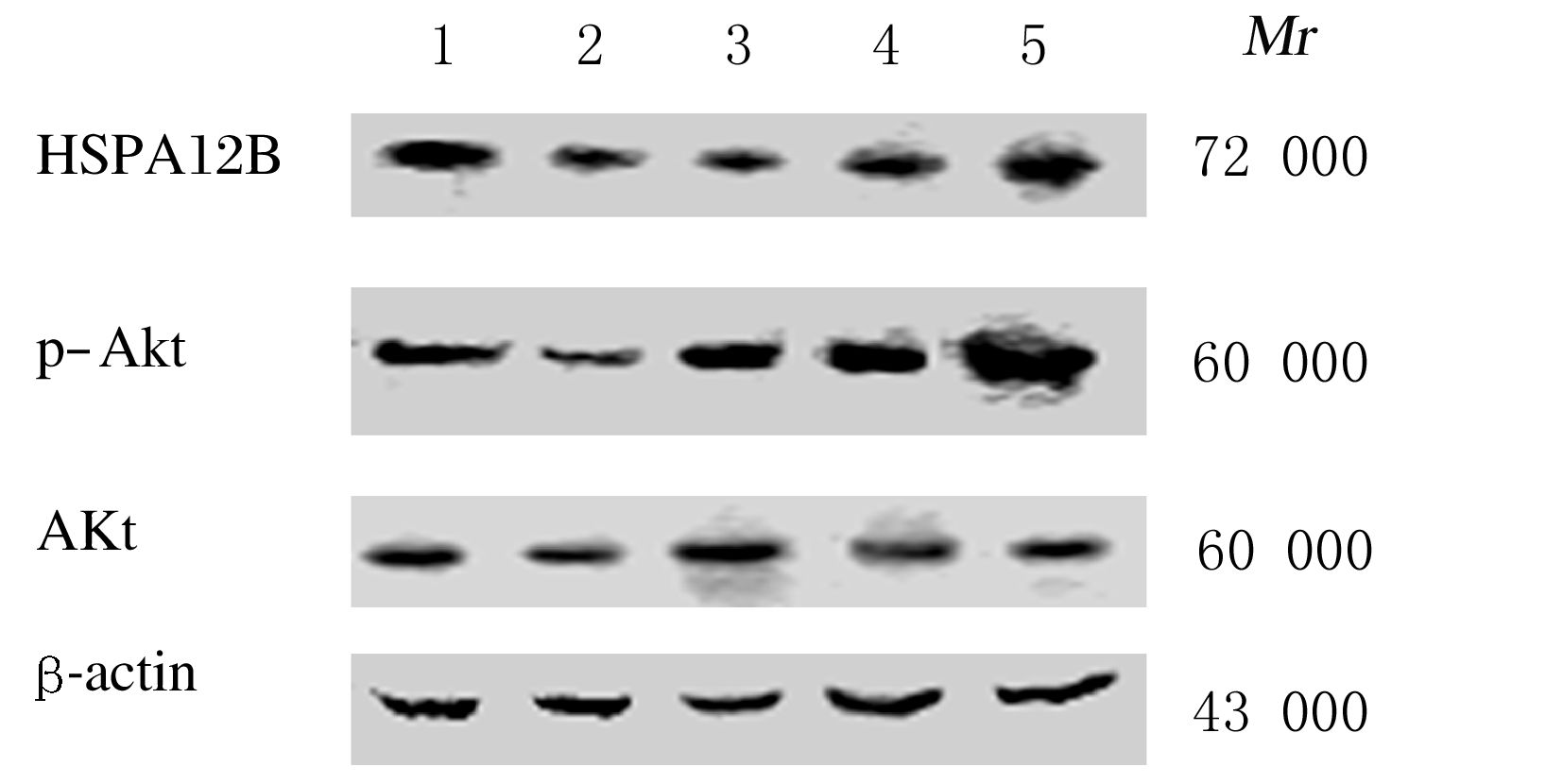
|
| 图 2 各组大鼠脑组织中HSPA12B、p-Akt和Akt蛋白表达电泳图 Figure 2 Electrophoregram expressions of HSPA12B,p-Akt and Akt protein in brain tissue of rats in various groups |
|
|
| (n=10,x±s,η) | ||||
| Group | Dose (mg·kg-1) | HSPA12B/β-actin | p-Akt /β-actin | Akt /β-actin |
| Sham | 0 | 1.00±0.00 | 1.00±0.00 | 1.00±0.00 |
| Model | 0 | 0.72±0.06* | 0.67±0.05* | 0.96±0.06 |
| SchB1 | 3 | 0.74±0.06 | 1.18±0.09△△ | 1.12±0.08△ |
| SchB2 | 10 | 0.87±0.07△ | 1.25±0.12△△ | 0.98±0.05 |
| SchB3 | 30 | 1.16±0.09△△ | 1.99±0.13△△ | 0.96±0.08 |
| *P<0.01 compared with sham group;△P<0.05,△△P<0.01 compared with model group. | ||||
SchB能保护神经细胞的缺氧性损伤并具有一定的抗炎作用[10-12],但有关SchB对脑缺血再灌注损伤继发的炎症反应的抑制作用和机制尚不明确。本实验中SchB对大鼠脑缺血再灌注损伤影响的结果显示:不同浓度的SchB预保护给药后均能明显降低大鼠神经功能缺损评分,减轻缺血引起的神经功能障碍,药物对神经系统的保护作用具有明显的剂量依赖关系;显微镜下观察,各剂量SchB组大鼠脑组织病理形态学均有改善,神经细胞水肿减轻,间质空泡减少;高、中剂量SchB组大鼠脑组织的含水量减少。以上结果提示:SchB能够剂量依赖性地保护脑缺血再灌注损伤。
脑缺血再灌注后继发的炎症反应能够进一步加重神经细胞损伤。NF-κB是很多信号通路(如PI3K/Akt)中的下游分子并参与脑缺血损伤过程中的炎症反应[13]。脑缺血时活化的NF-κB能结合到参与炎症反应的大量基因的启动子上,如VEGF、IL-1、IL-8、IL-6和TNF-α等,这些炎症因子被激活后将进一步加重神经细胞的变性和坏死,增加血脑屏障的通透性,加重脑水肿。本研究结果显示:模型组脑缺血再灌注损伤时,NF-κB、TNF-α、IL-1和IL-6水平升高,而经过不同剂量SchB预处理后NF-κB、TNF-α、IL-1和IL-6水平均降低,表明SchB能够抑制脑缺血再灌注后继发的炎症反应,保护神经细胞。
以上结果显示:SchB能够保护大鼠的脑缺血再灌注损伤,并能抑制缺血再灌注后继发的炎症反应(如抑制NF-κB等的产生),因此本文作者推测SchB有可能是通过影响NF-κB的上游信号通路进而产生下游的这一系列效应。HSPA12B作为一种新发现的炎症反应蛋白参与中枢神经系统炎症反应[14],参与小胶质细胞和星形胶质细胞的活化,后者合成和分泌一系列细胞因子,包括TNF-α和NO等参与炎症反应。研究[15]发现:HSPA12B在体内和体外实验中均可通过PI3K/Akt信号通路抗脑缺血再灌注损伤,减小脑梗塞面积,抑制神经细胞的凋亡,PI3K/Akt是其发挥保护神经细胞作用的下游靶点,而Akt激活后能够通过一系列酶促反应下调NF-κB并抑制炎症因子的释放减轻炎症损伤 [16]。因此,在本研究中SchB对HSPA12B/PI3K/Akt信号通路影响的结果显示:中、高剂量SchB组大鼠脑组织中HSPA12B蛋白水平升高,不同浓度的SchB均能促进p-Akt蛋白表达。这就验证了之前的推测,即SchB可能通过HSPA12B/PI3K/Akt信号通路抑制NF-κB的活化,进而抑制炎症因子的产生,保护神经细胞损伤。
综上所述,SchB可能通过调控HSPA12B/PI3K/Akt信号通路,减轻脑缺血再灌注时炎症反应对神经细胞的损伤,故将临床治疗靶标定为HSPA12B/PI3K/Akt信号通路进而调控脑缺血再灌注损伤将会是一种非常有效的治疗策略。
| [1] | Cao XL, Du J, Zhang Y, et al. Hyperlipidemia exacerbates cerebral injury through oxidative stress, inflammation and neuronal apoptosis in MCAO/reperfusion rats[J]. Exp Brain Res , 2015, 233 (10) : 2753–2765. DOI:10.1007/s00221-015-4269-x |
| [2] | Shambayati M, Patel M, Ma Y, et al. Central inflammatory response to experimental stroke is inhibited by a neuroprotective dose of dietary soy[J]. Brain Res , 2014, 1593 : 76–82. DOI:10.1016/j.brainres.2014.09.042 |
| [3] | Han Z, Truong QA, Park S, et al. Two Hsp70 family members expressed in atherosclerotic lesions[J]. Proc Natl Acad Sci USA , 2003, 100 (3) : 1256–1261. DOI:10.1073/pnas.252764399 |
| [4] | Cui Z, Wang P, Sun L, et al. Lipopolysaccharide-evoked HSPA12B expression by activation of MAPK cascade in microglial cells of the spinal cord[J]. J Neurol Sci , 2010, 294 (1/2) : 29–37. |
| [5] | Ma Y, Lu C, Li C, et al. Overexpression of HSPA12B protects against cerebral ischemia/reperfusion injury via a PI3K/Akt-dependent mechanism[J]. Biochim Biophys Acta , 2013, 1832 (1) : 57–66. DOI:10.1016/j.bbadis.2012.10.003 |
| [6] | Panossian A, Wikman G. Pharmacology of Schisandra chinensis Bail:An overview of Russian research and uses in medicine[J]. J Ethnopharmacol , 2008, 118 (2) : 183–212. DOI:10.1016/j.jep.2008.04.020 |
| [7] | 姜恩平, 李贺, 于春艳, 等. 五味子乙素通过p38MAPK信号通路对结肠癌SW480细胞凋亡和侵袭的影响[J]. 吉林大学学报:医学版 , 2015, 41 (4) : 675–679. |
| [8] | Lam PY, Ko KM. Schisandrin B as a hormetic agent for preventing age-related neurodegenerative diseases[J]. Oxid Med Cell Longev , 2012, 2012 : 250825. DOI:10.1155/2012/250825 |
| [9] | 潘瑶, 林剑霞, 李妍. 五味子乙素的药理作用研究概况[J]. 吉林医药学院学报 , 2015, 36 (1) : 60–62. |
| [10] | 杨擎, 隋欣, 王宝森, 等. 五味子乙素对谷氨酸诱导SH-SY5Y细胞损伤的保护作用及其机制[J]. 吉林大学学报:医学版 , 2016, 42 (1) : 80–84. |
| [11] | Ba Q, Cui C, Wen L, et al. Schisandrin B shows neuroprotective effect in 6-OHDA-induced Parkinson's disease via inhibiting the negative modulation of miR-34a on Nrf2 pathway[J]. Biomed Pharmacother , 2015, 75 : 165–172. DOI:10.1016/j.biopha.2015.07.034 |
| [12] | Liu W, Liu Y, Wang Z, et al. Suppression of MAPK and NF-κB pathways by schisandrin B contributes to attenuation of DSS-induced mice model of inflammatory bowel disease[J]. Pharmazie , 2015, 70 (9) : 598–603. |
| [13] | 余浩佳, 冯向营, 辛世萌, 等. 丁苯酞注射液预处理通过NF-κB信号通路对大鼠脑缺血再灌注损伤的保护作用[J]. 中风与神经疾病杂志 , 2015, 32 (12) : 1119–1121. |
| [14] | Shevtsov MA, Nikolaev BP, Yakovleva LY, et al. Neurotherapeutic activity of the recombinant heat shock protein Hsp70 in a model of focal cerebral ischemia in rats[J]. Drug Des Devel Ther , 2014, 2014 (8) : 639–650. |
| [15] | Downwrd J. PI3-kinase, Akt and cell survival[J]. Semin Cell Dev Biol , 2004, 15 (2) : 177–182. DOI:10.1016/j.semcdb.2004.01.002 |
| [16] | Tyagi E, Agrawal R, Nath C, et al. Cholinergic protection via alpha7 nicotinic acetylcholine receptors and PI3K-Akt pathway in LPS-induced neuroin flammation[J]. Neurochem Int , 2010, 56 (1) : 135–142. DOI:10.1016/j.neuint.2009.09.011 |
 2016, Vol. 42
2016, Vol. 42


