扩展功能
文章信息
- 于海帆, 郭传辉, 李当当, 张虹亮, 耿爽, 杨占清, 郭斌, 岳占碰
- YU Haifan, GUO Chuanhui, LI Dangdang, ZHANG Hongliang, GENG Shuang, YANG Zhanqing, GUO Bin, YUE Zhanpeng
- 多效生长因子对小鼠子宫基质细胞蜕膜化的影响
- Effect of pleiotrophin on decidualization of uterine stromal cells in mice
- 吉林大学学报(医学版), 2016, 42(05): 855-859
- Journal of Jilin University (Medicine Edition), 2016, 42(05): 855-859
- 10.13481/j.1671-587x.20160503
-
文章历史
- 收稿日期: 2016-01-05
子宫内膜蜕膜化是胚泡植入、胎盘形成以及妊娠维持的必备条件之一。蜕膜化过程伴随着胚胎着床区域新血管网络的重塑[1],重塑的血管网络可以为胚胎的植入和发育提供支持和保障[2]。多效生长因子(pleiotrophin,PTN),又称成骨细胞特异性生长因子1,在骨生成和骨重塑方面具有潜在的作用[3]。已有研究[4]证实:PTN具有促进血管生成、促进细胞增殖与分化、刺激神经突触生长、诱导细胞迁移和促进细胞有丝分裂等多种生物学功能。PTN作为一种重要的生长因子,具有调控生理性和病理性血管生成的双重作用[5-6]。研究[7]显示:PTN能够增加局部血管内皮细胞数量和血管内皮前体细胞的数量,从而发挥其促血管生成作用。研究[8]表明:调控血管生成的多种细胞因子在蜕膜化过程中均发挥重要作用,提示PTN可能通过影响小鼠子宫的血管生成来调控子宫内膜蜕膜化过程,但关于PTN在小鼠子宫基质细胞蜕膜化过程中的作用及调控机制尚不清楚。本研究将小鼠PTN基因融合到pcDNA3.1(+)质粒空载体中,构建小鼠PTN基因过表达载体,将构建的PTN过表达载体转染小鼠子宫基质细胞,通过实时荧光定量PCR(qRT-PCR)法检测基质细胞中PTN及蜕膜化标志分子Prl8a2 (prolactin family 8,subfamily a,member 2) 和Prl3c1 (prolactin family 3,subfamily c,member 1 )表达水平的变化,旨在探讨PTN对小鼠子宫基质细胞蜕膜化的影响。
1 材料与方法 1.1 实验动物、细胞和主要试剂性成熟的昆明种小鼠由长春生物制品研究所有限责任公司提供,动物合格证号:SCXK(吉)2011-0007,饲养条件为室温22℃、光照14 h(06:00-20:00)和黑暗10 h,自由采食和饮水。感受态细胞DH5α(北京Tiangen 公司)。荧光定量试剂(美国Roche 公司),DL2000 Marker(日本TaKaRa 公司),T4 DNA连接酶、pGEM-T质粒载体和反转录酶M-MLV(美国Promega 公司),LA酶、限制性内切酶 EcoRⅠ和XhoⅠ及琼脂糖凝胶回收试剂盒(美国Omega 公司),Ⅰ型胶原酶(美国Gibco 公司),pcDNA 3.1(+)真核表达载体(美国Invitrogen 公司),DMEM/F12 1∶1培养基(美国Thermo Fisher 公司)。
1.2 PCR引物根据 GenBank 中报道的PTN基因的mRNA序列,利用Primer Premier 5在基因各自的编码区内设计特异性引物,并加入限制性内切酶位点。上游引物,5′-GAATTCAAAATGTCGTCCCAGCAAT-3′;下游引物,5′-CTCGAGTTTTAATCCAGCATCTTCTC-3′ (下划线分别表示EcoRⅠ和XhoⅠ酶切位点)。扩增片段长度为524 bp。引物由苏州金唯智生物科技有限公司合成。
1.3 PCR扩增目的基因取正常妊娠第7天小鼠子宫组织,提取总RNA,经反转录得到cDNA,以此cDNA为模板用含酶切位点的引物进行PCR扩增,扩增出含EcoRⅠ和XhoⅠ酶切位点的目的片段。扩增条件:模板1 μL,dNTP 2 μL,Taq 聚合酶0.14 μL,10×PCR buffer 2.5 μL,上下游引物(10 μmol·L-1)各1 μL,加水补足25 μL。反应条件:94℃预变性3 min;94℃变性30 s,55℃退火1 min,72℃延伸3 min,30个循环;72℃延伸10 min。扩增产物经1.5%琼脂糖凝胶电泳并按照DNA胶回收试剂盒说明操作,获得纯化的目的基因。
1.4 PTN过表达载体构建为了提高构建过表达载体的效率,胶回收产物先连接到pGEM-T质粒载体。连接反应体系为10 μL:已纯化目的基因 1 μL,pGEM-T质粒载体1 μL,2×Rapid Libgation buffer 5 μL,去离子水2 μL,T4 DNA连接酶 1 μL,连接反应4℃过夜。连接后质粒载体命名为 pGEM-T-PTN。将pGEM-T-PTN转化到DH5α感受态细胞中,挑取阳性克隆,采用快速质粒小提试剂盒对菌液进行提取,获得纯化的pGEM-T-PTN质粒载体。 分别用限制性内切酶EcoRⅠ和XhoⅠ对已纯化的质粒pGEM-T-PTN和pcDNA3.1(+)空载体进行双酶切。质粒pGEM-T-PTN双酶切体系为50 μL:pGEM-T-PTN 25 μL,10×M buffer 5 μL,去离子水17 μL,限制性内切酶EcoRⅠ和XhoⅠ各1.5 μL;pcDNA3.1(+)空载体双酶切体系为20 μL:pcDNA3.1(+)质粒空载体2 μL,10×M buffer 2 μL,去离子水14 μL,限制性内切酶EcoRⅠ和XhoⅠ各1 μL。室温下酶切反应1 h。pGEM-T-PTN和pcDNA3.1(+)的双酶切产物进行连接,反应体系为10 μL:pGEM-T双酶切产物3 μL,pcDNA3.1(+)空载体双酶切产物1 μL,T4 DNA连接酶1 μL,2×Rapid Libgation buffer 5 μL,反应4℃过夜。连接后重组质粒命名为pcDNA3.1(+)-PTN,转化入DH5α感受态细胞中,挑取阳性克隆,提取重组质粒pcDNA3.1-PTN,用限制性内切酶EcoRⅠ和XhoⅠ进行双酶切鉴定,室温下反应1 h。阳性菌液送长春库美生物公司测序。测序鉴定后对重组质粒pcDNA3.1(+)空载体和 pcDNA3.1-PTN的菌液进行大提质粒,获得纯化的重组质粒pcDNA3.1(+)空载体和 pcDNA3.1-PTN进行下一步实验。
1.5 细胞培养与转染取正常妊娠第4天小鼠子宫组织,纵向剖开后添加Ⅰ型胶原酶和2%胰蛋白酶以消化分离子宫基质细胞[9]。消化后按1×106mL-1的细胞密度接种到6孔板,1 h后换液以吸除上皮细胞,再加入含2%活性炭处理的胎牛血清的DMEN/F12培养基培养。24 h后将已分离的细胞分为2组:对照组转染pcDNA3.1(+)空载体质粒;过表达载体组转染重组质粒pcDNA3.1-PTN。于转染空载体和重组质粒24 h后收集细胞,倒置显微镜下观察细胞形态并拍照,观察倍数为200。
1.6 qRT-PCR法检测小鼠子宫基质细胞中PTNmRNA表达水平 将上述收集的小鼠子宫基质细胞提取总RNA,测定其浓度后取2 μg RNA反转录得到cDNA,以此cDNA为模板按荧光定量试剂盒提供的方法进行基因扩增以检测PTNmRNA表达水平。PTN基因上游引物为5′-TGGAGCTGAGTGCAAGTACC-3′,下游引物为5′-CAGTCAGCATTGTGCAGAGC-3′,扩增长度为108 bp。内参分子为甘油三磷酸脱氢酶(GAPDH),GAPDH上游引物为5′-GCCTTCCGTGTTCCTACCC-3′,下游引物为5′-TGCCTGCTTCACCACCTTC-3′,扩增长度为102 bp。qRT-PCR扩增条件:95℃预变性3 min,95℃变性15 s,60℃退火1 min,45个循环。反应体系为20 μL:模板5 μL,上下游引物(10 μmol·L-1)各0.2 μL,荧光定量染料10 μL,去离子水4.6 μL。反应在荧光定量PCR仪(BIO-RAD CFX96TM Real Time Detection System)上进行,并按照2-ΔΔCt 标准化法计算基因的相对表达水平。
1.7 qRT-PCR法检测小鼠子宫基质细胞中Prl8a2和Prl3c1mRNA表达水平以过表达载体组和对照组小鼠子宫基质细胞的cDNA为模板,qRT-PCR法检测PTN基因过表达对蜕膜化标志性分子表达的影响。qRT-PCR扩增条件及分析方法同1.6。Prl8a2,上游引物为5′-AGCCAGAAATCACTGCCACT-3′,下游引物为5′-TGATCCATGCACCCATAAAA-3′,扩增长度为119 bp;Prl3c1,上游引物为5′-GCCACACGATATGACCGGAA-3′,下游引物为5′-GGTTTGGCACATCTTGGTGTT-3′,扩增长度为162 bp。
1.8 统计学分析采用SPSS 19.0统计学软件进行统计学分析。PTN、Prl8a2和Prl3c1 mRNA相对表达水平以x±s表示,组间均数比较采用两独立样本t检验。以P<0.05表示差异有统计学意义。
2 结 果 2.1 PCR扩增PTN基因以小鼠子宫基质细胞cDNA为模板对PTN基因进行PCR扩增,扩增产物经1.5%琼脂糖凝胶电泳分析,可见约524 bp的条带,大小与理论值基本一致。见图 1。扩增产物经胶回收纯化后测序,测序结果进一步证实扩增片段为PTN基因。

|
| 图 1 PCR法扩增目的基因PTN的电泳图 Figure 1 Electrophoregram of PTN gene amplified by PCR method |
|
|
目的基因经胶回收纯化后连接到空质粒pGEM-T得到pGEM-T-PTN,挑取阳性克隆进行培养,pGEM-T-PTN经EcoRⅠ和XhoⅠ双酶切后,获得大小约524和3 000 bp的条带,其大小与理论值一致。见图 2。重组质粒pcDNA3.1-PTN用限制性内切酶EcoRⅠ和XhoⅠ进行双酶切后经琼脂糖凝胶电泳分析可见约524和5 000 bp 2个条带,其大小与理论值基本一致。见图 3。目的基因测序结果与GenBank中报道的PTN基因序列一致。见图 4。上述结果表明重组质粒 pcDNA3.1(+)-PTN构建成功。
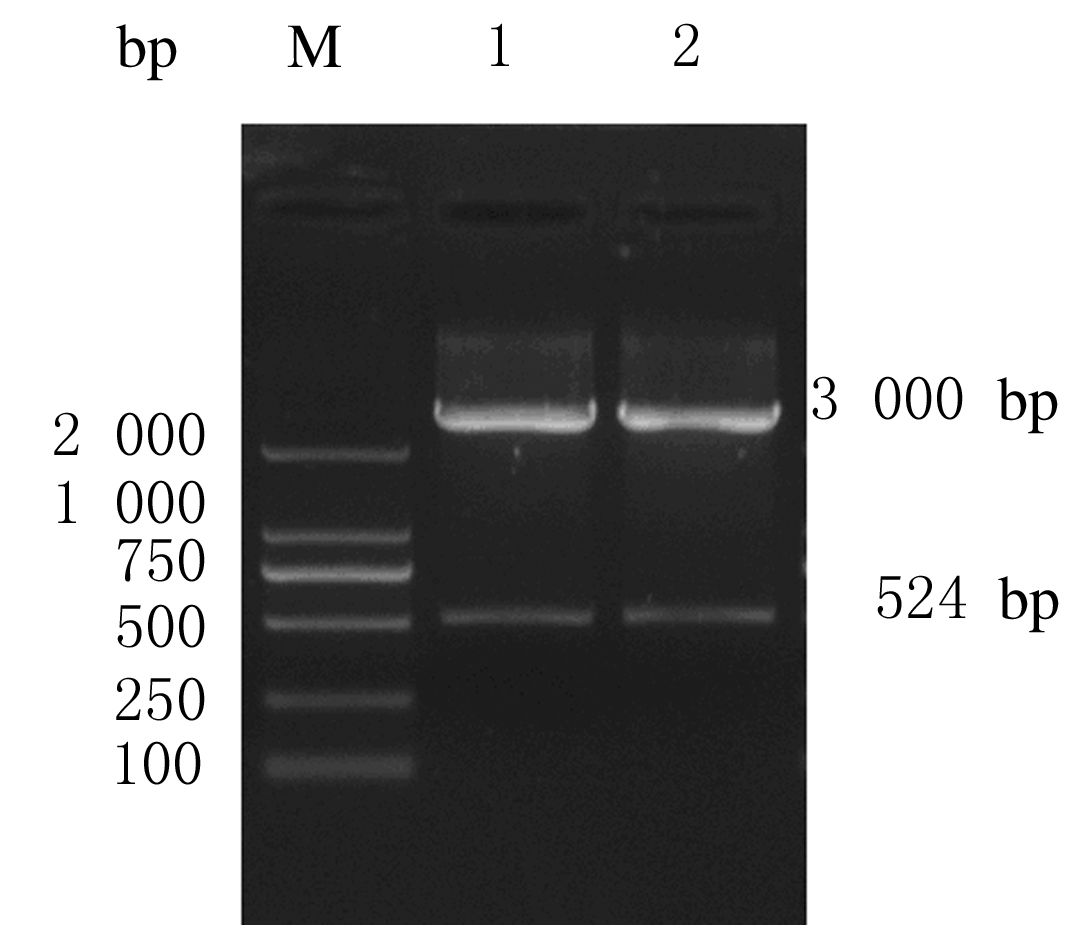
|
| 图 2 pGEM-T-PTN经EcoRⅠ和XhoⅠ双酶切鉴定的电泳图 Figure 2 Electrophoregram of identification of pGEM-T-PTN digested by EcoRⅠand XhoⅠ |
|
|
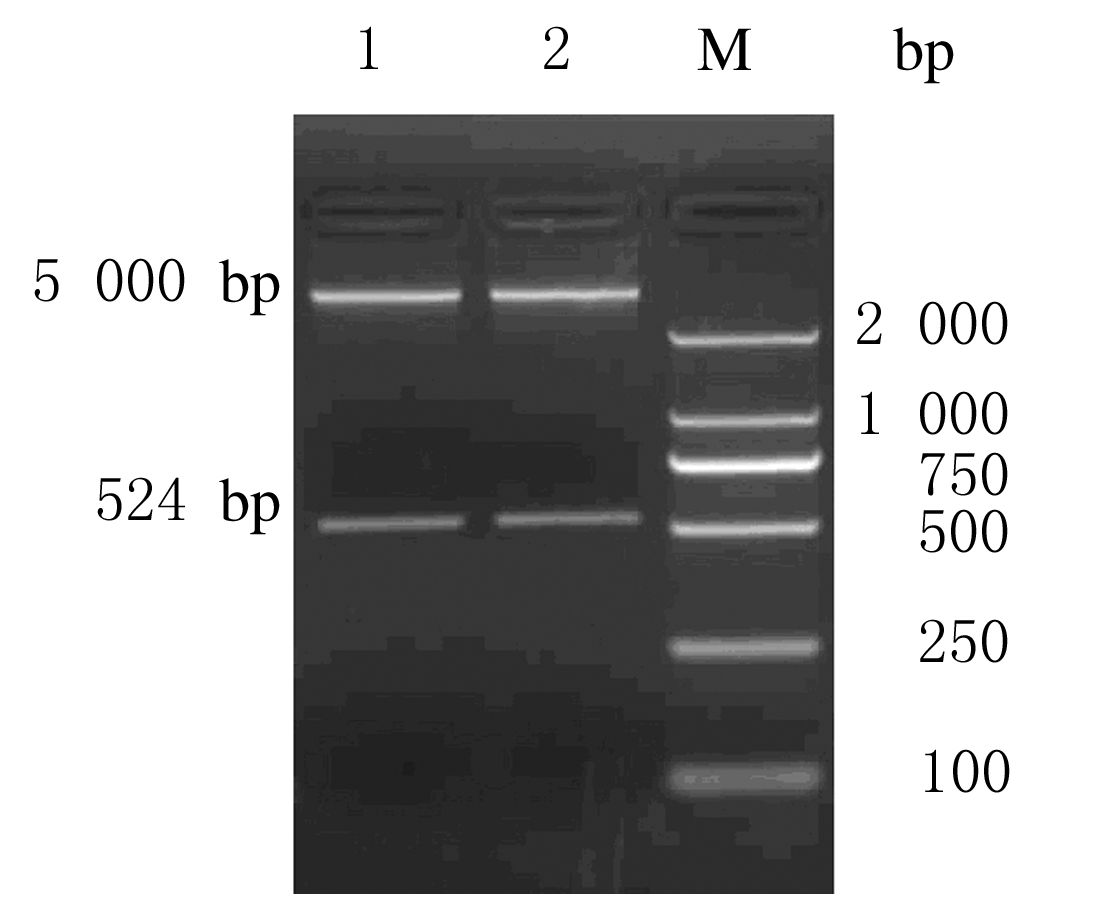
|
| 图 3 pcDNA3.1(+)-PTN经EcoRⅠ和XhoⅠ 双酶切鉴定的电泳图 Figure 3 Electrophoregram of identification of pcDNA3.1(+)-PTN digested by EcoRⅠand XhoⅠ |
|
|

|
| 图 4 经双酶切鉴定阳性克隆菌的测序结果 Figure 4 Sequencing results of positive clones identified by double enzyme digestion |
|
|
mRNA表达水平 将PTN过表达载体和pcDNA3.1(+)空载体瞬时转染子宫基质细胞24 h后,小鼠子宫基质细胞大多已贴壁生长且排列紧密,细胞形态多为长梭形,转染PTN过表达载体的小鼠子宫基质细胞与对照组比较在细胞形态上未见明显变化。见图 5(插页一)。qRT-PCR法检测:与对照组比较,转染PTN过表达载体可导致子宫基质细胞中PTN mRNA表达水平升高约17 740倍,提示利用瞬时转染的方法可有效地促进PTN在小鼠子宫基质细胞中的表达。见表 1。
| (n=3,x±s,η) | |||
| Group | PTN mRNA | Prl8a2 mRNA | Prl3c1 mRNA |
| Control | 1.00±0.08 | 1.00±0.05 | 1.00±0.09 |
| PTN overexprrssion | 17 740.00±1 257.00* | 1.69±0.16 * | 2.79±0.54* |
| *P<0.05 compared with control group. | |||
转染PTN过表达载体后,小鼠子宫基质细胞中Prl8a2 mRNA表达水平上调约1.69倍,而Prl3c1 mRNA表达水平上调约2.79倍。见表 1。
3 讨 论PTN最初是从牛的子宫和新生大鼠大脑中纯化得到的一种肝素结合蛋白,目前已报道在人、小鼠、鸡、鱼、蛙和昆虫等不同的物种中均存在其同源蛋白[10]。PTN具有2个β-折叠结构域,每个β-折叠结构域又含有3个呈反平行的β链。PTN在发育成熟组织的血管生成中起重要作用,其能够动员并促使血管内皮前体细胞迁移至缺血部位聚集,进而分化为血管内皮细胞,促进血管发生,在损伤组织中能够刺激毛细血管和微动脉的形成,使新生成的血管网络能够与机体建立紧密联系[11]。大量研究[5-6]表明:PTN在生理性和病理性血管生成过程中均发挥重要作用。已有研究[12]证实:PTN能够调控多种内皮细胞增殖、分化和迁移,并且可以直接诱导胚胎的血管生成。PTN不仅可以促进血管内皮细胞的增殖,而且能够通过与血管内皮生长因子(vascular endothelial growth factor,VEGF)结合来下调VEGF对内皮细胞增殖的刺激效应[13]。PTN基因过表达能够促进骨形成,对长期的骨骼生长发育有多方面效应[3]。PTN基因敲除鼠表现出骨生长发育和骨骼重建障碍,骨质减少[14-16]。
胚胎着床到子宫内膜是成功妊娠的关键,胚胎着床后子宫内膜开始发生蜕膜化,而血管生成是蜕膜化过程最重要的变化。蜕膜化过程中子宫内膜基质细胞大量增殖与分化并伴随着蜕膜区域血管发生一系列通透性变化[8]。研究[8]表明:调控血管生成的多种细胞因子在蜕膜化过程中均发挥着重要作用,提示PTN可能在小鼠子宫内膜基质细胞蜕膜化过程中发挥重要作用,但有关 PTN在小鼠子宫基质细胞蜕膜化过程中的作用及调控机制尚不清楚。
为了深入研究PTN在小鼠子宫基质细胞蜕膜化过程中的作用与调控机制,本研究将PTN基因融合到pcDNA3.1(+)质粒上,成功构建出PTN过表达载体并将其转染到体外分离培养的小鼠子宫基质细胞中,qRT-PCR法检测相关基因表达变化结果显示:与对照组比较,转染PTN过表达载体24h后的小鼠子宫基质细胞PTN表达水平显著升高;同时,过表达PTN可使小鼠子宫基质细胞中蜕膜化标志性分子Prl8a2和Prl3c1表达水平均显著升高,说明PTN在小鼠子宫蜕膜化过程中起重要作用。有关PTN在小鼠子宫基质细胞蜕膜化过程中的调控机制仍有待进一步研究。
| [1] | Ramathal CY, Bagchi IC, Taylor RN, et al. Endometrial decidualization:of mice and men[J]. Semin Reprod Med , 2010, 28 (1) : 17–26. DOI:10.1055/s-0029-1242989 |
| [2] | Carson DD, Bagchi I, Dey SK, et al. Embryo implantation[J]. Dev Biol , 2000, 223 (2) : 217–237. DOI:10.1006/dbio.2000.9767 |
| [3] | Lamprou M, Kaspiris A, Panagiotopoulos E, et al. The role of pleiotrophin in bone repair[J]. Injury , 2014, 45 (12) : 1816–1823. DOI:10.1016/j.injury.2014.10.013 |
| [4] | 韩文文, 李慧娟, 王仙琦, 等. 多效生长因子通过诱导肿瘤血管生成、重建肿瘤微环境和活化基质纤维发挥多功能肿瘤启动子作用[J]. 胃肠病学和肝病学杂志 , 2014, 23 (7) : 843–847. |
| [5] | Papadimitriou E, Mikelis C, Lampropoulou E, et al. Roles of pleiotrophin in tumor growth and angiogenesis[J]. Eur Cytokine Netw , 2009, 20 (4) : 180–190. |
| [6] | Pantazaka E, Papadimitriou E. PTN(pleiotrophin)[J]. Atlas Genet Cytogenet Oncol Haematol , 2012 (16) : 821–837. |
| [7] | Antoine M, Tag CG, Wirz W, et al. Upregulation of pleiotrophin expression in rat hepatic stellate cells by PDGF and hypoxia:implications for its role in experimental biliary liver fibrogenesis[J]. Biochem Biophys Res Commun , 2005, 337 (4) : 1153–1164. DOI:10.1016/j.bbrc.2005.09.173 |
| [8] | Zhang S, Lin H, Kong S, et al. Physiological and molecular determinants of embryo implantation[J]. Mol Aspects Med , 2013, 34 (5) : 939–980. DOI:10.1016/j.mam.2012.12.011 |
| [9] | Li DD, Guo CH, Yue L, et al. Expression, regulation and function of Hmgn3 during decidualization in mice[J]. Mol Cell Endocrinol , 2015 (413) : 13–25. |
| [10] | Englund C, Birve A, Falileeva L, et al. Miple1 and miple2 encode a family of MK/PTN homologues in Drosophila melanogaster[J]. Dev Genes Evol , 2005, 216 (1) : 10–18. |
| [11] | 张圣飞, 冯新民, 陶玉平, 等. 多效生长因子及血小板源性生长因子在增龄鼠椎间盘中的表达[J]. 中国组织工程研究与临床康复 , 2011, 15 (15) : 2764–2768. |
| [12] | Magnusson PU, Dimberg A, Mellberg S, et al. FGFR-1 regulates angiogenesis through cytokines interleukin-4 and pleiotrophin[J]. Blood , 2007, 110 (13) : 4214–4222. DOI:10.1182/blood-2007-01-067314 |
| [13] | Heéroult M, Bernard-Pierrot I, Delbé J, et al. Heparin affin regulatory peptide binds to vascular endothelial growth factor (VEGF) and inhibits VEGF-induced angiogenesis[J]. Oncogene , 2004, 23 (9) : 1745–1753. DOI:10.1038/sj.onc.1206879 |
| [14] | Imai S, Heino TJ, Hienola A, et al. Osteocyte-derived HB-GAM (pleiotrophin) is associated with bone formation and mechanical loading[J]. Bone , 2009, 44 (5) : 785–794. DOI:10.1016/j.bone.2009.01.004 |
| [15] | 陈丽平, 周美芳, 吕杰强. 血管内皮生长因子基因与习惯性流产的相关性研究[J]. 西安交通大学学报:医学版 , 2015, 36 (4) : 538–542. |
| [16] | 王爽, 丰培勋, 陈悦, 等. 转化生长因子β1对牙周膜干细胞迁移、粘附及增殖的影响[J]. 西安交通大学学报:医学版 , 2015, 36 (6) : 782–786. |
 2016, Vol. 42
2016, Vol. 42


