扩展功能
文章信息
- 方滕姣子, 刘杰, 顾中一, 宫海环, 布文奂, 董悦, 孙宏晨
- FANG Tengjiaozi, LIU Jie, GU Zhongyi, GONG Haihuan, BU Wenhuan, DONG Yue, SUN Hongchen
- 聚乙烯亚胺介导miR-2861模拟物转染MC3T3-E1细胞的体外成骨分化
- Osteogenesis differentiation of MC3T3-E1 cells induced by miRNA-2861 mimic transfection mediated by polyethylenimine
- 吉林大学学报(医学版), 2016, 42(05): 848-854
- Journal of Jilin University (Medicine Edition), 2016, 42(05): 848-854
- 10.13481/j.1671-587x.20160502
-
文章历史
- 收稿日期: 2016-01-10
微小RNA(microRNA,miRNA)是近年来发现的一类长约22nt的非编码单链RNA,可沉默转录后水平的基因表达从而发挥调节功能。作为内源性的RNA干涉(RNA interference,RNAi)途径,miRNA几乎参与了体内所有生物调控过程。在基因治疗中,由于miRNA能通过多个信号通路有效调控成骨细胞和破骨细胞的增殖、功能和定向分化能力,因此常被应用于骨组织工程领域,通过非病毒载体将miRNA递送至局部或全身以期达到良好的骨再生效果[1-4]。最近,有研究[5]鉴定出在小鼠原代成骨细胞中高表达的一种miRNA基因,即miRNA-2861(miR-2861),其在骨形态发生蛋白2(BMP-2)诱导下利用pre-miR-2861转染ST2细胞使miR-2861过表达,促进ST2细胞成骨向分化。然而,目前国内外采用非病毒载体递送miR-2861 mimic(人工合成的单链模拟物)进一步应用于基因治疗的研究却鲜有报道。因此,本研究选择聚乙烯亚胺(polyethylenimine,PEI)这种经典的阳离子聚合物作为miRNA的递送载体,介导miR-2861转染前成骨细胞系MC3T3-E1,检测转染效果及对MC3T3细胞成骨分化能力的影响,为miR-2861模拟物在骨组织工程领域的应用提供理论依据。
1 材料与方法 1.1 细胞株、主要试剂和仪器小鼠前成骨细胞系MC3T3-E1(Gibco公司,美国)。α-MEM培养基粉、胎牛血清(FBS)和青霉素-链霉素溶液(Gibco公司,美国),4-羟乙基哌嗪乙磺酸(HEPES)、聚乙烯亚胺(PEI,MW=1800)(Sigma-Aldrich公司,美国),胰蛋白酶粉剂和MTT粉剂(噻唑蓝,宝泰克生物有限公司,中国),RNA提取试剂盒(北京德迈德公司,中国),PrimerScriptTMRT reagent Kit和SYBROR Premix Ex TaqTM(大连TaKaRa公司,中国)。倒置荧光显微镜及照相系统(Olympus公司,日本),酶标仪(RT-6000,深圳雷杜生命科学技术有限公司)。miR-2861 mimic (基因序列:5′-GGGGCCUGGCGGCGGGCGG-3′)和阴性对照(Negative control, NC)(基因序列:5′-UCACAACCUCCUAGAAAGAGUAGA-3′),逆转录及PCR特异性茎环引物为Bulge-Loop miR-2861。RT-PCR primer及U6 snRNA qRT-PCR Primer Set 试剂盒(Ribobio公司,中国)。
1.2 细胞培养MC3T3-E1细胞培养在含有10%胎牛血清、100 U·mL-1青霉素和100mg·L-1链霉素的α-MEM培养基中,于37℃、5% CO2恒温孵箱中培养,每2~3 d更换培养基。
1.3 实验分组及瞬时转染方法将人工合成的miR-2861模拟物和阴性对照(NC)溶于经DEPC处理的三蒸水中制成20μmol·L-1贮存液,实验时用培养基稀释成所需浓度。实验分为:空白对照组(未处理的细胞),10、20、30、50和100 nmol·L-1miR-2861模拟物/PEI组,50和100 nmol·L-1的NC/PEI组。细胞转染(以6孔板为例):将复苏后的MC3T3-E1细胞以6×104个/孔的密度接种到孔板中,接种24 h后观察细胞,待细胞融合至60%~70%进行瞬时转染。PEI转染miRNA的量以两者的N/P比例计算,要求N/P=10。 转染时将一定量的PEI与不同浓度的miR-2861混合,静置10 min后用无血清培养基转染细胞,6~8 h换成普通培养基(含血清)完成转染过程。
1.4 成骨诱导方法将MC3T3-E1细胞系复苏后置于含10%血清的α-MEM培养液中培养,接种至孔板24 h后换用成骨细胞诱导培养基(10 mmol·L-1β-甘油磷酸钠,50 mg·L-1抗坏血酸,含10%胎牛血清的α-MEM)[6],每3 d换液1次,根据实验需求分别诱导3、7、14和21 d。
1.5 MTT法检测细胞增殖抑制率将处于对数生长期的MC3T3-E1细胞消化离心重悬后接种到3个96孔板(3×103个/孔)中,置于37℃、5%CO2孵箱中培养24h后,用无血清培养基以不同浓度的miR-2861/PEI(10、20、30、50和100 nmol·L-1)对细胞进行转染,4~6 h后换有血清培养基。每个剂量设5个复孔,同时设定空白对照组(不加miR-2861/PEI)及阴性对照组(NC)。分别在24、48和72 h时向各板加入20μL的MTT液(5g·L-1),37℃孵育4 h,弃去上清后每孔加入DMSO150μL并振荡混匀,用酶标仪在550 nm波长条件下测定吸光度(A)值。按照以下公式计算细胞增殖率:细胞增殖率=实验组A值/对照组A值×100%。
1.6 荧光成像实验检测细胞内转染效率将处于对数生长期的MC3T3-E1细胞以每孔6×104个细胞的密度接种到6孔板中,将孔板置于恒温孵箱中培养24 h;待细胞融合至60%左右进行瞬时转染,将带有Cy3标记的miR-2861小分子序列分别以10、50和100 nmol·L-1浓度与对应量的PEI混合后加入无血清培养基中转染细胞,于转染后4~6h更换新鲜的培养基;转染24 h后,弃去培养基,PBS冲洗3次,用4%多聚甲醛固定细胞30 min;弃去多聚甲醛,加入1% DAPI对细胞核进行染色。通过荧光倒置显微镜观察MC3T3-E1细胞内荧光表达情况。细胞内红色荧光表示Cy3-miR-2861,蓝色荧光表示细胞核,通过将带红色荧光细胞与蓝色荧光标记细胞核数目进行对比,显微镜下大致评估转染效率。
1.7 茎环法RT-PCR检测瞬时转染细胞后miR-2861表达将MC3T3-E1细胞以6×104个/孔接种于6孔板中,进行成骨诱导,分别将10、30、50和100 nmol·L-1的miR-2861模拟物及100 nmol·L-1的阴性对照转染MC3T3-E1细胞系,并设置空白对照(blank control)组。于转染后24、48和72 h收集各组细胞,利用试剂盒提取其各组细胞总RNA,然后通过反转录RT试剂盒及Bulge-Loop 特殊引物对RNA进行反转录,分别获得U6内参和miR-2861的cDNA。以反转录产物cDNA为模板,采用SYBR Green Ex Taq进行实时荧光定量PCR反应。
1.8 RT-PCR法检测瞬时转染细胞上调miR-2861后成骨相关基因的表达将MC3T3-E1细胞以每孔6×104个的密度接种于6孔板中,实验分为空白对照组、实验组(50 nmol·L-1miR-2861/PEI)和NC组(50 nmol·L-1 NC/PEI)。接种24 h后用一定量的PEI瞬时转染细胞并进行成骨诱导(每隔3 d重复1次连续转染),分别于3、7和14 d时分别收集各组细胞,利用试剂盒提取其各组细胞总RNA,然后通过反转录RT试剂盒将RNA反转录为cDNA。以反转录产物cDNA为模板,采用SYBR Green Ex Taq进行实时荧光定量PCR反应。成骨相关基因Runx2、Ⅰ型胶原(ColⅠ)和碱性磷酸酶(ALP)引物,以及内参β-actin(Actb)的引物序列见表 1。
| Genename | Accession No. | Primer sequence(5′-3′) | Size(bp) | Product size(bp) |
| Actb | NM_031144 | F: 5′-GGAGATTACTGCCCTGGCTCCTA-3′R: 5′-GACTCATCGTACTCCTGCTTGCTG-3′ | 2324 | 150 |
| Runx2 | NM_053470 | F: 5′-CATGGCCGGGAATGATGAG-3′ R: 5′-TGTGAAGACCGTTATGGTCAAAGTG-3′ | 1925 | 148 |
| ColⅠ | NM_053304 | F: 5′-GACATGTTCAGCTTTGTGGACCTC-3′ R: 5′-AGGGACCCTTAGGCCATTGTGTA-3′ | 2423 | 120 |
| ALP | NM_013059 | F: 5′-CATCGCCTATCAGCTAATGCACA-3′ R: 5′-ATGAGGTCCAGGCCATCCAG-3′ | 2320 | 150 |
将MC3T3-E1细胞接种于6孔板中,待细胞融合至60%~70%时进行转染(实验分组同1.8),之后进行成骨诱导并培养21 d。将各组细胞用4%多聚甲醛固定30 min,经PBS洗涤后用1%茜素红染液于CO2孵箱中染色15 min,再次洗涤后于倒置显微镜下观察并拍照。配置10%氯化十六烷基吡啶溶液洗脱茜素红染液,置于室温下孵育30 min。吸取各组上清,使用紫外分光光度计,在波长562 nm 处测定各样本吸光度(A)值,用氯化十六烷基溶液调零,并同时测定单纯细胞组(未加茜素红) 上清A值。每个样本重复3次,计算平均值及标准差。样本(茜素红定量)测定值=样本A值-单纯细胞组A值。
1.10 统计学分析采用SPSS10.0统计软件进行统计学处理。细胞增殖抑制率、miR-2861和成骨相关基因的mRNA表达水平以x±s表示,多组间样本均数比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结 果 2.1 不同时间点各组MC3T3-E1细胞增殖率与空白对照组(100.0%)比较,不同浓度miR-2861/PEI复合物组24和48h 时MC3T3-E1细胞增殖率无明显变化(P>0.05)。与空白对照组比较,72h时100 nmol·L-1miR-2861/PEI复合物组和阴性对照组细胞增殖率明显下降(P<0.05),10、20、30和50 nmol·L-1miR-2861/PEI组细胞增殖率略有下降,但差异无统计学意义(P>0.05)。见表 2。
| (n=5,x±s,η/%) | |||
| Group | Proliferation rate | ||
| (t/h) 24 | 48 | 72 | |
| Blnak control | 100.00±0.02 | 100.00±0.01 | 100.00±0.03 |
| miR-2861/PEI (nmol·L-1) | |||
| 10 | 96.68±0.20 | 100.58±0.02 | 90.85±0.06 |
| 20 | 101.92±0.19 | 99.67±0.02 | 87.51±0.02 |
| 30 | 103.97±0.21 | 94.42±0.02 | 86.64±0.03 |
| 50 | 98.39±0.20 | 97.01±0.04 | 84.27±0.04 |
| 100 | 94.69±0.18 | 90.53±0.02 | 78.34±0.01* |
| NC/PEI 100 nmol·L-1 | 99.39±0.21 | 92.15±0.02 | 80.99±0.02* |
| *P<0.05 compared with blank control group . | |||
按照一定的N/P比例,用适量的PEI将人工合成的带有Cy3红色荧光标记的miR-2861双链小分子序列转染入细胞,在荧光倒置显微镜下观察细胞的瞬时转染效率。当miR-2861浓度低至10 nmol·L-1时,荧光微弱,仅有少数细胞的胞浆内能检测到红色荧光;但随着转染浓度增加,胞浆部位的红色荧光增强,转染效率呈明显增高趋势;在转染浓度为50 nmol·L-1时,已观察到胞内明显的红色荧光,且清晰显示红色荧光均定位于细胞质,围绕在蓝色的细胞核周围,转染效率约为60%;当转染浓度达到100 nmol·L-1时,约80%以上的细胞内转染入miR-2861小分子序列,且荧光表达强于50 nmol·L-1miR-2861/PEI组。见图 1(插页一)。
2.3 茎环法RT-PCR检测瞬时转染MC3T3-E1细胞后miR-2861表达水平在瞬时转染不同浓度miR-2861/PEI后,各时间点细胞中miR-2861表达水平均较空白对照和NC/PEI组明显升高(P<0.05或P<0.01),在48 h时各浓度miR-2861/PEI组的转染效率最高。见表 3。
| (n=3,x±s,η) | |||
| Group | Expression level of miR-2861 | ||
| (t/h)24 | 48 | 72 | |
| Blank control | 1.00±0.12 | 1.00±0.11 | 1.00±0.17 |
| miR-2861/PEI(nmol·L-1 ) | |||
| 10 | 983.21±20.44** | 3 524.81±248.23** | 843.33±27.34** |
| 30 | 2 184.87±174.57** | 4 582.61±279.38** | 1 249.09±153.20** |
| 50 | 4 804.12±55.56** | 6 586.99±83.35** | 3 986.21±40.63** |
| 100 | 5 317.69±148.03* | 7 004.89±183.17** | 4 260.09±29.42** |
| NC/PEI | 1.61±0.15 | 4.26±0.69 | 2.67±1.16 |
| *P<0.05,** P<0.01 compared with blank control group. | |||
结合MTT检测结果和瞬时转染后细胞内miR-2861表达结果,初步选定50 nmol·L-1浓度为最终实验浓度。将PEI介导的等量miR-2861和NC分别连续转染MC3T3细胞,并在转染后3、7和14 d时利用RT-PCR检测ALP、Runx2和ColⅠ的mRNA表达情况。50 nmol·L-1 miR-2861/PEI组在3 d时ALP和ColⅠmRNA表达水平高于空白对照组(P<0.05或P<0.01);在7和14 d时,50 nmol·L-1 miR-2861/PEI组的成骨相关基因表达水平均高于空白对照组(P<0.05)。而50 nmol·L-1 NC/PEI组在3、7和14 d时成骨相关基因表达水平与空白对照组比较差异无统计学意义(P>0.05)。见表 4。
| (n=3,x±s,η) | |||||||||||
| Group | ALP mRNA | Runx2 mRNA | ColⅠ mRNA | ||||||||
| (t/d) 3 | 7 | 14 | 3 | 7 | 14 | (t/d) 3 | 7 | 14 | |||
| Control | 1.000±0.024 | 1.000±0.045 | 1.000±0.091 | 1.000±0.153 | 1.000±0.116 | 1.000±0.173 | 1.000±0.191 | 1.000±0.214 | 1.000±0.258 | ||
| 50 nmol·L-1 miR-2861/PEI | 1.210±0.065** | 1.040±0.030 | 1.320±0.097* | 1.240±0.287* | 1.310±0.047* | 1.240±0.096* | 1.460±0.326* | 1.280±0.083* | 1.520±0.128* | ||
| 50 nmol·L-1 NC/PEI | 0.980±0.115 | 0.880±0.105 | 0.870±0.128 | 1.010±0.213 | 0.940±0.019 | 0.950±0.164 | 1.010±0.158 | 0.940±0.147 | 1.070±0.161 | ||
| *P<0.05,** P<0.01 compared with blank control group. | |||||||||||
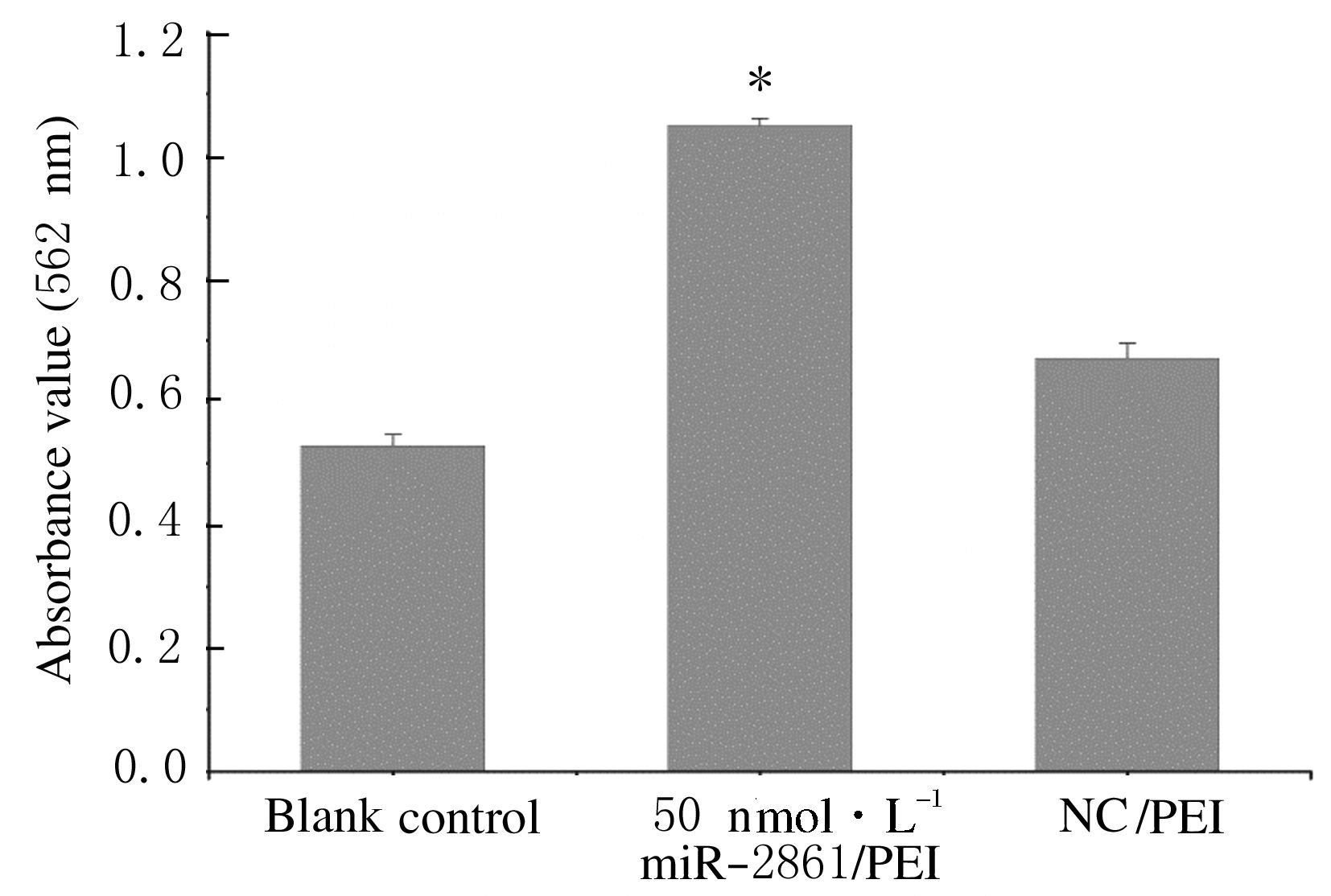
成骨诱导分化培养21 d后,各组MC3T3-E1细胞经茜素红染色结果:与空白对照组和阴性对照组比较,用PEI连续瞬时转染50 nmol·L-1 miR-2861模拟物后MC3T3细胞形成的矿化结节量明显增多,可观察到散在红染的矿化团块(图 2,插页一)。进一步提取各组含有的茜素红成分进行定量分析结果:空白对照组的A值为0.528 4±0.018 3,50 nmol·L-1 miR-2861/PEI组和阴性对照组的A值分别为1.048 6±0.011 2和0.670 8±0.023 9,50 nmol·L-1 miR-2861/PEI组的MC3T3细胞其骨基质钙化能力明显增强(P<0.01)。见图 3。
|
| 图 3 各组MC3T3-E1细胞成骨分化过程中骨基质钙化的定量分析 Figure 3 Quantitative analysis of bone matrix calcification in osteogenesis differentiation process of MC3T3-E1 cells in various groups |
|
|
骨组织通过成骨细胞介导的骨形成和破骨细胞介导的骨吸收过程不断发生骨改建。成骨细胞作为骨发生及骨形成的前提,对骨的代谢平衡、生长发育和损伤修复过程起着至关重要的作用。然而,成骨细胞的分化和成熟受多种因素影响,如炎症反应、细胞因子和激素水平的异常等均可干扰成骨细胞正常代谢进而导致骨质吸收破坏[7]。
基因治疗通过将外源性基因导入患者特定细胞和组织中进行适当表达,从根源上纠正异常基因,从而治疗因基因缺陷所引起的疾病[8-9]。近年来大量研究[10]表明:miRNA能通过调节多种网状信号通路和细胞因子参与成骨细胞分化成熟过程中的各个阶段,其中较为经典的如BMP信号通路和成骨细胞分化核心转录因子Runt相关转录因子2(runt-related transcription factor 2,Runx2)等。Runx2属于Runt相关转录因子家族成员,能通过TGF-β和Notch等信号通路启动表达最终激活成骨分化的相关基因,是成骨分化过程中关键的转录因子之一[11]。
Li等[5]发现:miR-2861是一种在小鼠成骨细胞中高表达的miRNA。当沉默小鼠骨髓基质细胞ST2中的miR-2861基因后,细胞在BMP-2蛋白的诱导下成骨分化能力下降,而转染 miRNA前体(pre-miR-2861)质粒使miR-2861过表达则可通过靶定目的基因组蛋白去乙酰化酶5(histone deacetylase,HDAC5),解除其对Runx2的抑制作用从而正向调控小鼠成骨细胞的分化。另有研究[12]显示:与miR-2861在同基因座位点上的miR-3960也具有类似作用,miR-3960可通过靶定同源异形盒(homeobox,HOX)α2调控成骨分化,同时Runx2促进miR-3960/miR-2861表达簇的转录,形成了一个Runx2/miR-3960/miR-2861正反馈调控环路,协同发挥促进成骨细胞分化的功能。以上研究结果均提示:miR-2861在成骨细胞分化过程中发挥了重要作用。
在基因治疗中,裸露的miRNA具有靶向能力差、半衰期短和易被核酶降解的特性,所以选择安全和高效的载体是基因治疗成功的关键之一[13-14]。PEI是一种常用的多聚阳离子型的非病毒载体。其氨基团质子化作用表面带正电,具有与电负性核酸结合的能力,并通过静电吸附作用使基因/PEI复合物被动内吞入细胞中。此外,PEI还由于具有“质子海绵”效应,能够促使进入细胞的基因/PEI复合物从内涵体中逃逸从而使目的基因稳定表达[15-17]。因此,本研究选择PEI介导miR-2861模拟物转染小鼠成骨细胞系MC3T3-E1,检测其转染效率和细胞的成骨分化潜能。
本实验结果显示:PEI介导miR-2861模拟物能有效转染MC3T3-E1细胞,通过荧光成像和茎环法RT-PCR双重水平验证了瞬时转染miR-2861/PEI的MC3T3细胞可高表达miR-2861,且细胞内miR-2861水平随模拟物转染浓度加大而明显增加,表现为量效依赖关系,表明本实验中所用的miR-2861模拟物能有效增强MC3T3细胞中miR-2861水平。此外,72 h时茎环法RT-PCR结果显示:与空白对照组和阴性对照组比较,10、30、50和100nmol·L-1miR-2861模拟物在细胞中的mRNA表达水平明显升高,说明PEI转染miR-2861模拟物后对MC3T3-E1细胞发挥的生物学作用可持续至72h或更长时间。本研究中MTT实验结果显示:高浓度(100 nmol·L-1)miR-2861/PEI复合物对MC3T3细胞的增殖具有轻微抑制作用,而50 nmol·L-1miR-2861/PEI在具有较高转染效率的同时不影响细胞的增殖,因此选择50 nmol·L-1作为进一步实验的最佳浓度。RT-PCR和茜素红实验结果显示:与空白对照组及NC组比较,MC3T3细胞在转染50 nmol·L-1 miR-2861模拟物后成骨相关基因表达升高、钙盐的沉积量明显增加(P<0.05或P<0.01),表明MC3T3细胞经miR-2861模拟物调控后其成骨分化能力增强。
综上所述,通过非病毒载体PEI介导miR-2861模拟物能够有效转染MC3T3-E1细胞并发挥促进其成骨分化的功能。在未来的基因治疗中,利用非病毒载体PEI介导的miR-2861模拟物有望成为治疗骨损伤、骨质疏松症或骨缺损相关疾病的新策略。
| [1] | Kapinas K, Delany AM. MicroRNA biogenesis and regulation of bone remodeling[J]. Arthritis Res Ther , 2011, 13 (3) : 220. DOI:10.1186/ar3325 |
| [2] | 孙宏晨, 方滕姣子, 李道伟, 等. 微小RNA对骨重塑和炎症性骨吸收调控的研究进展[J]. 吉林大学学报:医学版 , 2015, 41 (1) : 195–198. |
| [3] | van Wijnen AJ, van de Peppel J, van Leeuwen JP, et al. MicroRNA functions in osteogenesis and dysfunctions in osteoporosis[J]. Curr Osteoporosis Rep , 2013, 11 (2) : 72–82. DOI:10.1007/s11914-013-0143-6 |
| [4] | Ivey KN, Srivastava D. MicroRNAs as regulators of differentiation and cell fate decisions[J]. Cell Stem cell , 2010, 7 (1) : 36–41. DOI:10.1016/j.stem.2010.06.012 |
| [5] | Li H, Xie H, Liu W, et al. A novel microRNA targeting HDAC5 regulates osteoblast differentiation in mice and contributes to primary osteoporosis in humans[J]. J Clin Invest , 2009, 119 (12) : 3666–3677. DOI:10.1172/JCI39832 |
| [6] | Qiao C, Zhang K, Jin H, et al. Using poly (lactic-co-glycolic acid) microspheres to encapsulate plasmid of bone morphogenetic protein 2/polyethylenimine nanoparticles to promote bone formation in vitro and in vivo[J]. Int J Nanomedicine , 2013, 8 (1) : 2985–2995. |
| [7] | Redlich K, Smolen JS. Inflammatory bone loss:pathogenesis and therapeutic intervention[J]. Nat Rev Drug Discov , 2012, 11 (3) : 234–250. DOI:10.1038/nrd3669 |
| [8] | 李燕, 阳俊, 刘桂英, 等. 基因治疗药物输递系统的研究现状及发展趋势[J]. 生物化学与生物物理进展 , 2013, 40 (10) : 998–1007. |
| [9] | Lu CH, Chang YH, Lin SY, et al. Recent progresses in gene delivery-based bone tissue engineering[J]. Biotechnol Adv , 2013, 31 (8) : 1695–1706. DOI:10.1016/j.biotechadv.2013.08.015 |
| [10] | Karsenty G, Kronenberg HM, Settembre C. Genetic control of bone formation[J]. Annu Rev Cell Dev Biol , 2009, 25 : 629–648. DOI:10.1146/annurev.cellbio.042308.113308 |
| [11] | 周名亮, 李谧, 余希杰. 微小RNA对成骨细胞分化成熟的调控及临床意义[J]. 中国修复重建外科杂志 , 2012, 26 (6) : 755–759. |
| [12] | Hu R, Liu W, Li H, et al. A Runx2/miR-3960/miR-2861 regulatory feedback loop during mouse osteoblast differentiation[J]. J Biol Chem , 2011, 286 (14) : 12328–12339. DOI:10.1074/jbc.M110.176099 |
| [13] | Zhang Y, Wang Z, Gemeinhart RA. Progress in microRNA delivery[J]. J Control Release , 2013, 172 (3) : 962–974. DOI:10.1016/j.jconrel.2013.09.015 |
| [14] | Ben-Shushan D, Markovsky E, Gibori H, et al. Overcoming obstacles in microRNA delivery towards improved cancer therapy[J]. Drug Deliv Transl Res , 2014, 4 (1) : 38–49. DOI:10.1007/s13346-013-0160-0 |
| [15] | Boussif O, Lezoualc'h F, Zanta MA, et al. A versatile vector for gene and oligonucleotide transfer into cells in culture and in vivo:polyethylenimine[J]. Proc Nat1 Acad Sci USA , 1995, 92 (16) : 7297–7301. DOI:10.1073/pnas.92.16.7297 |
| [16] | 李玮, 李坤阳, 范云, 等. 富血小板纤维蛋白对人牙周膜成纤维细胞迁移及成骨分化的影响[J]. 郑州大学学报:医学版 , 2014, 49 (1) : 108–112. |
| [17] | 王慧丽, 谢冰, 李欣, 等. 人参皂苷Rd对高糖致人牙周膜干细胞成骨分化抑制作用的影响[J]. 郑州大学学报:医学版 , 2015, 50 (4) : 542–546. |
 2016, Vol. 42
2016, Vol. 42


