扩展功能
文章信息
- 宋志强, 沈海山, 王文佳, 吴建臣, 李然伟, 李胜文
- SONG Zhiqiang, SHEN Haishan, WANG Wenjia, WU Jianchen, LI Ranwei, LI Shengwen
- 硫化氢及其合成酶在膀胱癌细胞株中的表达及其作用
- Expressions of hydrogen sulfide and its synthases in bladder cancer cell lines and their effects
- 吉林大学学报(医学版), 2016, 42(05): 843-847
- Journal of Jilin University (Medicine Edition), 2016, 42(05): 843-847
- 10.13481/j.1671-587x.20160501
-
文章历史
- 收稿日期: 2016-03-06
2. 清华大学第一附属医院泌尿外科, 北京 100016;
3. 吉林大学第二医院泌尿外科, 吉林 长春 130041
2. Department of Urology, First Hospital, Tsinghua University, Beijing 100016, China;
3. Department of Urology, Second Hospital, Jilin University, Changchun 130041, China
膀胱癌发病率居中国男性泌尿生殖系恶性肿瘤的第1位,中国恶性肿瘤发病率第8位,占中国恶性肿瘤发病构成的2.5%[1],是泌尿系统最常见的恶性肿瘤之一。多发、容易复发、浸润和转移等是膀胱癌的特点,但目前尚无有效的膀胱肿瘤标记物,其发生机制尚未明确,晚期膀胱癌患者亦常因出现顺铂耐受而致化疗失败[2],故对膀胱癌的早期诊断及有效治疗仍是难题。硫化氢(hydrogen sulfide,H2S)广泛存在于人体内并参与多种病理生理过程[3-5],被认为是人体内一种新的气体信号分子[6]。亦有研究[7]显示:H2S及其合成酶参与肿瘤的病理生理过程,但其在膀胱癌中的表达及作用研究鲜有报道。本研究测定膀胱癌细胞株和膀胱正常上皮细胞株中H2S及其合成酶胱硫醚β合成酶(cystathionine beta synthase,CBS)和胱硫醚γ裂解酶(cystathionine gamma lyase,CSE)的表达水平,同时采用外源性H2S供体硫氢化钠(sodium hydrosulfide,NaHS)处理膀胱癌EJ细胞株,旨在初步探讨H2S及其合成酶在膀胱癌中的表达及作用。
1 材料与方法 1.1 主要试剂和仪器胎牛血清(Gibco公司,澳大利亚),RPMI-1640培养液(Thermo公司,美国),CBS抗体(Abnova公司,美国),CSE抗体(Santa Cruz公司,美国),全蛋白提取试剂盒和MTT细胞增殖及细胞毒性检测试剂盒(南京凯基生物)。HERA cell-150 CO2细胞培养箱和Multiskan GO全波长酶标仪 (Thermo公司,美国),PXS-270型离子计(上海雷磁仪器厂),DYY-6C型双稳定时电泳仪(北京六一仪器厂)。
1.2 细胞培养和分组膀胱癌细胞株(5637、T24、EJ和UM-UC-3)及人膀胱上皮永生化细胞株SV-HUC-1由清华大学第一附属医院泌尿医学中心提供,培养在10%胎牛血清的RPMI-1640培养液中,置于37℃、5% CO2培养箱内。根据前期实验结果选取EJ细胞进行药物处理并分组如下:① 10 μmol·L-1 NaHS组、50 μmol·L-1 NaHS组、100 μmol·L-1 NaHS组和对照组;②参照参考文献[8]设顺铂组(5 μg·L-1)和顺铂(5 μg·L-1)+ NaHS(100 μmol·L-1)组,另设无药物处理为对照组。
1.3 Western blotting法检测膀胱癌细胞株和膀胱正常细胞株中CBS和CSE蛋白表达按全蛋白提取试剂盒说明书操作提取细胞总蛋白,以BCA法测定蛋白浓度。各泳道蛋白上样总量为50 μg,加入5×样品缓冲液,95℃水浴变性5 min。样品蛋白经SDS-聚丙烯酰胺凝胶电泳分离,电转移至PVDF膜上,5%脱脂奶粉室温封闭1 h,加一抗4℃孵育过夜,清洗膜3次(每次5 min)后,加二抗室温孵育1 h,弃二抗,振荡清洗3次,ECL显影。凝胶图像分析系统检测条带灰度值,蛋白相对表达水平=目的条带灰度值/GADPH条带灰度值。
1.4 敏感硫电极法检测膀胱癌细胞株和膀胱正常细胞株中H2S产率参考耿彬等[9]实验方法,制备10%细胞匀浆。取500 μL匀浆液,Bradford法蛋白定量后移至25 mL反应瓶,加入反应液(100 mmol·L-1磷酸缓冲液,pH 7.4;10 mmol·L-1左旋半胱氨酸;2 mmol·L-1磷酸吡多醛),反应瓶内小烧杯中加入NaOH(1 mol·L-1)0.5 mL,用氮气将锥形瓶充盈20 s后,石蜡膜封口。将反应瓶置于37℃水浴中孵育90 min,加入50%三氯乙酸500 μL,37℃再孵育60 min后终止反应。取中央孔液体用敏感硫电极法测定溶液中H2S水平,并计算H2S产率。H2S产率=H2S水平/匀浆蛋白水平/反应时间,结果以nmol·mg-1·min-1表示。
1.5 MTT法检测各组细胞生存率按MTT试剂盒说明书操作。在96孔板上每孔中加入细胞100 μL(约1×104个细胞)培养24 h。按实验分组处理。药物处理后,96孔板置于培养箱继续培养48 h。每孔加50μL 1×MTT,37℃孵育4 h,平板摇床摇匀,使MTT还原为甲臜,酶标仪在550 nm波长处检测每孔的吸光度(A)值,以A值表示细胞增殖活性。
1.6 流式细胞术AnnexinⅤ-FITC/PI双染法检测各组细胞凋亡率 取对数生长期的EJ细胞,将1 mL细胞悬液(细胞数 4×105 mL-1)接种于6孔板,37℃、5% CO2培养箱中培养48 h。按实验分组处理细胞后继续培养48 h。胰酶消化细胞收集于离心管,PBS 洗涤1次,离心,弃上清液,将细胞悬浮于100 μL PBS中,每管加 Annexin Ⅴ- FITC 5 μL,PI 2.5 μL,震荡混匀后置冰上避光染色10 min,每管加400 μL 1×Buffer,经流式细胞术检测细胞凋亡情况。结果判定方法:左上象限数值为坏死细胞(FITC-/ PI+),左下象限数值为活细胞(FITC-/PI-),右上象限数值为晚期凋亡或凋亡继发坏死细胞(FITC+/ PI+),右下象限数值为早期凋亡细胞(FITC+/ PI-)。
1.7 统计学分析采用SPSS 18.0 统计软件对数据进行分析处理。各组细胞株中CBS和CSE蛋白表达水平、H2S产率、细胞生存率和细胞凋亡率等数据均以x±s表示,多组间样本均数比较采用单因素方差分析。以P<0.05表示差异有统计学意义。
2 结 果 2.1 Western blotting 法检测各组细胞株中CBS和CSE蛋白表达膀胱癌细胞株(5637、T24、EJ和UM-UC-3)中CBS和CSE蛋白表达水平高于人膀胱永生化上皮细胞SV-HUC-1,且差异均有统计学意义(P<0.05),其中EJ细胞株中CBS和CSE表达水平较SV-HUC-1细胞株升高更为明显(P<0.01)。见图 1。
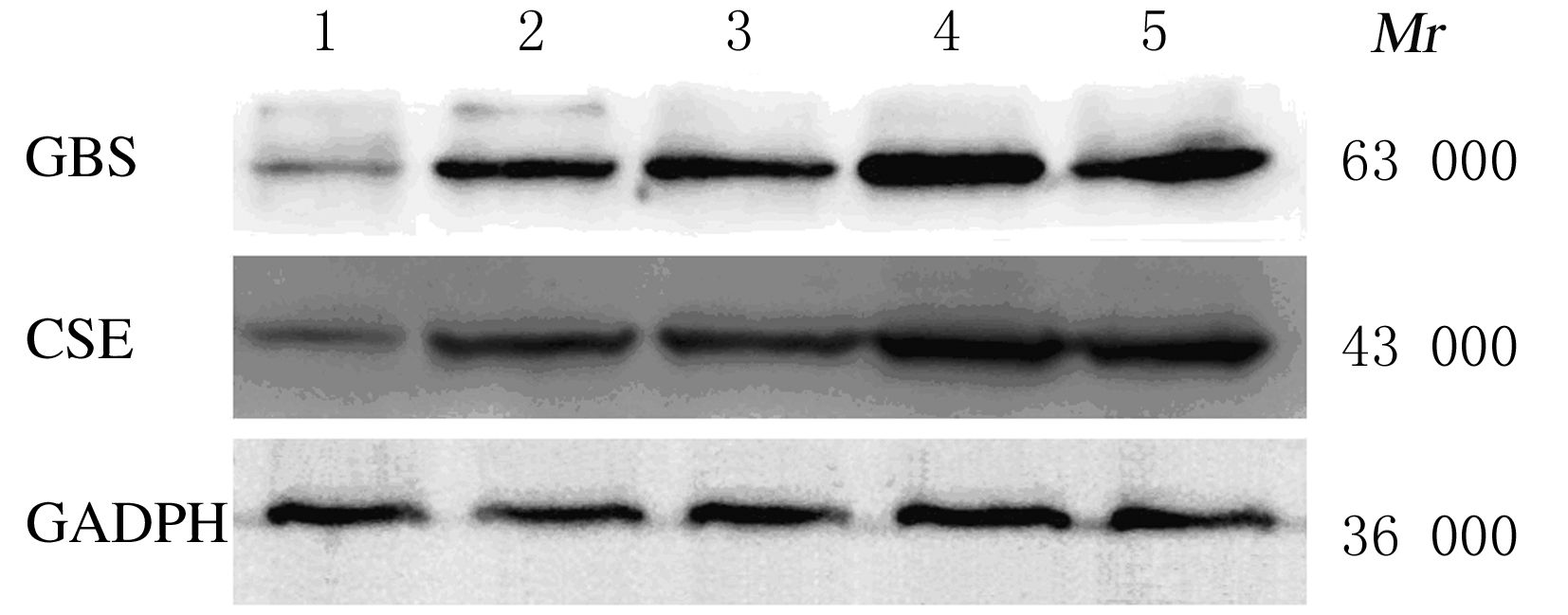
|
| 图 1 Western blotting法检测膀胱细胞株中CBS和CSE蛋白表达电泳图 Figure 1 Electrophoregram of expressions of CBS and CSE protein in bladder cell lines detected by Western blotting assay |
|
|
SV-HUC-1、5637、T24、EJ和UM-UC-3细胞中H2S产率分别为(9.20±1.83)、(23.70±2.14)、(27.80±3.57)、(60.50±2.36)和(42.40±2.11) nmol·mg-1·min-1。与膀胱正常上皮细胞SV-HUC-1比较,5637、T24、EJ和UM-UC-3细胞中H2S产率均明显升高(P<0.05),并以EJ细胞株升高最明显(P<0.01)。
2.3 MTT法检测NaHS处理EJ细胞后的细胞增殖活性外源性NaHS可提高细胞增殖活性,与对照组比较差异有统计学意义(P<0.05),且随着NaHS剂量增加,细胞增殖活性呈上升趋势,各NaHS组组间比较差异均有统计学意义(P<0.05)。见表 1。
| (n=9,x±s) | ||
| Group | A value | |
| (t/h) 24 | 48 | |
| Control | 0.409±0.003 | 0.713±0.001 |
| 10μmol·L-1 NaHS | 0.431±0.001* | 0.792±0.003* |
| 50μmol·L-1 NaHS | 0.458±0.003*△ | 0.837±0.002*△ |
| 100μmol·L-1 NaHS | 0.494±0.002*△# | 0.965±0.004*△# |
| *P<0.05 compared with control group;△P<0.05 compared with 10 μmol·L-1 NaHS group;#P<0.05 compared with 50 μmol·L-1 NaHS group. | ||
与对照组比较,顺铂组和顺铂+NaHS组药物处理后,细胞增殖活性均明显下降。而与顺铂组比较,顺铂+NaHS组EJ细胞的细胞增殖活性明显升高(P<0.05)。见表 2。
| (n=9,x±s) | |||
| Group | A value | Early apoptotic rate (η/%) | Total apoptotic rate (η/%) |
| Control | 0.713±0.001 | 1.79±0.52 | 5.29±1.25 |
| Cisplatin | 0.354±0.004* | 27.32±3.23* | 35.88±4.68* |
| Cisplatin+ NaHS | 0.544±0.002*△ | 10.82±2.14*△ | 17.46±1.81*△ |
| *P<0.05 compared with control group; △P<0.05 compared with cisplatin group. | |||
与对照组比较,顺铂组和顺铂+NaHS组药物处理后,细胞凋亡率均升高。与顺铂组比较,顺铂+NaHS组EJ细胞凋亡率明显下降(P<0.05)。见表 2和图 2。
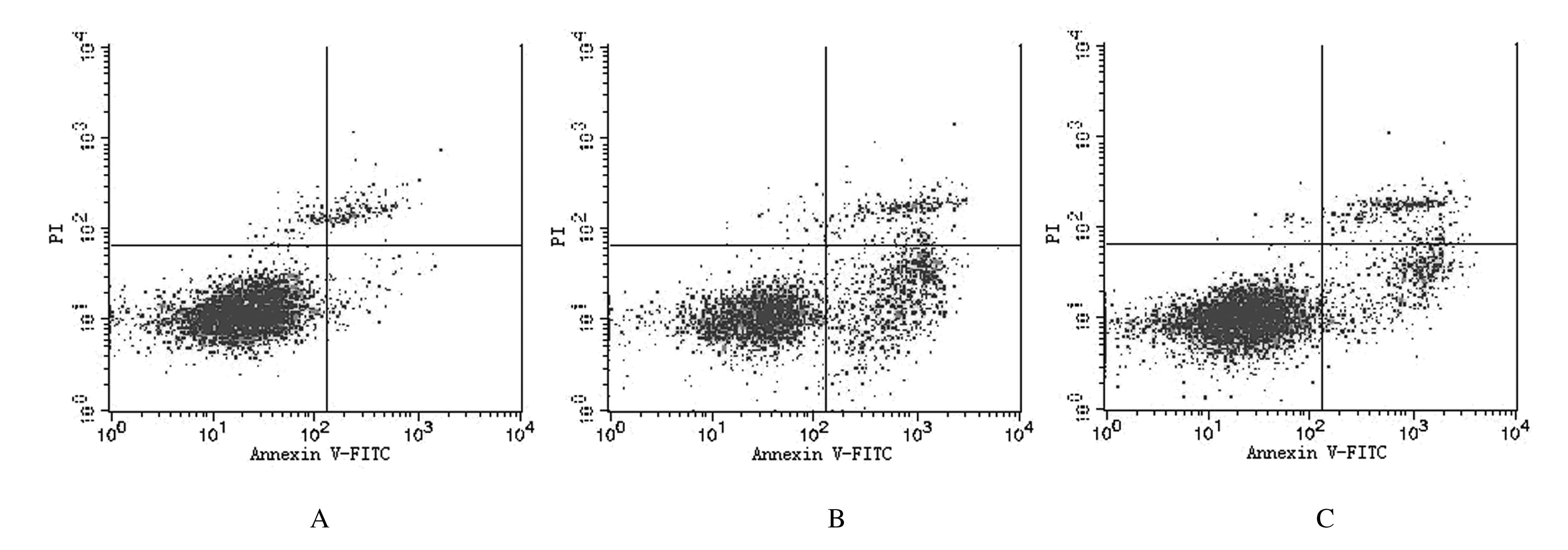
|
| 图 2 流式细胞术检测不同药物处理48 h后各组细胞凋亡率 Figure 2 Apoptotic rates of cells in various groups after treated with different drugs detected by flow cytometry for 48 h |
|
|
人体内H2S由重要的一碳单位供体蛋氨酸经转硫途径变为半胱氨酸后,主要由CBS和CSE催化合成[10]。H2S合成酶分布具有组织特异性,神经系统内主要存在CBS表达 [11];主动脉、肺动脉、肠系膜动脉、尾动脉、门静脉和心肌组织中有CSE表达而无CBS表达[12];回肠黏膜等则同时存在有CBS和CSE表达[13]。本实验结果显示:在膀胱癌及膀胱正常上皮细胞株中,CBS和CSE均有表达,且在膀胱癌细胞中2种酶的表达水平明显高于膀胱正常上皮细胞,这为探讨H2S及其合成酶与膀胱癌的关系提供了实验基础,H2S及其合成酶的这种异常表达亦有可能成为膀胱癌诊断的新标志物。
调节细胞增殖与凋亡是内源性H2S发挥作用的主要途径之一。在结肠癌和卵巢癌等肿瘤细胞中,内源性H2S主要发挥促细胞增殖的作用[13],H2S水平增加可促进肿瘤增殖和迁移[14],而降低细胞H2S水平则明显促进肿瘤细胞的凋亡[15]。Sen等[16]研究发现:肿瘤坏死因子α可通过促使转录因子SP1与CSE基因增强子结合,提高CSE蛋白表达,从而增加H2S合成;H2S与NF-κB的P65亚单位发生巯基化反应,进一步促使NF-κB与共活化核糖体蛋白S3结合,上调下游抗凋亡基因的表达,进而起到抗凋亡的作用。本研究结果显示:膀胱癌细胞中的H2S及其合成酶水平明显高于膀胱正常上皮细胞,而外源性供给H2S后,随着剂量的增加和/或药物作用时间的延长,可明显上调膀胱癌EJ细胞的增殖活力,这与文献报道[14-15]结果相符,说明H2S及其合成酶具有促肿瘤细胞增殖的作用,进一步推测Sen等[16]报道的途径可能是膀胱癌异常增殖逃避凋亡的途径之一。
耐药性是临床肿瘤化疗失败的主要因素之一,基于顺铂的化疗方案,如顺铂和吉西他滨(GC)、顺铂联合甲氨蝶呤、长春碱和多柔比星(MVAC)方案被认为是晚期膀胱癌标准的化疗方案[17],但膀胱癌晚期患者常因顺铂耐药而导致化疗失败,因此减少肿瘤细胞顺铂耐药对晚期膀胱癌治疗至关重要。本研究MTT法及流式细胞术实验结果显示:顺铂对膀胱癌EJ细胞具有明显的抑制增殖和促凋亡作用,而外源性H2S干预后,膀胱癌细胞抗顺铂凋亡的能力明显增强,细胞增殖活性亦增强,说明膀胱癌细胞能借助H2S抵抗顺铂的细胞凋亡作用,进行恶性增殖。研究[18]报道:CSE特异性抑制剂炔丙基甘氨酸(PPG)可提高顺铂在膀胱癌中的疗效,这与本研究结果相符。Bhattacharyya等[19]研究结果显示:在卵巢癌细胞中降低CBS表达减少H2S合成后,降低了还原型谷胱甘肽(GSH)水平或降低过氧化氢酶和超氧化物歧化酶的酶活性,从而增加活性氧自由基的产生,而这可导致脱氧核糖核酸的损伤,同时可增强癌细胞对顺铂的敏感性。Ahn等[20]认为:GSH的降低可增强顺铂对膀胱癌细胞株的细胞毒性作用,其表达水平和膀胱癌细胞系顺铂耐药及阿霉素耐药呈正相关关系。H2S在体内代谢的终末产物正是还原性物质GSH,结合本研究结果,癌细胞可能通过上调H2S及合成酶水平,以增加GSH水平,从而抵御顺铂的细胞毒性作用,这可能是膀胱癌顺铂耐药的机制之一。
综上所述,H2S及其合成酶CBS和CSE在膀胱癌细胞系和膀胱正常上皮细胞系中均有表达,在膀胱癌细胞系中H2S及其合成酶表达较膀胱正常上皮细胞明显增加,外源性H2S可增强膀胱癌EJ细胞的增殖活力,可减弱顺铂介导的细胞凋亡。
| [1] | 韩苏军, 张思维, 陈万青, 等. 中国膀胱癌发病现状及流行趋势分析[J]. 癌症进展 , 2013, 1 (11) : 89–95. |
| [2] | Ismaili N, Amzerin M, Flechon A. Chemotherapy in advanced bladder cancer:current status and future[J]. J Hematol Oncol , 2011, 4 (1) : 35–46. DOI:10.1186/1756-8722-4-35 |
| [3] | Dursun M, Otunctemur A, Ozbek E, et al. Protective effect of hydrogen sulfide on renal injury in the experimental unilateral ureteral obstruction[J]. Int Braz J Urol , 2015, 41 (6) : 1185–1193. DOI:10.1590/S1677-5538.IBJU.2014.0090 |
| [4] | Kuo MM, Kim DH, Jandu S, et al. MPST but not CSE is the primary regulator of hydrogen sulfide production and function in the coronary artery[J]. Am J Physiol Heart Circ Physiol , 2016, 310 (1) : H71–79. DOI:10.1152/ajpheart.00574.2014 |
| [5] | Giangregorio N, Tonazzi A, Console L, et al. The mitochondrial carnitine/acylcarnitine carrier is regulated by hydrogen sulfide via interaction with C136 and C155[J]. Biochim Biophys Acta , 2016, 1860 (1PtA) : 20–27. |
| [6] | Zheng Y, Ji X, Ji K, et al. Hydrogen sulfide prodrugs-a review[J]. Acta Pharm Sin B , 2015, 5 (5) : 367–377. DOI:10.1016/j.apsb.2015.06.004 |
| [7] | Szabo C, Coletta C, Chao C, et al. Tumor-derived hydrogen sulfide, produced by cystathionine-β-synthase, stimulates bioenergetics, cell proliferation, and angiogenesis in colon cancer[J]. Proc Natl Acad Sci USA , 2013, 110 (30) : 12474–12479. DOI:10.1073/pnas.1306241110 |
| [8] | 王志, 张艺, 黄亚琴, 等. 干性基因Nanog在膀胱癌组织中的表达及其对膀胱癌细胞增殖与耐药的作用[J]. 第三军医大学学报 , 2014, 36 (7) : 655–658. |
| [9] | 耿彬, 杜军保, 唐朝枢. 敏感硫电极法在测定心血管组织细胞及血浆胱硫醚-γ-裂解酶/硫化氢的应用[J]. 北京大学学报:医学版 , 2005, 37 (5) : 545–548. |
| [10] | Kimura H. Hydrogen sulfide:its production, release and functions[J]. Amino Acids , 2011, 41 (1) : 113–121. DOI:10.1007/s00726-010-0510-x |
| [11] | 李倩, 刘春风, 胡丽芳. 气体信号分子NO、CO和H2S的生物学研究进展[J]. 生理科学进展 , 2014, 45 (5) : 395–398. |
| [12] | Geng B, Yang J, Qi Y, et al. H2S generated by heart in rat and its effects on cardiac function[J]. Biochem Biophys Res Commun , 2004, 313 (2) : 362–368. DOI:10.1016/j.bbrc.2003.11.130 |
| [13] | Xu GY, Winston JH, Shenoy M, et al. The endogenous hydrogen sulfide producing enzyme cystathionine-beta synthase contributes to visceral hypersensitivity in a rat model of irritable bowel syndrome[J]. Mol Pain , 2009, 5 (1) : 44–52. DOI:10.1186/1744-8069-5-44 |
| [14] | 洪敏, 唐小卿, 何葵. 硫化氢对人结肠癌细胞增殖和迁移的影响[J]. 南方医科大学学报 , 2014, 24 (5) : 699–703. |
| [15] | Wang TX, Shi XY, Liu YH. Endogenous cystathionine-gamma-lyase/hydrogen sulfide pathway regulates apoptosis of HepG2 cells[J]. Acta Pharm Sin , 2013, 48 (8) : 1233–1240. |
| [16] | Sen N, Paul BD, Gadalla MM, et al. Hydrogen sulfide-linked sulfhydration of NF-κB mediates its antiapoptotic actions[J]. Mol Cell , 2012, 45 (1) : 13–24. DOI:10.1016/j.molcel.2011.10.021 |
| [17] | 魏晓龙, 郭和清. 晚期膀胱癌化疗进展[J]. 微创泌尿外科杂志 , 2013, 2 (2) : 146–150. |
| [18] | Satoh M, Kloth DM, Kadhim SA, et al. Modulation of both cisplatin nephrotoxicity and drug resistance in murine bladder tumor by controlling metallothionein synthesis[J]. Cancer Res , 1993, 53 (8) : 1829–1832. |
| [19] | Bhattacharyya S, Saha S, Giri K, et al. Cystathionine beta-synthase (CBS) contributes to advanced ovarian cancer progression and drug resistance[J]. PLoS One , 2013, 8 (11) : e79167. DOI:10.1371/journal.pone.0079167 |
| [20] | Ahn H, Lee E, Kim K, et al. Effect of glutathione and its related enzymes on chemosensitivity of renal cell carcinoma and bladder carcinoma cell lines[J]. J Urol , 1994, 151 (1) : 263–267. |
 2016, Vol. 42
2016, Vol. 42


